Iloperidone (fanapt) Pełna informacja na receptę
Nazwa marki: Fanapt
Nazwa ogólna: iloperidon
Fanapt (Iloperidone) Przewodnik po przepisywaniu (PDF)
Zawartość:
Ostrzeżenie w pudełku
Wskazania i zastosowanie
Dawkowanie i sposób podawania
Przeciwwskazania
Ostrzeżenia i środki
Działania niepożądane
Interakcje z lekami
Użyj w określonych populacjach
Nadużywanie narkotyków i uzależnienie
Przedawkować
Opis
Farmakologia kliniczna
Toksykologia niekliniczna
Studia kliniczne
Jak dostarczone
Przewodnik po lekach Brintellix
OSTRZEŻENIE: ZWIĘKSZONA Śmiertelność u starszych pacjentów z psychozą związaną z demencją
Starsi pacjenci z psychozą związaną z otępieniem leczeni lekami przeciwpsychotycznymi są narażeni na zwiększone ryzyko śmierci. FANAPT nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z demencją.
Wskazania i zastosowanie
FANAPT® jest wskazany w leczeniu schizofrenii u dorosłych.
Przy podejmowaniu decyzji o alternatywnych metodach leczenia tego stanu lekarz przepisujący powinien wziąć pod uwagę odkrycie, że FANAPT wiąże się z wydłużeniem odstępu QTc. Wydłużenie odstępu QTc jest związane z niektórymi innymi lekami ze zdolnością do powodowania dezaktywacji torsade arytmia punktowa, potencjalnie śmiertelny polimorficzny częstoskurcz komorowy, który może spowodować nagłe śmierć. W wielu przypadkach doprowadziłoby to do wniosku, że najpierw należy wypróbować inne leki. To, czy FANAPT spowoduje torsade de pointes, czy zwiększy wskaźnik nagłej śmierci, nie jest jeszcze znane.
Należy zwiększyć dawkę do skutecznej dawki FANAPT. Tak więc kontrola objawów może być opóźniona w ciągu pierwszych 1–2 tygodni leczenia w porównaniu z niektórymi innymi lekami przeciwpsychotycznymi, które nie wymagają podobnego zwiększania dawki. Lekarze powinni pamiętać o tym opóźnieniu przy wyborze leku przeciwpsychotycznego do leczenia schizofrenii.
kontynuuj historię poniżej
Dawkowanie i sposób podawania
Zwykła dawka
FANAPT należy stopniowo zwiększać od niskiej dawki początkowej, aby uniknąć niedociśnienia ortostatycznego z powodu jego właściwości blokujących receptory alfa-adrenergiczne. Zalecana dawka początkowa tabletek FANAPT wynosi 1 mg doustnie dwa razy na dobę. Zwiększenia dawki, aby osiągnąć docelowy zakres 6-12 mg dwa razy na dobę (12_24 mg / dzień), można dokonać z codzienną modyfikacją dawki, tak aby nie przekraczać 2 mg dwa razy na dobę (4 mg / dzień). Maksymalna zalecana dawka wynosi 12 mg dwa razy na dobę (24 mg / dobę). Dawki FANAPT powyżej 24 mg / dobę nie były systematycznie oceniane w badaniach klinicznych. Skuteczność FANAPT wykazano w zakresie dawek od 6 do 12 mg dwa razy na dobę. Lekarze przepisujący lek powinni pamiętać o tym, że pacjenci muszą być dostosowani do skutecznej dawki FANAPT. Tak więc kontrola objawów może być opóźniona podczas pierwszych 1–2 tygodni leczenia w porównaniu z innymi lekami przeciwpsychotycznymi, które nie wymagają podobnego zwiększania dawki. Lekarze przepisujący lek powinni także pamiętać, że niektóre działania niepożądane związane ze stosowaniem FANAPT są zależne od dawki. FANAPT można podawać niezależnie od posiłków.
Dawkowanie w szczególnych populacjach
Dostosowanie dawki u pacjentów przyjmujących FANAPT jednocześnie z potencjalnymi inhibitorami CYP2D6: Dawka FANAPT powinna wynosić zmniejszona o połowę przy jednoczesnym podawaniu z silnymi inhibitorami CYP2D6, takimi jak fluoksetyna lub paroksetyna. Gdy inhibitor CYP2D6 zostanie wycofany z terapii skojarzonej, dawkę FANAPT należy następnie zwiększyć do wcześniejszego poziomu.
Dostosowanie dawki u pacjentów przyjmujących FANAPT jednocześnie z potencjalnymi inhibitorami CYP3A4: Dawka FANAPT powinna wynosić zmniejszona o połowę przy jednoczesnym podawaniu z silnymi inhibitorami CYP3A4, takimi jak ketokonazol lub klarytromycyna. Po odstawieniu inhibitora CYP3A4 z terapii skojarzonej dawkę FANAPT należy zwiększyć do miejsca, w którym była wcześniej.
Dostosowanie dawki u pacjentów przyjmujących FANAPT, którzy mają słaby metabolizm CYP2D6: Dawka FANAPT powinna zostać zmniejszona o połowę w przypadku słabego metabolizmu CYP2D6.
Zaburzenia czynności wątroby: Nie ma konieczności dostosowania dawki FANAPT u pacjentów z łagodnymi zaburzeniami czynności wątroby. Pacjenci z umiarkowanymi zaburzeniami czynności wątroby mogą wymagać zmniejszenia dawki, jeśli jest to klinicznie wskazane. FANAPT nie jest zalecany u pacjentów z ciężkimi zaburzeniami czynności wątroby.
Leczenie podtrzymujące
W długoterminowym badaniu FANAPT skutecznie opóźniał czas do nawrotu u pacjentów ze schizofrenią, u których stabilizowano FANAPT do 24 mg / dobę. Pacjentów należy okresowo poddawać ponownej ocenie w celu ustalenia potrzeby leczenia podtrzymującego.
Ponowne rozpoczęcie leczenia u pacjentów, które wcześniej przerwano Chociaż nie ma danych, które mogłyby konkretnie dotyczyć ponownego rozpoczęcia leczenia W trakcie leczenia zaleca się przestrzeganie harmonogramu dostosowywania dawki za każdym razem, gdy u pacjentów odstęp FANAPT wynosił więcej niż 3 dni.
Top
Postacie dawkowania i mocne strony
Tabletki FANAPT są dostępne w następujących mocach: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg i 12 mg. Tabletki są białe, okrągłe, płaskie, ze ściętymi krawędziami i oznaczone logo „” wytłoczonym po jednej stronie i siłą tabletki „1”, „2”, „4”, „6”, „8”, „10”, lub „12” wytłoczony po drugiej stronie.
Top
Przeciwwskazania
FANAPT jest przeciwwskazany u osób ze znaną reakcją nadwrażliwości na produkt. Zgłaszano anafilaksję, obrzęk naczynioruchowy i inne reakcje nadwrażliwości.
Top
OSTRZEŻENIA I ŚRODKI
Zwiększona śmiertelność u pacjentów w podeszłym wieku z psychozą związaną z demencją
Leki przeciwpsychotyczne zwiększają ogólne ryzyko śmierci u starszych pacjentów z psychozą związaną z demencją. Analizy 17 badań psychoz związanych z otępieniem, kontrolowanych placebo (modalny czas trwania 10 tygodni, głównie u pacjentów przyjmujących atypowe leki przeciwpsychotyczne) ujawniły ryzyko śmierci u pacjentów leczonych lekami od 1,6 do 1,7 razy większe niż u pacjentów otrzymujących placebo. W trakcie typowego 10-tygodniowego kontrolowanego badania wskaźnik zgonów u pacjentów leczonych lekami wynosił około 4,5%, w porównaniu do około 2,6% u pacjentów otrzymujących placebo.
Chociaż przyczyny zgonów były różne, większość zgonów miała charakter sercowo-naczyniowy (np. Niewydolność serca, nagła śmierć) lub zakaźna (np. Zapalenie płuc). FANAPT nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z demencją.
Niekorzystne reakcje naczyniowo-mózgowe, w tym udar mózgu, u pacjentów w podeszłym wieku z psychozą związaną z demencją
W kontrolowanych placebo badaniach u osób w podeszłym wieku z otępieniem pacjenci losowo przydzieleni do rysperydonu, arypiprazol i olanzapina miały większą częstość występowania udaru mózgu i przemijającego ataku niedokrwiennego, w tym śmiertelnego uderzenie. FANAPT nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z demencją.
Przedłużenie QT
W otwartym badaniu QTc u pacjentów ze schizofrenią lub zaburzeniem schizoafektywnym (n = 160) FANAPT wiązał się z wydłużeniem odstępu QTc o 9 milisekund przy dawce iloperidonu 12 mg dwa razy na dobę. Wpływ FANAPT na odstęp QT został zwiększony przez obecność hamowania metabolizmu CYP450 2D6 lub 3A4 (odpowiednio paroksetyna 20 mg raz na dobę i ketokonazol 200 mg dwa razy na dobę). W warunkach hamowania metabolicznego zarówno dla 2D6, jak i 3A4, FANAPT w dawce 12 mg dwa razy na dobę wiązał się ze średnim wzrostem QTcF w stosunku do wartości wyjściowej wynoszącym około 19 ms.
Podczas programu klinicznego przed wprowadzeniem do obrotu nie zaobserwowano przypadków torsade de pointes ani innych ciężkich zaburzeń rytmu serca.
Należy unikać stosowania FANAPT w połączeniu z innymi lekami, o których wiadomo, że wydłużają odstęp QTc, w tym z klasą 1A (np. Chinidyna, prokainamid) lub leki przeciwarytmiczne klasy III (np. amiodaron, sotalol), leki przeciwpsychotyczne (np. chlorpromazyna, tiorydazyna), antybiotyki (np. gatifloksacyna, moksyfloksacyna) lub inna klasa leków, o których wiadomo, że wydłużają odstęp QTc (np. pentamidyna, octan lewometadylu, metadon). FANAPT należy także unikać u pacjentów z wrodzonym zespołem długiego odstępu QT oraz u pacjentów z zaburzeniami rytmu serca w wywiadzie.
Niektóre okoliczności mogą zwiększać ryzyko wystąpienia torsade de pointes i / lub nagłej śmierci w związku ze stosowaniem leków przedłużających odstęp QTc, w tym (1) bradykardia; (2) hipokaliemia lub hipomagnezemia; (3) równoczesne stosowanie innych leków przedłużających odstęp QTc; i (4) obecność wrodzonego wydłużenia odstępu QT; (5) niedawny ostry zawał mięśnia sercowego; i / lub (6) niewyrównana niewydolność serca.
Należy zachować ostrożność przepisując FANAPT z lekami hamującymi metabolizm FANAPT oraz u pacjentów ze zmniejszoną aktywnością CYP2D6.
Zaleca się, aby wziąć pod uwagę pacjentów poddanych leczeniu FANAPT, u których ryzyko jest znaczne zaburzenia elektrolitowe mają okresowe pomiary stężenia potasu i magnezu w surowicy monitorowanie Hipokaliemia (i / lub hipomagnezemia) może zwiększać ryzyko wydłużenia odstępu QT i arytmii. FANAPT należy unikać u pacjentów z historią znaczących chorób sercowo-naczyniowych, np. QT przedłużenie, niedawny ostry zawał mięśnia sercowego, niewyrównana niewydolność serca lub arytmia serca. FANAPT należy przerwać u pacjentów, u których stwierdzono trwałe pomiary QTc> 500 ms.
Jeśli u pacjentów przyjmujących FANAPT wystąpią objawy, które mogą wskazywać na występowanie zaburzeń rytmu serca, np. zawroty głowy, kołatanie serca lub omdlenia, lekarz przepisujący lek powinien rozpocząć dalszą ocenę, w tym kardiologiczną monitorowanie
Złośliwy zespół neuroleptyczny (NMS)
Zgłaszano potencjalnie śmiertelny kompleks objawów, czasami określany jako złośliwy zespół neuroleptyczny (NMS), w związku z podawaniem leków przeciwpsychotycznych, w tym FANAPT. Objawy kliniczne obejmują hiperpreksję, sztywność mięśni, zmieniony stan psychiczny (w tym objawy katatoniczne) i dowody niestabilności autonomicznej (nieregularny puls lub ciśnienie krwi, tachykardia, obfite pocenie się i serce zaburzenia rytmu serca). Dodatkowe objawy mogą obejmować podwyższoną aktywność fosfokinazy kreatynowej, mioglobinurię (rabdomioliza) i ostrą niewydolność nerek. Ocena diagnostyczna pacjentów z tym zespołem jest skomplikowana. Przy ustalaniu diagnozy ważne jest, aby zidentyfikować przypadki, w których obejmuje prezentacja kliniczna zarówno poważne choroby medyczne, jak i nieleczone lub niewłaściwie leczone objawy pozapiramidowe (EPS). Inne ważne uwagi w diagnostyce różnicowej obejmują centralną toksyczność antycholinergiczną, udar cieplny, gorączkę polekową i patologię pierwotnego ośrodkowego układu nerwowego (CNS).
Postępowanie w przypadku tego zespołu powinno obejmować: (1) natychmiastowe odstawienie leków przeciwpsychotycznych i innych leków nieistotnych dla równoczesnego leczenia, (2) intensywne leczenie objawowe i monitorowanie medyczne oraz (3) leczenie wszelkich towarzyszących poważnych problemów medycznych, dla których dostępne są określone metody leczenia. Nie ma ogólnej zgody co do konkretnych schematów leczenia farmakologicznego NMS.
Jeśli pacjent wymaga leczenia przeciwpsychotycznego po wyleczeniu z NMS, należy dokładnie rozważyć potencjalne ponowne wprowadzenie terapii lekowej. Pacjenta należy uważnie monitorować, ponieważ zgłaszano nawroty NMS.
Późne dyskinezy
Późne dyskinezy to zespół polegający na potencjalnie nieodwracalnych, mimowolnych ruchach dyskinetycznych, które mogą rozwinąć się u pacjentów leczonych lekami przeciwpsychotycznymi. Chociaż występowanie tego zespołu wydaje się być najwyższe wśród osób starszych, zwłaszcza starszych kobiet, jest to niemożliwe polegają na szacunkach rozpowszechnienia, aby przewidzieć, na początku leczenia przeciwpsychotycznego, u których pacjentów prawdopodobnie rozwinie się zespół. Nie wiadomo, czy leki przeciwpsychotyczne różnią się potencjałem powodowania późnych dyskinez.
Uważa się, że istnieje ryzyko wystąpienia późnych dyskinez i prawdopodobieństwo, że stanie się ono nieodwracalne zwiększa się wraz z czasem trwania leczenia i całkowitą łączną dawką podawanego leku przeciwpsychotycznego wzrasta. Jednak syndrom może rozwinąć się, choć znacznie rzadziej, po stosunkowo krótkich okresach leczenia przy niskich dawkach.
Nie jest znane leczenie ustalonych przypadków późnych dyskinez, chociaż zespół może ustąpić częściowo lub całkowicie, jeśli leczenie przeciwpsychotyczne zostanie przerwane. Jednak samo leczenie przeciwpsychotyczne może tłumić (lub częściowo tłumić) oznaki i objawy zespołu, a tym samym może maskować leżący u jego podstaw proces. Wpływ tłumienia objawów na długoterminowy przebieg zespołu jest nieznany.
Biorąc pod uwagę te względy, FANAPT powinien być przepisywany w sposób, który najprawdopodobniej zminimalizuje występowanie późnych dyskinez. Przewlekłe leczenie przeciwpsychotyczne powinno być zasadniczo zarezerwowane dla pacjentów cierpiących na przewlekłą chorobę, na którą (1) wiadomo, że reaguje leki przeciwpsychotyczne i (2) dla których alternatywne, równie skuteczne, ale potencjalnie mniej szkodliwe metody leczenia nie są dostępne lub właściwy. U pacjentów wymagających przewlekłego leczenia należy poszukiwać najmniejszej dawki i najkrótszego czasu leczenia zapewniającego zadowalającą odpowiedź kliniczną. Konieczność kontynuowania leczenia należy okresowo poddawać ponownej ocenie.
Jeśli u pacjenta leczonego preparatem FANAPT pojawią się objawy późnej dyskinezy, należy rozważyć odstawienie leku. Jednak niektórzy pacjenci mogą wymagać leczenia FANAPT pomimo obecności zespołu.
Zmiany metaboliczne
Nietypowe leki przeciwpsychotyczne są związane ze zmianami metabolicznymi, które mogą zwiększać ryzyko sercowo-naczyniowe / mózgowo-naczyniowe. Te zmiany metaboliczne obejmują hiperglikemię, dyslipidemię i przyrost masy ciała. Chociaż wykazano, że wszystkie nietypowe leki przeciwpsychotyczne wywołują pewne zmiany metaboliczne, każdy lek w tej klasie ma swój własny profil ryzyka.
Hiperglikemia i cukrzyca
U pacjentów leczonych atypowymi lekami przeciwpsychotycznymi, w tym FANAPT, zgłaszano hiperglikemię, w niektórych przypadkach skrajną i związaną z kwasicą ketonową, śpiączką hiperosmolarną lub śmiercią. Ocena związku między nietypowym stosowaniem leków przeciwpsychotycznych a zaburzeniami glukozy jest skomplikowana z powodu możliwości ryzyko cukrzycy w tle u chorych na schizofrenię i rosnące występowanie cukrzycy w ogóle populacja. Biorąc pod uwagę te czynniki zakłócające, związek między nietypowym stosowaniem leków przeciwpsychotycznych a zdarzeniami niepożądanymi związanymi z hiperglikemią nie jest do końca poznany. Jednak badania epidemiologiczne wskazują na zwiększone ryzyko zdarzeń niepożądanych związanych z hiperglikemią u pacjentów leczonych atypowymi lekami przeciwpsychotycznymi objętymi tymi badaniami.
Pacjenci z rozpoznaną cukrzycą, którzy rozpoczynają leczenie atypowymi lekami przeciwpsychotycznymi, powinni być regularnie monitorowani pod kątem pogorszenia kontroli glikemii. Pacjenci z czynnikami ryzyka cukrzycy (np. Otyłość, cukrzyca w rodzinie), którzy rozpoczynają leczenie atypowe leki przeciwpsychotyczne powinny być poddawane testom glikemicznym na czczo na początku leczenia i okresowo w trakcie leczenie. Każdy pacjent leczony atypowymi lekami przeciwpsychotycznymi powinien być monitorowany pod kątem objawów hiperglikemii, w tym polidypsji, poliurii, polifagii i osłabienia. Pacjenci, u których podczas leczenia atypowymi lekami przeciwpsychotycznymi wystąpią objawy hiperglikemii, powinni przejść badanie glikemii na czczo. W niektórych przypadkach hiperglikemia ustąpiła po odstawieniu atypowego leku przeciwpsychotycznego; jednak niektórzy pacjenci wymagali kontynuacji leczenia przeciwcukrzycowego pomimo odstawienia podejrzanego leku.
Dane z 4-tygodniowego badania z ustaloną dawką u dorosłych pacjentów ze schizofrenią, w którym pobrano próbki krwi na czczo, przedstawiono w tabeli 1.
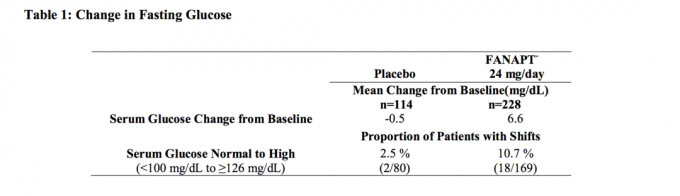
Sumaryczne analizy danych dotyczących poziomu glukozy z badań klinicznych, w tym badań długoterminowych, przedstawiono w tabeli 2.
Dyslipidemia
U pacjentów leczonych atypowymi lekami przeciwpsychotycznymi obserwowano niepożądane zmiany lipidów.
Dane z kontrolowanego placebo, 4-tygodniowego badania z ustaloną dawką, w którym pobierano próbki krwi na czczo, u dorosłych pacjentów ze schizofrenią przedstawiono w tabeli 3.

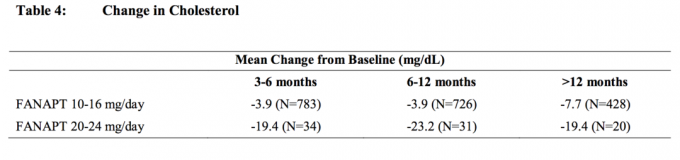
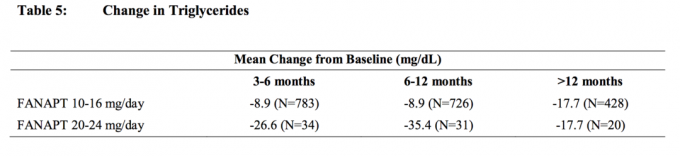
Zbiorczą analizę danych dotyczących cholesterolu i trójglicerydów z badań klinicznych, w tym badań długoterminowych, przedstawiono w Tabeli 4 i Tabeli 5.
Przybranie na wadze
Przy nietypowym stosowaniu leków przeciwpsychotycznych obserwowano zwiększenie masy ciała. Zaleca się kliniczne monitorowanie masy ciała.
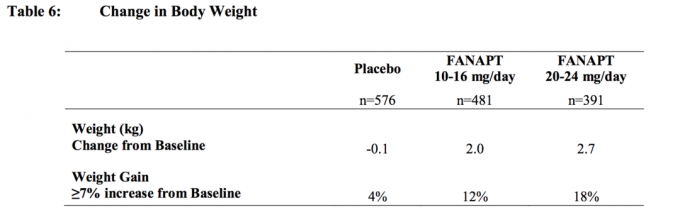
We wszystkich badaniach krótko- i długoterminowych ogólna średnia zmiana w stosunku do wartości wyjściowej w punkcie końcowym wyniosła 2,1 kg.
Zmiany masy ciała (kg) i odsetek pacjentów z ≥7% przyrostem masy ciała od 4 kontrolowane placebo, 4- lub 6-tygodniowe badania z ustaloną lub elastyczną dawką u dorosłych pacjentów przedstawiono w Tabela 6
Drgawki
W krótkoterminowych badaniach kontrolowanych placebo (od 4 do 6 tygodni) drgawki występowały u 0,1% (1/1344) pacjentów leczonych FANAPT w porównaniu do 0,3% (2/587) w grupie placebo. Podobnie jak w przypadku innych leków przeciwpsychotycznych, FANAPT należy stosować ostrożnie u pacjentów z napadami w wywiadzie lub w stanach, które potencjalnie obniżają próg drgawkowy. Warunki, które obniżają próg drgawkowy, mogą występować częściej w populacji w wieku 65 lat lub starszej.
Niedociśnienie ortostatyczne i omdlenia
FANAPT może wywoływać niedociśnienie ortostatyczne związane z zawrotami głowy, tachykardią i omdleniami. Odzwierciedla to jego antagonistyczne właściwości alfa1-adrenergiczne. W krótkoterminowych badaniach z podwójnie ślepą próbą kontrolowanych placebo, w których dawkę zwiększano powoli, zgodnie z zaleceniami powyżej omdlenie zgłoszono u 0,4% (5/1344) pacjentów leczonych FANAPT, w porównaniu z 0,2% (1/587) placebo. Niedociśnienie ortostatyczne zgłaszano u 5% pacjentów otrzymujących 20–24 mg / dobę, 3% pacjentów otrzymujących 10–16 mg / dobę i 1% pacjentów otrzymujących placebo. Oczekuje się, że szybsze miareczkowanie zwiększy częstość niedociśnienia ortostatycznego i omdlenia.
FANAPT należy stosować ostrożnie u pacjentów ze znaną chorobą sercowo-naczyniową (np. Niewydolnością serca, zawałem mięśnia sercowego w wywiadzie, niedokrwieniem lub przewodzeniem nieprawidłowości), choroby naczyniowo-mózgowe lub stany predysponujące pacjenta do niedociśnienia (odwodnienie, hipowolemia i leczenie przeciwnadciśnieniowe leki). U pacjentów podatnych na niedociśnienie należy rozważyć monitorowanie ortostatycznych parametrów życiowych.
Leukopenia, neutropenia i agranulocytoza
W badaniach klinicznych i po wprowadzeniu do obrotu zgłaszano przypadki leukopenii / neutropenii związane czasowo ze środkami przeciwpsychotycznymi. Zgłaszano również agranulocytozę (w tym przypadki śmiertelne).
Możliwe czynniki ryzyka leukopenii / neutropenii obejmują istniejącą wcześniej niską liczbę białych krwinek (WBC) i historię leukopenii / neutropenii wywołanej przez leki. U pacjentów z istniejącą wcześniej niską liczbą krwinek białych lub leukopenią / neutropenią wywołaną lekami należy monitorować ich pełną morfologię krwi (CBC) często w ciągu pierwszych kilku miesięcy terapii i powinien przerwać stosowanie FANAPT przy pierwszych oznakach zmniejszenia liczby białych krwinek przy braku innych przyczyn czynniki.
Pacjenci z neutropenią powinni być uważnie monitorowani pod kątem gorączki lub innych objawów lub oznak infekcji i niezwłocznie leczeni, jeśli takie objawy lub oznaki wystąpią. Pacjenci z ciężką neutropenią (bezwzględna liczba granulocytów obojętnochłonnych <1000 / mm3) powinni przerwać podawanie FANAPT i obserwować WBC aż do wyzdrowienia.
Hiperprolaktynemia
Podobnie jak w przypadku innych leków, które antagonizują receptory dopaminy D2, FANAPT podnosi poziom prolaktyny.
Hiperprolaktynemia może hamować podwzgórze GnRH, powodując zmniejszenie wydzielania gonadotropin w przysadce. To z kolei może hamować funkcje rozrodcze poprzez upośledzenie gonadalsteroidogenezy zarówno u kobiet, jak iu mężczyzn. Zgłaszano mlekotok, brak miesiączki, ginekomastię i impotencję w przypadku związków podwyższających poziom prolaktyny. Długotrwała hiperprolaktynemia związana z hipogonadyzmem może prowadzić do zmniejszenia gęstości kości zarówno u kobiet, jak iu mężczyzn.
Eksperymenty z kulturami tkankowymi wskazują, że około jedna trzecia ludzkich nowotworów piersi jest in vitro zależna od prolaktyny, a czynnik o potencjalnym znaczeniu, jeśli przepisanie tych leków rozważa się u pacjentki z uprzednio wykrytą piersią nowotwór. Zmiany proliferacyjne gruczołu sutkowego i wzrost prolaktyny w surowicy obserwowano u myszy i szczurów leczonych FANAPT. Dotychczasowe badania kliniczne ani epidemiologiczne nie wykazały związku między przewlekłym podawaniem tej klasy leków a nowotworami u ludzi; dostępne dowody są obecnie uważane za zbyt ograniczone, aby były rozstrzygające.
W krótkoterminowym badaniu kontrolowanym placebo (4 tygodnie) średnia zmiana poziomów prolaktyny w osoczu od wartości wyjściowej do punktu końcowego dla grupy leczonej FANAPT 24 mg / dobę nastąpił wzrost o 2,6 ng / ml w porównaniu ze spadkiem o 6,3 ng / ml w grupa placebo. W tym badaniu podwyższone poziomy prolaktyny w osoczu zaobserwowano u 26% dorosłych leczonych FANAPT w porównaniu do 12% w grupie placebo. W krótkoterminowych badaniach FANAPT wiązał się ze skromnym wzrostem poziomu prolaktyny w porównaniu z większym wzrostem stężenia prolaktyny obserwowanym w przypadku niektórych innych leków przeciwpsychotycznych. W zbiorczej analizie z badań klinicznych obejmujących badania długoterminowe u 3210 dorosłych leczonych iloperidonem ginekomastię zgłoszono u 2 mężczyzn (0,1%) w porównaniu do 0% u pacjentów otrzymujących placebo, a mlekotok odnotowano u 8 kobiet (0,2%) w porównaniu do 3 kobiet (0,5%) u pacjentów otrzymujących placebo pacjenci
Regulacja temperatury ciała
Zaburzenia zdolności organizmu do obniżania temperatury ciała przypisano środkom przeciwpsychotycznym. Zaleca się odpowiednią ostrożność przepisując FANAPT pacjentom, u których wystąpią schorzenia, które mogą przyczynić się do podwyższenia rdzenia temperatura, np. wysiłek fizyczny, ekspozycja na ekstremalne ciepło, przyjmowanie jednocześnie leków o działaniu antycholinergicznym lub poddawanie się odwodnienie.
Dysfagia
Dysfunkcja przełyku i aspiracja przełyku są związane ze stosowaniem leków przeciwpsychotycznych. Zapalenie płuc spowodowane aspiracją jest częstą przyczyną zachorowalności i umieralności u pacjentów w podeszłym wieku. FANAPT i inne leki przeciwpsychotyczne należy stosować ostrożnie u pacjentów zagrożonych aspiracyjnym zapaleniem płuc.
Samobójstwo
Możliwość próby samobójczej jest nieodłącznie związana z chorobą psychotyczną, a terapia lekowa powinna towarzyszyć ścisłemu nadzorowi pacjentów wysokiego ryzyka. Recepty na FANAPT powinny być napisane na najmniejszą liczbę tabletek zgodną z dobrym zarządzaniem pacjentem, aby zmniejszyć ryzyko przedawkowania.
Priapizm
Trzy przypadki priapizmu zgłoszono w programie FANAPT przed wprowadzeniem do obrotu. Doniesiono, że leki o działaniu blokującym receptory alfa-adrenergiczne wywołują priapizm. FANAPT podziela tę aktywność farmakologiczną. Ciężki priapizm może wymagać interwencji chirurgicznej.
Potencjał upośledzenia funkcji poznawczych i motorycznych
FANAPT, podobnie jak inne leki przeciwpsychotyczne, może potencjalnie wpływać na zdolność oceny, myślenia i zdolności motorycznych. W krótkoterminowych badaniach kontrolowanych placebo senność (w tym sedację) zgłaszano u 11,9% (104/874) dorośli pacjenci leczeni FANAPT w dawkach 10 mg / dobę lub większych w porównaniu do 5,3% (31/587) leczonych placebo. Pacjentów należy ostrzec o obsłudze niebezpiecznych maszyn, w tym samochodów, do czasu, gdy będą mieli wystarczającą pewność, że terapia FANAPT nie wpłynie na nie niekorzystnie.
Top
Działania niepożądane
Doświadczenie z badań klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo różnych warunkach, częstość występowania działań niepożądanych obserwowana w badaniu klinicznym leku nie można bezpośrednio porównać z odsetkami w badaniach klinicznych innego leku i może nie odzwierciedlać wskaźników obserwowanych w badaniach klinicznych ćwiczyć. Poniższe informacje pochodzą z bazy danych badań klinicznych FANAPT, składającej się z 3229 pacjentów narażonych na FANAPT w dawkach 10 mg / dzień lub większych, w leczeniu schizofrenii. Spośród nich 999 otrzymywało FANAPT przez co najmniej 6 miesięcy, a 657 było narażonych na FANAPT przez co najmniej 12 miesięcy. Wszyscy ci pacjenci, którzy otrzymali FANAPT, brali udział w badaniach klinicznych z wieloma dawkami. Warunki i czas trwania leczenia FANAPT były bardzo zróżnicowane i obejmowały (w pokrywających się kategoriach), otwarte i fazy badań z podwójnie ślepą próbą, pacjentów hospitalizowanych i ambulatoryjnych, badań o stałej dawce i dawkach elastycznych oraz krótko i długoterminowych ekspozycja.
Informacje przedstawione w tych sekcjach pochodzą z danych zbiorczych z 4 kontrolowanych placebo, 4- lub 6-tygodniowych, badania z ustaloną lub elastyczną dawką u pacjentów, którzy otrzymywali FANAPT w dawkach dziennych w zakresie od 10 do 24 mg (n = 874).
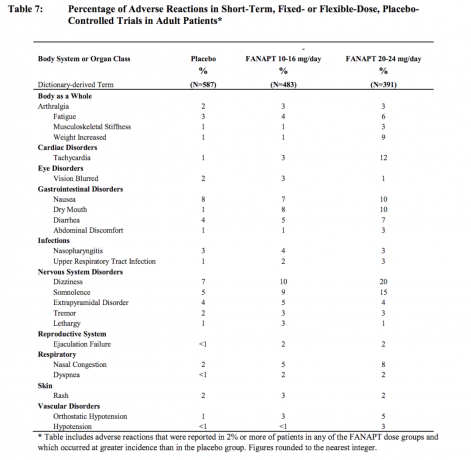
Działania niepożądane występujące z częstością 2% lub wyższą wśród pacjentów leczonych FANAPT i częściej niż placebo
Tabela 7 wylicza łączne przypadki działań niepożądanych, które zostały spontanicznie zgłoszone w czterech kontrolowanych placebo, 4- lub 6-tygodniowych, badania z ustaloną lub elastyczną dawką, wymieniające reakcje, które wystąpiły u 2% lub więcej pacjentów leczonych FANAPT w dowolnej dawce grupy, dla których częstość występowania u pacjentów leczonych FANAPT w dowolnej grupie dawek była większa niż częstość występowania u pacjentów leczonych placebo.
Działania niepożądane związane z dawką w badaniach klinicznych
Na podstawie zbiorczych danych z 4 kontrolowanych placebo, 4- lub 6-tygodniowych badań z ustaloną lub elastyczną dawką, działania niepożądane występujące z więcej niż 2% częstość występowania u pacjentów leczonych FANAPT i dla których częstość występowania u pacjentów leczonych FANAPT w dawce 20–24 mg na dobę była dwa razy większa niż częstość pacjenci leczeni FANAPT 10-16 mg / dobę to: dyskomfort w jamie brzusznej, zawroty głowy, niedociśnienie, sztywność mięśniowo-szkieletowa, tachykardia i waga wzrosła.
Częste i związane z lekami działania niepożądane w badaniach klinicznych
Na podstawie zbiorczych danych z 4 kontrolowanych placebo, 4- lub 6-tygodniowych badań z ustaloną lub elastyczną dawką, następujące działania niepożądane wystąpiły z częstością ≥5% u leczonych pacjentów z FANAPT i co najmniej dwukrotnością placebo szczura e dla co najmniej 1 dawki: zawroty głowy, suchość w ustach, zmęczenie, przekrwienie błony śluzowej nosa, senność, tachykardia, niedociśnienie ortostatyczne i waga wzrosła. Zawroty głowy, tachykardia i zwiększenie masy ciała były co najmniej dwa razy częstsze przy dawkach 20-24 mg / dobę niż przy dawkach 10-16 mg / dobę.
Objawy pozapiramidowe (EPS) w badaniach klinicznych
Dane zbiorcze z 4 kontrolowanych placebo, trwających 4 lub 6 tygodni badań z ustaloną lub elastyczną dawką dostarczyły informacji dotyczących EPS. Dane dotyczące zdarzeń niepożądanych zebrane z tych badań wykazały następujące wskaźniki zdarzeń niepożądanych związanych z EPS, jak pokazano w tabeli 8.

Działania niepożądane związane z przerwaniem leczenia w badaniach klinicznych
Na podstawie zbiorczych danych z 4 kontrolowanych placebo, 4- lub 6-tygodniowych badań o ustalonej lub elastycznej dawce nie stwierdzono różnica w częstości przerwania leczenia z powodu zdarzeń niepożądanych między leczonym FANAPT (5%) i leczonym placebo (5%) pacjenci Rodzaje zdarzeń niepożądanych, które doprowadziły do przerwania leczenia, były podobne u pacjentów leczonych FANAPT i placebo.
Różnice demograficzne w reakcjach niepożądanych w badaniach klinicznych
Badanie podgrup populacji w 4 kontrolowanych placebo, 4- lub 6-tygodniowych, ustalonych lub badania z elastyczną dawką nie wykazały żadnych różnic w zakresie bezpieczeństwa ze względu na wiek, płeć lub rasa.
Nieprawidłowe wyniki badań laboratoryjnych w badaniach klinicznych
Nie było różnic między FANAPT a placebo w częstości przerwania leczenia z powodu zmian w hematologii, analizie moczu lub chemii surowicy.
W krótkoterminowych badaniach kontrolowanych placebo (od 4 do 6 tygodni) u 1,0% (13/1342) pacjentów leczonych iloperidonem hematokryt przynajmniej raz poniżej rozszerzonego zakresu normalnego podczas leczenia po randomizacji, w porównaniu do 0,3% (2/585) placebo. Rozszerzony normalny zakres obniżonego hematokrytu zdefiniowano w każdej z tych prób jako wartość 15% poniżej normalnego zakresu dla scentralizowanego laboratorium, które zastosowano w próbie.
Inne reakcje podczas oceny FANAPT przed wprowadzeniem do obrotu
Poniżej znajduje się lista terminów MedDRA, które odzwierciedlają działania niepożądane u pacjentów leczonych FANAPT w wielokrotnych dawkach ≥ 4 mg / dzień podczas dowolnej fazy badania z bazą danych 3210 leczonych FANAPT pacjenci Uwzględniono wszystkie zgłoszone reakcje oprócz tych wymienionych już w tabeli 7 lub innych części działań niepożądanych (6), tych uwzględnionych w Ostrzeżenia i środki ostrożności (5), te warunki reakcji, które były tak ogólne, że były pozbawione informacji, reakcje zgłaszane u mniej niż 3 pacjentów i które nie były ani groźne, ani zagrażające życiu, reakcje, które w innym przypadku byłyby powszechne jako reakcje tła i reakcje uważane za mało prawdopodobne, aby były lekami związane z.
Reakcje są dalej kategoryzowane według klasyfikacji układów i narządów MedDRA i wymienione w kolejności malejącej według następujących kryteriów definicje: częstymi zdarzeniami niepożądanymi są te występujące u co najmniej 1/100 pacjentów (pojawiają się tylko te niewymienione w tabeli 7) wymienianie kolejno); rzadkie działania niepożądane to te występujące u 1/100 do 1/1000 pacjentów; rzadkie zdarzenia to te, które występują u mniej niż 1/1000 pacjentów.
Zaburzenia krwi i układu chłonnego: rzadko - niedokrwistość, niedokrwistość z niedoboru żelaza; Rzadko - leukopenia
Zaburzenia serca: Częste - kołatanie serca; Rzadko - arytmia, blok przedsionkowo-komorowy pierwszego stopnia, niewydolność serca (w tym zastoinowa i ostra)
Zaburzenia ucha i błędnika: rzadko - zawroty głowy, szum w uszach
Zaburzenia endokrynologiczne: rzadko - niedoczynność tarczycy
Zaburzenia oka: Częste - zapalenie spojówek (w tym alergiczne); Rzadko - suche oko, zapalenie powiek, obrzęk powiek, obrzęk oka, zmętnienia soczewkowe, zaćma, przekrwienie (w tym spojówek)
Zaburzenia żołądka i jelit: Rzadko - zapalenie żołądka, nadmierne wydzielanie śliny, nietrzymanie stolca, owrzodzenie jamy ustnej; Rzadko - aftowe zapalenie jamy ustnej, wrzód dwunastnicy, przepuklina rozworu przełykowego, hiperchlorhydria, owrzodzenie warg, refluksowe zapalenie przełyku, zapalenie jamy ustnej
Zaburzenia ogólne i stany w miejscu administracyjnym: Rzadko - obrzęk (ogólny, wżerowy, z powodu chorób serca), trudności w chodzeniu, pragnienie; Rzadko - hipertermia
Zaburzenia wątroby i dróg żółciowych: Rzadko - kamica żółciowa
Badania: Częste: zmniejszenie masy ciała; Rzadko - zmniejszenie stężenia hemoglobiny, zwiększenie liczby neutrofili, zmniejszenie hematokrytu
Zaburzenia metabolizmu i odżywiania: Rzadko - zwiększony apetyt, odwodnienie, hipokaliemia, zatrzymanie płynów
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej: Częste - bóle mięśni, skurcze mięśni; Rzadko - kręcz szyi
Zaburzenia układu nerwowego: rzadko - parestezje, nadpobudliwość psychoruchowa, niepokój, amnezja, oczopląs; Rzadko - zespół niespokojnych nóg
Zaburzenia psychiczne: Częste - niepokój, agresja, złudzenie; Rzadko - wrogość, obniżone libido, paranoja, anorgazmia, stan splątania, mania, katatonia, wahania nastroju, panika atak, zaburzenie obsesyjno-kompulsyjne, bulimia psychiczna, majaczenie, polidypsja psychogenna, zaburzenie kontroli impulsów, poważne depresja
Zaburzenia nerek i dróg moczowych: Częste - nietrzymanie moczu; Rzadko - bolesne oddawanie moczu, częstomocz, mdłości, kamica nerkowa; Rzadko - zatrzymanie moczu, ostra niewydolność nerek
Zaburzenia układu rozrodczego i piersi: Częste - zaburzenia erekcji; Rzadko - ból jąder, brak miesiączki, ból piersi; Rzadko - nieregularne miesiączki, ginekomastia, krwotok miesiączkowy, krwotok krwotoczny, krwotok pomenopauzalny, zapalenie gruczołu krokowego.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: Rzadko - krwawienie z nosa, astma, nieżyt nosa, przekrwienie zatok, suchość nosa; Rzadko - suchość w gardle, zespół bezdechu sennego, duszność wysiłkowa
Doświadczenie po wprowadzeniu do obrotu
Podczas stosowania produktu FANAPT po zatwierdzeniu stwierdzono następujące działania niepożądane: wytrysk wsteczny i reakcje nadwrażliwości (w tym anafilaksja; obrzęk naczynioruchowy; ucisk w gardle; obrzęk jamy ustnej i gardła; obrzęk twarzy, warg, ust i języka; pokrzywka; wysypka; i świąd). Ponieważ reakcje te zgłaszano dobrowolnie w populacji o niepewnej wielkości, nie można wiarygodnie oszacować ich częstości ani ustalić związku przyczynowego z ekspozycją na lek.
Top
Interakcje z lekami
Biorąc pod uwagę główne działanie FANAPT na ośrodkowy układ nerwowy, należy zachować ostrożność, gdy jest on stosowany w połączeniu z innymi działającymi ośrodkowo lekami i alkoholem. Ze względu na antagonizm wobec receptora alfa1-adrenergicznego FANAPT może nasilać działanie niektórych leków przeciwnadciśnieniowych.
Potencjalny wpływ innych leków na FANAPT
Iloperidon nie jest substratem dla enzymów CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ani CYP2E1. Sugeruje to, że interakcja iloperidonu z inhibitorami lub induktorami tych enzymów lub innymi czynnikami, takimi jak palenie, jest mało prawdopodobna. Zarówno CYP3A4, jak i CYP2D6 są odpowiedzialne za metabolizm iloperidonu. Inhibitory CYP3A4 (np. Ketokonazol) lub CYP2D6 (np. Fluoksetyna, paroksetyna) mogą hamować eliminację iloperidonu i powodować zwiększenie stężenia we krwi.
Ketokonazol: jednoczesne podawanie ketokonazolu (200 mg dwa razy na dobę przez 4 dni), silnego inhibitora CYP3A4, z pojedynczą dawką iloperidonu 3 mg do 19 zdrowi ochotnicy w wieku 18–45 lat zwiększyli obszar pod krzywą (AUC) iloperidonu i jego metabolitów P88 i P95 o 57%, 55% i 35%, odpowiednio. Dawki iloperidonu należy zmniejszyć o około połowę, gdy podaje się je z ketokonazolem lub innymi silnymi inhibitorami CYP3A4 (np. Itrakonazol). Słabsze inhibitory (np. Erytromycyna, sok grejpfrutowy) nie były badane. Po odstawieniu inhibitora CYP3A4 z terapii skojarzonej dawkę iloperidonu należy przywrócić do poprzedniego poziomu.
Fluoksetyna: jednoczesne podawanie fluoksetyny (20 mg dwa razy na dobę przez 21 dni), silnego inhibitora CYP2D6, z pojedynczą dawką 3 mg iloperidonu 23 zdrowym ochotnikom w wieku 29-44 lat, zaklasyfikowanych jako intensywnie metabolizujące CYP2D6, zwiększyło AUC iloperidonu i jego metabolitu P88 około 2–3-krotnie oraz zmniejszyło AUC jego metabolitu P95 o połowa. Dawki iloperidonu należy zmniejszyć o połowę w przypadku podawania z fluoksetyną. Po wycofaniu fluoksetyny z terapii skojarzonej dawkę iloperidonu należy przywrócić do poprzedniego poziomu. Oczekuje się, że inne silne inhibitory CYP2D6 będą miały podobne działanie i będą wymagać odpowiedniego zmniejszenia dawki. Gdy inhibitor CYP2D6 zostanie wycofany z terapii skojarzonej, dawkę iloperidonu można następnie zwiększyć do poprzedniego poziomu.
Paroksetyna: jednoczesne podawanie paroksetyny (20 mg / dobę przez 5-8 dni), silnego inhibitora CYP2D6, z wieloma dawkami iloperidonu (8 lub 12 mg dwa razy na dobę) u pacjentów ze schizofrenią w wieku 18–65 lat spowodowało zwiększenie średnich maksymalnych stężeń w stanie stacjonarnym iloperidon i jego metabolit P88, około 1,6-krotnie, oraz zmniejszyli średnie maksymalne stężenia jego metabolitu P95 w stanie stacjonarnym o połowa. Dawki iloperidonu należy zmniejszyć o połowę w przypadku podawania z paroksetyną. Po odstawieniu paroksetyny z terapii skojarzonej dawkę iloperidonu należy przywrócić do poprzedniego poziomu. Oczekuje się, że inne silne inhibitory CYP2D6 będą miały podobne działanie i będą wymagać odpowiedniego zmniejszenia dawki. Gdy inhibitor CYP2D6 zostanie wycofany z terapii skojarzonej, dawkę iloperidonu można następnie zwiększyć do poprzednich poziomów.
Paroksetyna i ketokonazol: jednoczesne podawanie paroksetyny (20 mg raz na dobę przez 10 dni), inhibitora CYP2D6 i ketokonazolu (200 mg dwa razy dziennie) z wielokrotnymi dawkami iloperidonu (8 lub 12 mg dwa razy dziennie) pacjentom ze schizofrenią w wieku 18-65 lat spowodowało 1,4 krotny wzrost stężenia w stanie stacjonarnym iloperidonu i jego metabolitu P88 oraz 1,4 krotny spadek P95 w obecności paroksetyna. Podanie iloperidonu z inhibitorami obu jego szlaków metabolicznych nie zwiększyło efektu działania żadnego z inhibitorów podawanych osobno. Dlatego dawki iloperidonu należy zmniejszyć o około połowę, jeśli podaje się je jednocześnie z inhibitorem CYP2D6 i CYP3A4.
Potencjalny wpływ FANAPT na inne leki
Badania in vitro na mikrosomach wątroby ludzkiej wykazały, że iloperidon nie hamuje zasadniczo metabolizmu leki metabolizowane przez następujące izozymy cytochromu P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 lub CYP2E1. Ponadto badania in vitro na mikrosomach ludzkiej wątroby wykazały, że iloperidon nie indukuje enzymów właściwości, szczególnie dla następujących izozymów cytochromu P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 i CYP3A5.
Dekstrometorfan: Badanie przeprowadzone na zdrowych ochotnikach wykazało, że zmiany w farmakokinetyce dekstrometorfanu (dawka 80 mg), gdy dawka 3 mg iloperidon był podawany jednocześnie, powodując 17% wzrost całkowitej ekspozycji i 26% wzrost maksymalnego stężenia w osoczu Cmax dekstrometorfan. Zatem interakcja między iloperidonem i innymi substratami CYP2D6 jest mało prawdopodobna.
Fluoksetyna: Pojedyncza dawka 3 mg iloperidonu nie miała wpływu na farmakokinetykę fluoksetyny (20 mg dwa razy na dobę).
Midazolam (wrażliwy substrat CYP 3A4): Badanie u pacjentów ze schizofrenią wykazało mniej niż 50% wzrost całkowitej ilości midazolamu ekspozycja w stanie stacjonarnym iloperidonu (14 dni doustnego dawkowania do 10 mg iloperidonu dwa razy dziennie) i brak wpływu na midazolam C max. Zatem interakcja między iloperidonem i innymi substratami CYP3A4 jest mało prawdopodobna.
Leki przedłużające odstęp QT FANAPT nie powinny być stosowane z innymi lekami przedłużającymi odstęp QT.
Top
Użyj w określonych populacjach
Rejestr narażenia na ciążę
Istnieje rejestr narażenia na ciążę, który monitoruje wyniki ciąży u kobiet narażonych na FANAPT podczas ciąży. Aby uzyskać więcej informacji, skontaktuj się z krajowym rejestrem ciąż dla nietypowych leków przeciwpsychotycznych pod numerem 1-866-961-2388 lub odwiedź http://womensmentalhealth.org/clinical-and -badania-programów / ciąża /.
Podsumowanie ryzyka
Noworodki, których matki są narażone na leki przeciwpsychotyczne, w tym FANAPT, w trzecim trymestrze ciąży są narażone na objawy pozapiramidowe i / lub odstawienne po porodzie. Ograniczone dostępne dane dotyczące FANAPT u kobiet w ciąży nie są wystarczające, aby poinformować o ryzyku poważnych wad wrodzonych i poronień związanych z narkotykami. Iloperidon nie wykazywał działania teratogennego po podaniu doustnym ciężarnym szczurom podczas organogenezy w dawkach do 26 razy większych niż maksymalna zalecana dawka dla ludzi 24 mg / dobę w przeliczeniu na mg / m2. Przedłużyło to jednak czas trwania ciąży i porodu, zwiększyło liczbę urodzeń martwych, wczesne zgony wewnątrzmaciczne, zwiększyło opóźnienia rozwojowe i zmniejszyło przeżywalność młodych po porodzie. Iloperidon nie wykazywał działania teratogennego po podaniu doustnym ciężarnym królikom podczas organogenezy w dawkach do 20-krotności MRHD w przeliczeniu na mg / m2. Jednak zwiększało to wczesne zgony wewnątrzmaciczne i zmniejszało żywotność płodu w czasie przy najwyższej dawce, która była także dawką toksyczną dla matki.
Ryzyko poważnych wad wrodzonych i poronień we wskazanej populacji nie jest znane. W populacji ogólnej USA szacunkowe ryzyko poważnych wad wrodzonych i poronień w klinicznie rozpoznanych ciążach wynosi odpowiednio 2-4% i 15-20%.
Uwagi kliniczne
Działania niepożądane u płodu / noworodka
Objawy pozapiramidowe i / lub odstawienne, w tym pobudzenie, hipertonia, hipotonia, drżenie, senność, niewydolność oddechowa i zaburzenia noworodka zgłaszano u noworodków, których matki były narażone na leki przeciwpsychotyczne w trzecim trymestrze ciąży ciąża. Objawy te różniły się nasileniem. Niektóre noworodki wyzdrowiały w ciągu kilku godzin lub dni bez specjalnego leczenia; inne wymagały przedłużonej hospitalizacji. Monitoruj noworodków pod kątem objawów pozapiramidowych i / lub odstawiennych i odpowiednio zarządzaj objawami.
Dane
Dane zwierząt
W badaniu rozwoju zarodka i płodu ciężarnym szczurom podawano 4, 16 lub 64 mg / kg / dobę (1,6, 6,5 i 26 razy więcej niż maksymalna zalecana dawka dla ludzi (MRHD) 24 mg / dobę w przeliczeniu na mg / m2) iloperidonu doustnie w okresie organogeneza. Największa dawka spowodowała zwiększenie liczby wczesnych zgonów wewnątrzmacicznych, zmniejszenie masy i długości płodu, zmniejszone kostnienie kostne płodu oraz zwiększona częstość występowania drobnych anomalii szkieletowych płodu i wariacje; dawka ta spowodowała również zmniejszenie spożycia pokarmu przez matkę i zwiększenie masy ciała.
W badaniu rozwoju zarodka i płodu ciężarnym królikom podawano 4, 10 lub 25 mg / kg / dobę (3, 8 i 20-krotność MRHD w przeliczeniu na mg / m2) iloperidonu w okresie organogenezy. Największa dawka spowodowała wzrost wczesnych zgonów wewnątrzmacicznych i zmniejszenie żywotności płodu w terminie; dawka ta spowodowała również toksyczność dla matki.
W dodatkowych badaniach, w których szczurom podawano iloperidon w dawkach podobnych do powyższych, zaczynając od poczęcia lub od poczęcia 17 dzień ciąży i kontynuacja po odstawieniu od piersi niekorzystny wpływ na reprodukcję obejmował przedłużoną ciążę i poród liczba urodzeń martwych, zwiększona częstość zmian trzewnych płodu, zmniejszenie masy płodu i potomstwa oraz zmniejszenie liczby młodych po porodzie przetrwanie. Nie stwierdzono wpływu leku na rozwój neurobehawioralny lub reprodukcyjny ocalałych szczeniąt. Dawki niepowodujące zmian wahały się od 4 do 12 mg / kg, z wyjątkiem wzrostu odsetka martwych urodzeń, który wystąpił przy najniższej badanej dawce 4 mg / kg, czyli 1,6 razy więcej niż MRHD w przeliczeniu na mg / m2. W tych badaniach obserwowano toksyczność dla matek po wyższych dawkach.
Metabolit iloperydonu P95, który jest głównym krążącym metabolitem iloperidonu u ludzi, ale nie występuje w znaczące ilości u szczurów podawano ciężarnym szczurom w okresie organogenezy w dawkach doustnych 20, 80 lub 200 mg kg / dzień. Nie zaobserwowano działania teratogennego. Opóźnione kostnienie kostne występowało przy wszystkich dawkach. Nie stwierdzono znaczącej toksyczności matczynej. Poziomy P95 (AUC) w osoczu przy najwyższej badanej dawce były 2 razy wyższe niż u ludzi otrzymujących MRHD iloperidonu.
Laktacja
Podsumowanie ryzyka
Nie ma informacji dotyczących obecności iloperidonu lub jego metabolitów w mleku ludzkim wpływ iloperidonu na dziecko karmione piersią, ani wpływ iloperidonu na mleko matki produkcja. Iloperidon jest obecny w mleku szczura. Ze względu na możliwość wystąpienia poważnych działań niepożądanych u niemowląt karmionych piersią, odradzaj kobietom karmienie piersią podczas leczenia lekiem FANAPT.
Dane Przenoszenie radioaktywności do mleka szczurów w okresie laktacji badano po podaniu pojedynczej dawki iloperidonu [14C] w dawce 5 mg / kg. Stężenie radioaktywności w mleku po 4 godzinach od podania było prawie 10-krotnie większe niż w osoczu w tym samym czasie. Jednak po 24 godzinach od podania stężenie radioaktywności w mleku spadło do wartości nieco niższych niż w osoczu. Profil metaboliczny w mleku był jakościowo podobny do profilu w osoczu.
Stosowanie u dzieci Bezpieczeństwo i skuteczność u dzieci i młodzieży nie zostały ustalone.
Zastosowanie geriatryczne
Badania kliniczne FANAPT w leczeniu schizofrenii nie obejmowały wystarczającej liczby pacjenci w wieku 65 lat i starsi, aby ustalić, czy reagują inaczej niż młodsi dorośli pacjenci Spośród 3210 pacjentów leczonych FANAPT w badaniach przed wprowadzeniem do obrotu, 25 (0,5%) było w wieku ≥65 lat i nie było pacjentów w wieku ≥75 lat.
Starsi pacjenci z psychozą związaną z otępieniem leczeni FANAPT są narażeni na zwiększone ryzyko śmierci w porównaniu z placebo. FANAPT nie jest zatwierdzony do leczenia pacjentów z psychozą związaną z demencją.
Zaburzenia czynności nerek
Ponieważ FANAPT jest silnie metabolizowany, a mniej niż 1% leku jest wydalane w postaci niezmienionej, samo zaburzenie czynności nerek raczej nie będzie miało znaczącego wpływu na farmakokinetykę FANAPT. Zaburzenia czynności nerek (klirens kreatyniny <30 ml / min) miały minimalny wpływ na Cmax iloperidonu (podawanego w pojedynczej dawce 3 mg) i jego metabolitów P88 i P95 w którymkolwiek z 3 mierzonych analitów. AUC0– ∞ wzrosło o 24%, zmniejszyło się o 6% i wzrosło o 52% odpowiednio dla iloperidonu, P88 i P95 u pacjentów z zaburzeniami czynności nerek.
Zaburzenia czynności wątroby
U pacjentów z łagodnymi zaburzeniami czynności wątroby dostosowanie dawki FANAPT nie jest konieczne. Pacjenci z umiarkowanymi zaburzeniami czynności wątroby mogą wymagać zmniejszenia dawki. FANAPT nie jest zalecany u pacjentów z ciężkimi zaburzeniami czynności wątroby.
U dorosłych pacjentów z łagodnymi zaburzeniami czynności wątroby nie zaobserwowano istotnej różnicy w farmakokinetyce iloperidonu, P88 lub P95 (całkowite lub niezwiązane) w porównaniu ze zdrowymi dorosłymi osobami kontrolnymi. U pacjentów z umiarkowanymi zaburzeniami czynności wątroby wyższa (2-krotnie) i bardziej zmienna wolna ekspozycja na aktywne metabolity P88 wynosiła zaobserwowano w porównaniu ze zdrowymi kontrolami, podczas gdy ekspozycja na iloperidon i P95 była ogólnie podobna (zmiana mniejsza niż 50% w porównaniu do kontrola). Ponieważ nie przeprowadzono badania z udziałem osób z ciężką niewydolnością wątroby, FANAPT nie jest zalecany u pacjentów z ciężkimi zaburzeniami czynności wątroby.
Status palenia
W oparciu o badania in vitro z wykorzystaniem enzymów ludzkiej wątroby, FANAPT nie jest substratem dla CYP1A2; palenie nie powinno zatem wpływać na farmakokinetykę FANAPT.
Ciąża
Top
Nadużywanie narkotyków i uzależnienie
Substancja kontrolowana
FANAPT nie jest substancją kontrolowaną.
Nadużycie
FANAPT nie był systematycznie badany na zwierzętach lub ludziach pod kątem potencjalnego nadużycia, tolerancji lub fizycznej zależności. Chociaż badania kliniczne nie wykazały tendencji do zachowań związanych z poszukiwaniem narkotyków, obserwacje te nie były systematyczne i nie jest możliwe przewidzieć na podstawie tego doświadczenia, w jakim stopniu FANAPT, aktywny lek działający na OUN, zostanie nadużyty, przekierowany i / lub nadużyty jeden raz sprzedawany. W związku z tym należy dokładnie ocenić pacjentów pod kątem uzależnienia od narkotyków w wywiadzie i tacy pacjenci powinni uważnie obserwowane pod kątem oznak niewłaściwego lub niewłaściwego użycia FANAPT (np. rozwój tolerancji, zwiększenie dawki, poszukiwanie leku zachowanie).
Top
Przedawkowanie
Ludzkie doświadczenie
W badaniach przed wprowadzeniem do obrotu z udziałem ponad 3210 pacjentów przypadkowe lub celowe przedawkowanie produktu FANAPT miało miejsce udokumentowane u 8 pacjentów w zakresie od 48 mg do 576 mg przyjmowanych jednocześnie i 292 mg przyjmowanych w ciągu 3 dni Kropka. W tych przypadkach nie odnotowano ofiar śmiertelnych. Największe potwierdzone pojedyncze spożycie FANAPT wyniosło 576 mg; u tego pacjenta nie odnotowano niekorzystnych efektów fizycznych. Kolejnym największym potwierdzonym spożyciem FANAPT było 438 mg w okresie 4 dni; zgłaszano objawy pozapiramidowe i odstęp QTc wynoszący 507 ms dla tego pacjenta bez następstw sercowych. Ten pacjent wznowił leczenie FANAPT na dodatkowe 11 miesięcy.
Zasadniczo zgłaszanymi objawami przedmiotowymi i podmiotowymi były wyolbrzymienie znanych efektów farmakologicznych (np. Senność i uspokojenie, tachykardia i niedociśnienie) FANAPT.
Postępowanie w przypadku przedawkowania
Nie ma specyficznego antidotum na FANAPT. Dlatego należy wprowadzić odpowiednie środki wsparcia. W przypadku ostrego przedawkowania lekarz powinien założyć i utrzymać drogi oddechowe oraz zapewnić odpowiednie dotlenienie i wentylację. Należy rozważyć płukanie żołądka (po intubacji, jeśli pacjent jest nieprzytomny) i podanie węgla aktywowanego wraz ze środkiem przeczyszczającym. Możliwość otępienia, drgawek lub reakcji dystonicznej głowy i szyi po przedawkowaniu może stwarzać ryzyko aspiracji z wywołaną wymiotami. Monitorowanie układu sercowo-naczyniowego powinno rozpocząć się natychmiast i powinno obejmować ciągłe monitorowanie EKG w celu wykrycia możliwych zaburzeń rytmu serca. Jeśli stosuje się leczenie przeciwarytmiczne, nie należy stosować dizopiramidu, prokainamidu i chinidyny, ponieważ mogą one wydłużać odstęp QT i mogą być addytywne w stosunku do FANAPT. Podobnie uzasadnione jest oczekiwanie, że właściwości blokujące alfa w bretylium mogą być addytywne w stosunku do właściwości FANAPT, powodując problematyczne niedociśnienie. Niedociśnienie i zapaść krążeniową należy leczyć za pomocą odpowiednich środków, takich jak dożylne płyny lub leki sympatykomimetyczne (epinefryna i dopamina nie powinny być stosowane, ponieważ stymulacja beta może pogorszyć niedociśnienie w warunkach alfa indukowanego przez FANAPT blokada). W przypadku ciężkich objawów pozapiramidowych należy podać leki antycholinergiczne. Ścisły nadzór medyczny powinien być kontynuowany aż do wyzdrowienia pacjenta.
Top
Opis
FANAPT jest nietypowym lekiem przeciwpsychotycznym należącym do klasy chemicznej pochodnych piperydynylo-benzizoksazolu. Jego nazwa chemiczna to 4 '- [3- [4- (6-fluoro-1,2-benzizoksazol-3-ilo) piperydyno] propoksy] -3'-metoksyacetofenon. Jego wzór cząsteczkowy to C24H27FN2O4, a jego masa cząsteczkowa wynosi 426,48. Wzór strukturalny jest następujący:
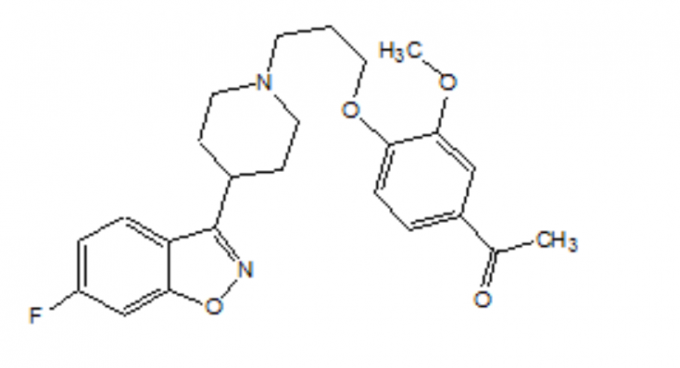
Iloperidon jest drobno krystalicznym proszkiem o barwie białej do białawej. Jest praktycznie nierozpuszczalny w wodzie, bardzo słabo rozpuszczalny w 0,1 N HCl i łatwo rozpuszczalny w chloroformie, etanolu, metanolu i acetonitrylu.
Tabletki FANAPT są przeznaczone wyłącznie do podawania doustnego. Każda runda, niepowlekana
tabletka zawiera 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg lub 12 mg iloperidonu. Nieaktywne składniki to: laktoza jednowodna, celuloza mikrokrystaliczna, hydroksypropylometyloceluloza, krospowidon, stearynian magnezu, krzem koloidalny
dwutlenek i woda oczyszczona (usuwana podczas przetwarzania). Tabletki są białe, okrągłe, płaskie, ze ściętymi krawędziami i oznaczone logo „” wytłoczonym po jednej stronie i siłą tabletki „1”, „2”, „4”, „6”, „8”, „10”, lub „12” wytłoczony po drugiej stronie.
Top
Farmakologia kliniczna
Mechanizm akcji
Mechanizm działania iloperidonu w schizofrenii jest nieznany. Jednak skuteczność iloperidonu może być mediowana przez połączenie antagonizmu dopaminy typu 2 (D2) i serotoniny typu 2 (5-HT2).
Iloperidon tworzy aktywny metabolit, P88, który ma profil wiązania receptora in vitro podobny do leku macierzystego.
Farmakodynamika
Iloperidon działa jako antagonista o wysokim powinowactwie (nM) wiążącym się z serotoniną 5-HT2A dopaminą D2 i Receptory D3 i receptory norepinefryny NEα1 (wartości Ki 5,6, 6,3, 7,1 i 0,36 nM, odpowiednio). Iloperidon ma umiarkowane powinowactwo do receptorów dopaminowych D4 i serotoninowych 5-HT6 i 5-HT7 (wartości Ki 25, 43 i 22, nM odpowiednio) i niskie powinowactwo do receptorów serotoninowych 5-HT1A, dopaminy D1 i histaminy H1 (wartości Ki 168, 216 i 437 nM, odpowiednio). Iloperidon nie wykazuje znaczącego powinowactwa (Ki> 1000 nM) do cholinergicznych receptorów muskarynowych. Powinowactwo metabolitu iloperydonu P88 jest na ogół równe lub mniejsze niż powinowactwa związku macierzystego, podczas gdy tylko metabolit P95 wykazuje powinowactwo do 5-HT2A (wartość Ki 3,91) i receptorów NEα1A, NEα1B, NEα1D i NEα2C (wartości Ki 4,7, 2,7, 8,8 i 4,7 nM odpowiednio).
Farmakokinetyka
Obserwowany średni okres półtrwania w fazie eliminacji iloperidonu, P88 i P95 u osób intensywnie metabolizujących CYP2D6 (EM) wynoszą odpowiednio 18, 26 i 23 godziny, a przy słabym metabolizmie (PM) odpowiednio 33, 37 i 31 godzin. Stężenia w stanie stacjonarnym są osiągane w ciągu 3–4 dni od podania. Akumulacja iloperidonu jest przewidywalna na podstawie farmakokinetyki pojedynczej dawki. Farmakokinetyka iloperidonu jest bardziej niż proporcjonalna do dawki. Eliminacja iloperidonu odbywa się głównie poprzez metabolizm wątrobowy z udziałem 2 izoenzymów P450, CYP2D6 i CYP3A4.
Wchłanianie: Iloperidon jest dobrze wchłaniany po podaniu tabletki, a maksymalne stężenie w osoczu występuje w ciągu 2 do 4 godzin; podczas gdy względna dostępność biologiczna formulacji tabletki w porównaniu do roztworu doustnego wynosi 96%. Podanie iloperidonu ze standardowym wysokotłuszczowym posiłkiem nie wpłynęło znacząco na Cmax lub AUC iloperidonu, P88 lub P95, ale opóźniło Tmax o 1 godzinę dla iloperidonu, 2 godziny dla P88 i 6 godzin dla P95. FANAPT można podawać niezależnie od posiłków.
Dystrybucja: Iloperidon ma pozorny klirens (klirens / biodostępność) od 47 do 102 l / h, z pozorną objętością dystrybucji 1340-2800 L. W stężeniach terapeutycznych niezwiązana frakcja iloperidonu w osoczu wynosi ~ 3%, a dla każdego metabolitu (P88 i P95) ~ 8%.
Metabolizm i eliminacja: Iloperidon jest metabolizowany głównie przez 3 szlaki biotransformacji: redukcję karbonylu, hydroksylację (za pośrednictwem CYP2D6) i O-demetylację (za pośrednictwem CYP3A4). Istnieją 2 dominujące metabolity iloperidonu, P95 i P88. Metabolit iloperydonu P95 stanowi 47,9% AUC iloperidonu i jego metabolitów w osoczu w stanie stacjonarnym dla osób intensywnie metabolizujących (EM) i 25% dla osób słabo metabolizujących (PM). Aktywny metabolit P88 stanowi odpowiednio 19,5% i 34,0% całkowitej ekspozycji w osoczu odpowiednio w EM i PM.
Około 7% -10% rasy białej i 3% -8% czarnych / Afroamerykanów nie ma zdolności do metabolizowania CYP2D6 substraty i są sklasyfikowane jako słabo metabolizujące (PM), podczas gdy reszta jest pośrednia, rozległa lub ultraszybka metabolizery. Jednoczesne podawanie FANAPT ze znanymi silnymi inhibitorami CYP2D6, takimi jak fluoksetyna, powoduje 2,3-krotność zwiększenie ekspozycji na iloperidon w osoczu, dlatego też połowa dawki FANAPT powinna wynosić podawany.
Podobnie PMs CYP2D6 mają większą ekspozycję na iloperidon w porównaniu z EM, a PM powinni mieć zmniejszoną dawkę o połowę. Dostępne są testy laboratoryjne w celu identyfikacji PM CYP2D6.
Większość materiałów radioaktywnych odzyskano w moczu (średnio 58,2% i 45,1% odpowiednio w EM i PM), przy czym kał stanowił 19,9% (EM) do 22,1% (PM) dozowanej radioaktywności.
Interakcja z transporterem: Iloperidon i P88 nie są substratami P-gp, a iloperidon jest słabym inhibitorem P-gp.
Top
Toksykologia niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
Rakotwórczość: Badania rakotwórczości przez całe życie przeprowadzono na myszach CD-1 i szczurach Sprague Dawley. Iloperidon podawano doustnie w dawkach 2,5, 5,0 i 10 mg / kg / dobę myszom CD-1 oraz 4, 8 i 16 mg / kg / dobę Szczury Sprague Dawley (0,5, 1,0 i 2,0 razy oraz odpowiednio 1,6, 3,2 i 6,5 razy, MRHD 24 mg / dzień na mg / m2 podstawa). Występowała zwiększona częstość złośliwych guzów gruczołu sutkowego u samic myszy leczonych tylko najniższą dawką (2,5 mg / kg / dzień). U szczurów nie stwierdzono związanego z leczeniem wzrostu nowotworu.
Działanie rakotwórcze metabolitu iloperydonu P95, który jest głównym krążącym metabolitem iloperidonu u ludzi, ale nie występuje w znacznych ilościach u myszy lub szczury oceniano w dożywotnim badaniu rakotwórczości u szczurów Wistar w dawkach doustnych 25, 75 i 200 mg / kg / dobę u samców oraz 50, 150 i 250 (zmniejszonych z 400) mg / kg / dobę u kobiety. Zmiany nowotworowe związane z lekami występowały u mężczyzn, w przysadce mózgowej (gruczolak pars distalis) we wszystkich dawkach oraz w trzustce (gruczolak wysp trzustkowych) po dużych dawkach. Poziomy P95 (AUC) w osoczu u mężczyzn w badanych dawkach (25, 75 i 200 mg / kg / dobę) były odpowiednio około 0,4, 3 i 23 razy większe niż narażenie ludzi na P95 przy MRHD iloperidonu.
Mutageneza: Iloperidon był ujemny w teście Amesa oraz w testach mikrojądrowych w szpiku kostnym myszy i wątrobie szczura. Iloperidon indukował aberracje chromosomalne w komórkach jajnika chomika chińskiego (CHO) in vitro w stężeniach, które również powodowały pewną cytotoksyczność.
Metabolit iloperydonu P95 był ujemny w teście Amesa, teście aberracji chromosomów V79 i teście mikrojądrowym szpiku kostnego myszy in vivo.
Upośledzenie płodności: Iloperidon zmniejszał płodność przy dawkach 12 i 36 mg / kg w badaniu, w którym leczono zarówno samce, jak i samice szczurów. Dawka niepowodująca zmian wynosiła 4 mg / kg, co stanowi 1,6-krotność MRHD 24 mg / dzień w przeliczeniu na mg / m2.
Top
Studia kliniczne
Skuteczność FANAPT w leczeniu schizofrenii została potwierdzona przez 2 placebo i kontrolowane aktywnie badania krótkoterminowe (4- i 6-tygodniowe) oraz jedno długoterminowe randomizowane badanie kontrolowane placebo proces wycofania. Do wszystkich badań włączono pacjentów, którzy spełnili kryteria DSM-III / IV dla schizofrenii.
W tych badaniach zastosowano trzy narzędzia do oceny objawów psychicznych. Zarówno Skala Syndromu Pozytywnego, jak i Negatywnego (PANSS) oraz Skala Krótkiej Oceny Psychiatrycznej (BPRS) to zapasy wielopozycyjne.
ogólnej psychopatologii zwykle stosowanej do oceny efektów leczenia uzależnień od narkotyków w schizofrenii. Ocena globalnego wrażenia klinicznego (CGI) odzwierciedla wrażenie wykwalifikowanego obserwatora, w pełni zaznajomionego z objawami schizofrenii, na temat ogólnego stanu klinicznego pacjenta.
6-tygodniowe, kontrolowane placebo badanie (n = 706) obejmowało 2 elastyczne zakresy dawek FANAPT (12-16 mg / dobę lub 20-24 mg / dobę) w porównaniu z placebo i aktywną kontrolą (rysperydon). W grupie otrzymującej 12–16 mg na dobę harmonogram miareczkowania FANAPT wynosił 1 mg dwa razy dziennie w dniach 1 i 2, 2 mg dwa razy dziennie w dniach 3 i 4, 4 mg dwa razy dziennie w dniach 5 i 6 oraz 6 mg dwa razy dziennie codziennie w dniu 7. W grupie otrzymującej 20–24 mg na dobę harmonogram miareczkowania FANAPT wynosił 1 mg dwa razy dziennie w 1. dniu, 2 mg dwa razy dziennie w 2. dniu, 4 mg dwa razy dziennie w dniu 3, 6 mg dwa razy dziennie w dniach 4 i 5, 8 mg dwa razy dziennie w dniu 6 i 10 mg dwa razy dziennie w dniu 7. Pierwszorzędowym punktem końcowym była zmiana w stosunku do wartości wyjściowej całkowitego wyniku BPRS pod koniec leczenia (dzień 42). Zarówno zakresy dawek 12-16 mg / dobę, jak i 20-24 mg / dobę FANAPT były lepsze niż placebo w całkowitym wyniku BPRS. Aktywny kontrolny lek przeciwpsychotyczny okazał się lepszy od FANAPT w tym badaniu w ciągu pierwszych 2 tygodnie, odkrycie, które można częściowo wyjaśnić szybszym miareczkowaniem, które było możliwe narkotyk. U pacjentów w tym badaniu, którzy kontynuowali leczenie przez co najmniej 2 tygodnie, wydaje się, że iloperidon ma porównywalną skuteczność do aktywnej kontroli.
Czterotygodniowe, kontrolowane placebo badanie (n = 604) obejmowało jedną ustaloną dawkę FANAPT (24 mg / dzień) w porównaniu z placebo i aktywną kontrolę (zyprazydon). Harmonogram miareczkowania dla tego badania był podobny do harmonogramu dla badania 6-tygodniowego. Badanie to obejmowało zwiększanie dawki FANAPT, zaczynając od 1 mg dwa razy dziennie w Dniu 1 i zwiększanie do 2, 4, 6, 8, 10 i 12 mg dwa razy dziennie w Dniach 2, 3, 4, 5, 6 i 7. Pierwszorzędowym punktem końcowym była zmiana w stosunku do wartości wyjściowej całkowitego wyniku PANSS pod koniec leczenia (dzień 28). Dawka 24 mg / dzień FANAPT była lepsza niż placebo w całkowitym wyniku PANSS. Wydaje się, że FANAPT ma podobną skuteczność do aktywnego leku kontrolnego, który również wymagał powolnego dostosowywania dawki docelowej.
W długoterminowym badaniu klinicznie stabilni dorośli pacjenci ambulatoryjni (n = 303) spełniający kryteria DSM-IV dla schizofrenii, którzy pozostali stabilni po 12 tygodniach otwarte leczenie elastycznymi dawkami FANAPT (8 mg / dobę - 24 mg / dobę podawane w dawkach dwa razy na dobę) losowo przydzielono do grupy placebo lub kontynuowano ich aktualna dawka FANAPT (8 mg / dobę - 24 mg / dobę podawana w dawkach dwa razy na dobę) w celu obserwacji możliwego nawrotu choroby podczas nawrotu podwójnie ślepej próby faza zapobiegania. Stabilizacja podczas fazy otwartej została zdefiniowana jako przyjmowanie ustalonej dawki FANAPT, która nie uległa zmianie ze względu na skuteczność w 4 tygodnie przed randomizacją, mający wskaźnik ciężkości CGI ≤4 i łączny wynik PANSS ≤70, wynik ≤4 na każdym z następujących pojedynczych elementów PANSS (urojenia P1, dezorganizacja P2, Zachowanie halucynacyjne P3, podejrzliwość / prześladowanie P6, wrogość P7 lub brak współpracy ze strony G8), brak hospitalizacji lub zwiększenie poziomu opieki w leczeniu zaostrzenia. Nawrót lub zbliżający się nawrót podczas podwójnie zaślepionej fazy zapobiegania nawrotowi zdefiniowano jako dowolny z następujące: hospitalizacja z powodu pogorszenia się schizofrenii, wzrost (pogorszenie) całkowitego wyniku PANSS ≥30%, CGI-
Wynik poprawy ≥6, pacjent miał zachowania samobójcze, zabójcze lub agresywne lub potrzebował innego leku przeciwpsychotycznego.

Na podstawie analizy tymczasowej niezależny komitet monitorujący dane zdecydował, że badanie należy przerwać wcześniej ze względu na dowody skuteczności. W oparciu o wyniki analizy okresowej, które zostały potwierdzone przez ostateczny zestaw danych analizy, pacjenci leczeni FANAPT doświadczył statystycznie istotnego dłuższego czasu do nawrotu lub zbliżającego się nawrotu niż pacjenci, którzy otrzymali placebo. Ryc. 1 pokazuje szacunkową łączną proporcję pacjentów z nawrotem lub zbliżającym się nawrotem na podstawie końcowego zestawu danych.
Top
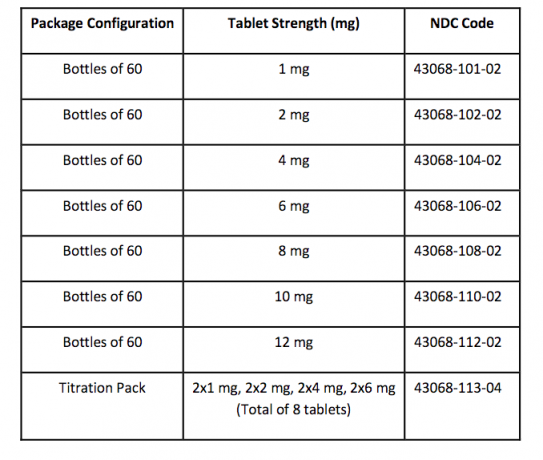
Jak dostarczane / Przechowywanie i obsługa
Tabletki FANAPT są białe, okrągłe i oznaczone wytłoczonym logo z jednej strony i napisem „1”, „2”, „4”, „6”, „8”, „10” lub „12” z wytłoczonym logo z drugiej strony bok. Tablety są dostarczane w następujących mocach i konfiguracjach opakowań:
Przechowywanie
Tabletki FANAPT należy przechowywać w kontrolowanej temperaturze pokojowej, 25 ° C (77 ° F); wycieczki dozwolone do 15 ° do 30 ° C (59 ° do 86 ° F) [Patrz temperatura pokojowa kontrolowana przez USP]. Chroń tabletki FANAPT przed działaniem światła i wilgoci.
INFORMACJE DLA PACJENTA
Zaleca się, aby lekarze omawiali następujące kwestie z pacjentami, którym przepisują FANAPT:
Przedłużenie odstępu QT
Pacjentom należy zalecić niezwłoczne skonsultowanie się z lekarzem, jeśli poczują się słabo, stracą przytomność lub kołatają serce. Należy pouczyć pacjentów, aby nie przyjmowali FANAPT z innymi lekami powodującymi wydłużenie odstępu QT. Pacjentów należy poinformować, aby informowali lekarzy o przyjmowaniu leku FANAPT przed przyjęciem jakiegokolwiek nowego leku.
Złośliwy zespół neuroleptyczny
Pacjentów i opiekunów należy poinformować, że czasami może wystąpić kompleks objawów potencjalnie śmiertelnych jak zgłaszano NMS w związku z podawaniem leków przeciwpsychotycznych, w tym FANAPT. Oznaki i objawy NMS obejmują hiperpreksję, sztywność mięśni, zmieniony stan psychiczny i dowody autonomii
niestabilność (nieregularny puls lub ciśnienie krwi, tachykardia, obfite pocenie się i zaburzenia rytmu serca).
Zmiany metaboliczne
Pacjenci powinni być świadomi objawów hiperglikemii (wysoki poziom cukru we krwi) i cukrzycy. Pacjenci, u których zdiagnozowano cukrzycę, ci z czynnikami ryzyka cukrzycy lub ci, którzy je rozwijają objawy podczas leczenia należy monitorować poziom glukozy we krwi na początku i okresowo w trakcie leczenie. Należy poinformować pacjentów, że podczas leczenia FANAPT doszło do zwiększenia masy ciała. Zaleca się kliniczne monitorowanie masy ciała.
Niedociśnienie ortostatyczne
Pacjentów należy poinformować o ryzyku wystąpienia niedociśnienia ortostatycznego, szczególnie w chwili rozpoczynania leczenia, wznawiania leczenia lub zwiększania dawki.
Zakłócenia wydajności poznawczej i motorycznej
Ponieważ FANAPT może potencjalnie wpływać na zdolność osądu, myślenia lub zdolności motorycznych, pacjentów należy ostrzec obsługiwanie niebezpiecznych maszyn, w tym samochodów, do czasu, aż będą mieli wystarczającą pewność, że terapia FANAPT ich nie dotyczy niekorzystnie.
Ciąża
Poinformuj pacjentów, że stosowanie Fanapt w trzecim trymestrze ciąży może powodować objawy pozapiramidowe i (lub) odstawienne u noworodka. Poradzić pacjentom, aby powiadomiły lekarza o znanej lub podejrzewanej ciąży.
Rejestr ciąż
Poinformuj pacjentów, że istnieje rejestr narażenia na ciążę, który monitoruje wyniki ciąży u kobiet narażonych na FANAPT podczas ciąży
Laktacja
Poradzić kobietom, aby nie karmiły piersią podczas leczenia lekiem FANAPT.
Jednoczesne leki
Należy doradzić pacjentom, aby informowali swoich lekarzy o przyjmowaniu lub planowaniu przyjmowania jakichkolwiek leków na receptę lub dostępnych bez recepty, ponieważ istnieje możliwość interakcji.
Alkohol
Należy zalecić pacjentom, aby unikali spożywania alkoholu podczas przyjmowania leku FANAPT.
Ekspozycja na ciepło i odwodnienie
Pacjentów należy poinformować o właściwej opiece, aby uniknąć przegrzania i odwodnienia.
Dystrybuowane przez:
Vanda Pharmaceuticals Inc.
Waszyngton, D.C. 20037 USA
Vanda i Fanapt® są zastrzeżonymi znakami towarowymi firmy Vanda Pharmaceuticals Inc. w Stanach Zjednoczonych i innych krajach.
powrót do góry
Fanapt (Iloperidone) Przewodnik po przepisywaniu (PDF)
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
ostatnia aktualizacja 07/13
wrócić do: Strona główna farmakologii leków psychiatrycznych



