NovoLog do leczenia cukrzycy
Nazwa marki: NovoLog
Nazwa ogólna: insulina aspart
Postać dawkowania: zastrzyk
Zawartość:
Wskazania i zastosowanie
Dawkowanie i sposób podawania
Formy dawkowania i moce
Przeciwwskazania
Ostrzeżenia i środki
Działania niepożądane
Interakcje z lekami
Użyj w określonych populacjach
Przedawkowanie
Opis
Farmakologia kliniczna
Toksykologia niekliniczna
Studia kliniczne
Jak dostarczane / Przechowywanie i obsługa
NovoLog, insulina aspart, informacje dla pacjentów (w prostym angielskim)
Wskazania i zastosowanie
Leczenie cukrzycy
NovoLog jest analogiem insuliny wskazanym do poprawy kontroli glikemii u dorosłych i dzieci z cukrzycą.
Top
Dawkowanie i sposób podawania
Dawkowanie
NovoLog jest analogiem insuliny o wcześniejszym działaniu niż zwykła insulina ludzka. Dawkowanie NovoLog musi być zindywidualizowane. NovoLog podawany we wstrzyknięciu podskórnym należy zasadniczo stosować w schematach z insuliną o pośrednim lub długo działającym działaniu [patrz Ostrzeżenia i środki, Jak dostarczane / Przechowywanie i obsługa]. Całkowite dzienne zapotrzebowanie na insulinę może się różnić i zwykle wynosi od 0,5 do 1,0 jednostek / kg / dzień. W przypadku stosowania w schemacie leczenia podskórnego wstrzyknięcia związanego z posiłkiem od 50 do 70% całkowitej insuliny wymagania mogą być określone przez NovoLog, a pozostała część przez pośrednio działające lub długo działająca insulina. Ze względu na stosunkowo szybki początek NovoLog i krótki czas działania obniżającego stężenie glukozy, niektórzy pacjenci mogą wymagać więcej podstawowa insulina i więcej całkowitej insuliny, aby zapobiec hiperglikemii przed posiłkiem podczas korzystania z NovoLog niż podczas zwykłego stosowania u ludzi insulina.
Nie należy używać NovoLog, który jest lepki (pogrubiony) lub mętny; używaj tylko, jeśli jest przezroczysty i bezbarwny. NovoLog nie powinien być używany po wydrukowanej dacie ważności.
Wstrzyknięcie podskórne
NovoLog należy podawać we wstrzyknięciu podskórnym w okolice brzucha, pośladków, ud lub ramienia. Ponieważ NovoLog ma szybszy początek i krótszy czas działania niż zwykła ludzka insulina, należy go wstrzyknąć natychmiast (w ciągu 5-10 minut) przed posiłkiem. Miejsca wstrzyknięcia należy obracać w obrębie tego samego regionu, aby zmniejszyć ryzyko lipodystrofii. Tak jak w przypadku wszystkich insulin, czas działania NovoLog będzie się różnić w zależności od dawki, miejsca wstrzyknięcia, przepływu krwi, temperatury i poziomu aktywności fizycznej.
NovoLog można rozcieńczyć pożywką do rozcieńczania insuliny dla NovoLog do wstrzykiwań podskórnych. Rozcieńczenie jednej części NovoLog do dziewięciu części rozcieńczalnika da stężenie o jedną dziesiątą stężenia NovoLog (równoważne U-10). Rozcieńczenie jednej części NovoLog do jednej części rozcieńczalnika da stężenie o połowę mniejsze niż NovoLog (równoważne U-50).
Ciągły podskórny wlew insuliny (CSII) przez pompę zewnętrzną
NovoLog można również podawać podskórnie za pomocą zewnętrznej pompy insulinowej [patrz Ostrzeżenia i środki, Jak dostarczane / Przechowywanie i obsługa]. Rozcieńczonej insuliny nie należy stosować w zewnętrznych pompach insulinowych. Ponieważ NovoLog ma szybszy początek i krótszy czas działania niż zwykła ludzka insulina, bolusy leku NovoLog przed posiłkiem należy podać natychmiast (w ciągu 5-10 minut) przed posiłkiem. Miejsca infuzji należy obracać w tym samym regionie, aby zmniejszyć ryzyko lipodystrofii. Wstępne programowanie zewnętrznej pompy infuzyjnej z insuliną powinno opierać się na całkowitej dziennej dawce insuliny z poprzedniego schematu. Chociaż istnieje znaczna zmienność między pacjentami, około 50% całkowitej dawki jest zwykle podawane w bolusach NovoLog związanych z posiłkiem, a pozostała część jest podawana w infuzji podstawowej. Zmień NovoLog w zbiorniku, zestawach infuzyjnych i miejscu wprowadzenia zestawu infuzyjnego co najmniej co 48 godzin.
Podanie dożylne
NovoLog można podawać dożylnie pod nadzorem lekarza w celu kontroli glikemii z dokładnym monitorowaniem poziomu glukozy we krwi i potasu, aby uniknąć hipoglikemii i hipokaliemii [patrz Ostrzeżenia i środki, Jak dostarczane / Przechowywanie i obsługa]. Do podawania dożylnego NovoLog należy stosować w stężeniach od 0,05 U / ml do 1,0 U / ml insuliny aspart w systemach infuzyjnych z użyciem polipropylenowych worków infuzyjnych. Wykazano, że NovoLog jest stabilny w płynach infuzyjnych, takich jak 0,9% chlorek sodu.
Przed podaniem pozajelitowym sprawdź NovoLog pod kątem cząstek stałych i przebarwień.
Top
Formy dawkowania i moce
NovoLog jest dostępny w następujących wielkościach opakowań: każda prezentacja zawiera 100 jednostek insuliny aspart na ml (U-100).
- Fiolki 10 ml
- Wkłady PenFill o pojemności 3 ml do urządzenia do podawania wkładów PenFill o pojemności 3 ml (z dodatkiem NovoPen® 3 PenMate® lub bez) z jednorazowymi igłami NovoFine®
- 3 ml ampułko-strzykawka NovoLog FlexPen
Top
Przeciwwskazania
NovoLog jest przeciwwskazany
- podczas epizodów hipoglikemii
- u pacjentów z nadwrażliwością na NovoLog lub jedną z jego substancji pomocniczych.
Top
Ostrzeżenia i środki
Podawanie
NovoLog ma szybszy początek działania i krótszy czas działania niż zwykła ludzka insulina. Po wstrzyknięciu leku NovoLog należy natychmiast zjeść posiłek w ciągu 5-10 minut. Ze względu na krótki czas działania NovoLog insulinę dłużej działającą należy również stosować u pacjentów z cukrzycą typu 1 i może być również potrzebna u pacjentów z cukrzycą typu 2. Monitorowanie glukozy jest zalecane u wszystkich pacjentów z cukrzycą i jest szczególnie ważne u pacjentów stosujących terapię zewnętrzną za pomocą pompy infuzyjnej.
Każda zmiana dawki insuliny powinna być dokonywana ostrożnie i wyłącznie pod nadzorem lekarza. Zmiana jednego produktu insuliny na inny lub zmiana mocy insuliny może spowodować konieczność zmiany dawki. Podobnie jak w przypadku wszystkich preparatów insuliny, czas działania NovoLog może być różny u różnych osób lub w tym samym czasie w różnym czasie osobnik i zależy od wielu warunków, w tym miejsca wstrzyknięcia, miejscowego ukrwienia, temperatury i aktywności fizycznej. Pacjenci zmieniający poziom aktywności fizycznej lub plan posiłków mogą wymagać dostosowania dawek insuliny. Zapotrzebowanie na insulinę może ulec zmianie podczas choroby, zaburzeń emocjonalnych lub innych stresów.
Pacjenci stosujący ciągłą podskórną terapię za pomocą pompy infuzyjnej muszą zostać przeszkoleni w zakresie podawania insuliny przez wstrzyknięcie oraz mieć dostęp do alternatywnej terapii insulinowej w przypadku awarii pompy.
Hipoglikemia
Hipoglikemia jest najczęstszym działaniem niepożądanym wszystkich terapii insulinowych, w tym NovoLog. Ciężka hipoglikemia może prowadzić do utraty przytomności i / lub drgawek oraz może powodować tymczasowe lub trwałe upośledzenie funkcji mózgu lub śmierć. Ciężka hipoglikemia wymagająca pomocy innej osoby i / lub pozajelitowego wlewu glukozy lub podawanie glukagonu obserwowano w badaniach klinicznych z insuliną, w tym w badaniach z NovoLog.
Czas hipoglikemii zwykle odzwierciedla profil czasowy działania podanych preparatów insuliny [patrz Farmakologia kliniczna]. Inne czynniki, takie jak zmiany w przyjmowaniu pokarmu (np. Ilość posiłków lub czas posiłków), miejsce wstrzyknięcia, ćwiczenia i inne leki mogą również zmieniać ryzyko hipoglikemii [patrz Interakcje z lekami]. Podobnie jak w przypadku wszystkich insulin, należy zachować ostrożność u pacjentów z nieświadomością hipoglikemii oraz u pacjentów, którzy mogą być predysponowani do hipoglikemii (np. Pacjenci na czczo lub przyjmujący nieprawidłowe posiłki). Zdolność koncentracji i reakcji pacjenta może być zaburzona w wyniku hipoglikemii. Może to stanowić ryzyko w sytuacjach, w których zdolności te są szczególnie ważne, takich jak prowadzenie pojazdów lub obsługiwanie innych maszyn.
Gwałtowne zmiany poziomu glukozy w surowicy mogą wywoływać objawy hipoglikemii u osób z cukrzycą, niezależnie od wartości glukozy. Wczesne ostrzeżenie objawy hipoglikemii mogą być różne lub mniej wyraźne w pewnych warunkach, takich jak długotrwała cukrzyca, choroba nerwu cukrzycowego, stosowanie leków takich jak beta-adrenolityki lub nasilona cukrzyca kontrola [patrz Interakcje z lekami]. Sytuacje te mogą powodować ciężką hipoglikemię (i być może utratę przytomności) przed uświadomieniem pacjentowi hipoglikemii. Dożylnie podawana insulina ma szybszy początek działania niż insulina podawana podskórnie, co wymaga dokładniejszego monitorowania hipoglikemii.
Hipokaliemia
Wszystkie produkty insulinowe, w tym NovoLog, powodują przesunięcie potasu z przestrzeni pozakomórkowej do wewnątrzkomórkowej, prowadząc do hipokaliemii, która nieleczona może powodować paraliż oddechowy, arytmię komorową i śmierć. Należy zachować ostrożność u pacjentów, którzy mogą być narażeni na hipokaliemię (np. Pacjenci stosujący leki obniżające potas, pacjenci przyjmowanie leków wrażliwych na stężenie potasu w surowicy i pacjentów otrzymujących dożylnie insulina).
Zaburzenia czynności nerek
Podobnie jak w przypadku innych insulin, wymagania dotyczące dawki NovoLog mogą być zmniejszone u pacjentów z zaburzeniami czynności nerek [patrz Farmakologia kliniczna].
Zaburzenia czynności wątroby
Podobnie jak w przypadku innych insulin, wymagania dotyczące dawki NovoLog mogą być zmniejszone u pacjentów z zaburzeniami czynności wątroby [patrz Farmakologia kliniczna].
Nadwrażliwość i reakcje alergiczne
Reakcje miejscowe - Podobnie jak w przypadku innych insulinoterapii, w miejscu wstrzyknięcia NovoLog pacjenci mogą odczuwać zaczerwienienie, obrzęk lub swędzenie. Reakcje te zwykle ustępują w ciągu kilku dni do kilku tygodni, ale w niektórych przypadkach mogą wymagać przerwania stosowania NovoLog. W niektórych przypadkach reakcje te mogą być związane z czynnikami innymi niż insulina, takimi jak czynniki drażniące w środku do czyszczenia skóry lub zła technika iniekcji. Zgłaszano miejscowe reakcje i uogólnione bóle mięśni po wstrzyknięciu metakrezolu, który jest substancją pomocniczą w produkcie NovoLog.
Reakcje ogólnoustrojowe - Ciężkie, zagrażające życiu, uogólnione alergie, w tym anafilaksja, mogą wystąpić w przypadku każdego produktu insulinowego, w tym NovoLog. Po zatwierdzeniu zgłaszano reakcje anafilaktyczne z NovoLog. Uogólniona alergia na insulinę może również powodować wysypkę na całym ciele (w tym świąd), duszność, świszczący oddech, niedociśnienie, tachykardię lub obfite pocenie się. W kontrolowanych badaniach klinicznych reakcje alergiczne zgłaszano u 3 z 735 pacjentów (0,4%) leczonych zwykłą insuliną ludzką i 10 z 1394 pacjentów (0,7%) leczonych produktem NovoLog. W kontrolowanych i niekontrolowanych badaniach klinicznych 3 z 2341 (0,1%) pacjentów leczonych produktem NovoLog przerwało leczenie z powodu reakcji alergicznych.
Produkcja przeciwciał
U pacjentów leczonych produktem NovoLog zaobserwowano wzrost mian przeciwciał przeciw insulinie reagujących zarówno z insuliną ludzką, jak i insuliną aspart. Wzrosty przeciwciał przeciw insulinie obserwuje się częściej w przypadku NovoLog niż w przypadku zwykłej ludzkiej insuliny. Dane z 12-miesięcznego kontrolowanego badania z udziałem pacjentów z cukrzycą typu 1 sugerują, że wzrost tych przeciwciał jest przejściowy i różnice poziomy przeciwciał między zwykłą grupą leczoną ludzką insuliną a insuliną aspart obserwowane po 3 i 6 miesiącach nie były już widoczne po 12 miesięcy. Znaczenie kliniczne tych przeciwciał nie jest znane. Przeciwciała te nie wydają się powodować pogorszenia kontroli glikemii ani nie wymagają zwiększania dawki insuliny.
Mieszanie Insulin
- Mieszanie NovoLog z ludzką insuliną NPH bezpośrednio przed wstrzyknięciem osłabia maksymalne stężenie NovoLog, bez znaczącego wpływu na czas do osiągnięcia maksymalnego stężenia lub całkowitą biodostępność NovoLog. Jeśli NovoLog zostanie zmieszany z ludzką insuliną NPH, należy najpierw pobrać NovoLog do strzykawki, a mieszaninę należy wstrzyknąć natychmiast po zmieszaniu.
- Skuteczność i bezpieczeństwo mieszania NovoLog z preparatami insuliny produkowanymi przez innych producentów nie były badane.
- Mieszanin insuliny nie należy podawać dożylnie.
Ciągły podskórny wlew insuliny przez pompę zewnętrzną
W przypadku stosowania w zewnętrznej podskórnej pompie infuzyjnej z insuliną, NovoLog nie powinien być mieszany z żadną inną insuliną lub rozcieńczalnikiem. Podczas korzystania z NovoLog w zewnętrznej pompie insulinowej należy przestrzegać informacji specyficznych dla NovoLog (np. Czas użytkowania, częstotliwość zmiany zestawów infuzyjnych), ponieważ informacje specyficzne dla NovoLog mogą różnić się od ogólnej instrukcji pompy instrukcje.
Nieprawidłowe działanie pompy lub zestawu infuzyjnego lub degradacja insuliny może prowadzić do szybkiego wystąpienia hiperglikemii i ketozy z powodu małego podskórnego depotu insuliny. Jest to szczególnie istotne w przypadku szybko działających analogów insuliny, które są szybciej wchłaniane przez skórę i mają krótszy czas działania. Konieczna jest szybka identyfikacja i korekta przyczyny hiperglikemii lub ketozy. Konieczna może być terapia przejściowa z zastrzykiem podskórnym [patrz Dawkowanie i sposób podawania, Ostrzeżenia i środki, i Jak dostarczane / Przechowywanie i obsługa].
NovoLog jest zalecany do stosowania w systemach pomp odpowiednich do infuzji insuliny, wymienionych poniżej.
Lakierki:
Seria MiniMed 500 i inne równoważne pompy.
Zbiorniki i zestawy infuzyjne:
NovoLog jest zalecany do stosowania w zbiornikach i zestawach infuzyjnych zgodnych z insuliną i określoną pompą. Badania in vitro wykazały, że nieprawidłowe działanie pompy, utrata metakrezolu i degradacja insuliny mogą wystąpić, gdy NovoLog jest utrzymywany w układzie pomp przez ponad 48 godzin. Zbiorniki i zestawy infuzyjne należy wymieniać co najmniej co 48 godzin.
NovoLog nie powinien być wystawiony na działanie temperatur wyższych niż 37 ° C (98,6 ° F). NovoLog, który będzie stosowany w pompie, nie powinien być mieszany z inną insuliną lub rozcieńczalnikiem [patrz Dawkowanie i sposób podawania, Ostrzeżenia i środki, i Jak dostarczane / Przechowywanie i obsługa].
Top
Działania niepożądane
Doświadczenie z próby klinicznej
Ponieważ badania kliniczne prowadzone są w ramach bardzo różnych schematów, wskaźniki działań niepożądanych zgłaszane w jednym badaniu klinicznym mogą nie być można je łatwo porównać do wskaźników zgłoszonych w innym badaniu klinicznym i może nie odzwierciedlać wskaźników rzeczywiście zaobserwowanych w badaniu klinicznym ćwiczyć.
- Hipoglikemia
Hipoglikemia jest najczęściej obserwowanym działaniem niepożądanym u pacjentów stosujących insulinę, w tym NovoLog [patrz Ostrzeżenia i środki].
- Inicjacja insuliny i intensyfikacja kontroli glukozy
Intensyfikacja lub szybka poprawa kontroli glikemii była związana z przemijającym, odwracalnym zaburzenie refrakcji okulistycznej, nasilenie retinopatii cukrzycowej i ostre bolesne objawy obwodowe neuropatia. Jednak długotrwała kontrola glikemii zmniejsza ryzyko retinopatii cukrzycowej i neuropatii.
- Lipodystrofia
Długotrwałe stosowanie insuliny, w tym NovoLog, może powodować lipodystrofię w miejscu powtarzanych zastrzyków lub infuzji. Lipodystrofia obejmuje lipohipertrofię (pogrubienie tkanki tłuszczowej) i lipoatrofię (przerzedzenie tkanki tłuszczowej) i może wpływać na wchłanianie insuliny. Obróć miejsca wstrzyknięcia lub infuzji insuliny w tym samym regionie, aby zmniejszyć ryzyko lipodystrofii.
- Przybranie na wadze
Przyrost masy ciała może wystąpić w przypadku niektórych terapii insulinowych, w tym NovoLog, i przypisywany jest anabolicznemu działaniu insuliny i zmniejszeniu glukozurii.
- Obrzęk obwodowy
Insulina może powodować zatrzymanie sodu i obrzęk, szczególnie jeśli wcześniej słaba kontrola metaboliczna ulegnie poprawie dzięki zintensyfikowanej terapii insulinowej.
- Częstotliwość działań niepożądanych leków
Częstotliwość działań niepożądanych leków podczas badań klinicznych NovoLog u pacjentów z cukrzycą typu 1 i cukrzycą typu 2 wymieniono w poniższych tabelach.
Tabela 1: Zdarzenia niepożądane związane z leczeniem u pacjentów z cukrzycą typu 1 (zdarzenia niepożądane z częstością 5% i występującymi częściej z NovoLogiem niż z ludzką zwykłą insuliną katalogowany)
|
NovoLog + NPH N = 596 |
Zwykła insulina ludzka + NPH N = 286 |
|||
| Preferowany termin | N. | (%) | N. | (%) |
| Hipoglikemia * | 448 | 75% | 205 | 72% |
| Bół głowy | 70 | 12% | 28 | 10% |
| Przypadkowe obrażenia | 65 | 11% | 29 | 10% |
| Nudności | 43 | 7% | 13 | 5% |
| Biegunka | 28 | 5% | 9 | 3% |
* Hipoglikemia jest definiowana jako epizod stężenia glukozy we krwi
Tabela 2: Zdarzenia niepożądane związane z leczeniem u pacjentów z cukrzycą typu 2 (z wyjątkiem hipoglikemii, zdarzeniami niepożądanymi z częstością 5% i występującymi częściej z NovoLogiem niż z ludzką zwykłą insuliną katalogowany)
|
NovoLog + NPH N = 91 |
Zwykła insulina ludzka + NPH N = 91 |
|||
| N. | (%) | N. | (%) | |
| Hipoglikemia * | 25 | 27% | 33 | 36% |
| Hiporefleksja | 10 | 11% | 6 | 7% |
| Grzybica paznokci | 9 | 10% | 5 | 5% |
| Zaburzenia czuciowe | 8 | 9% | 6 | 7% |
| Zakażenie dróg moczowych | 7 | 8% | 6 | 7% |
| Ból w klatce piersiowej | 5 | 5% | 3 | 3% |
| Bół głowy | 5 | 5% | 3 | 3% |
| Zaburzenia skóry | 5 | 5% | 2 | 2% |
| Ból brzucha | 5 | 5% | 1 | 1% |
| Zapalenie zatok | 5 | 5% | 1 | 1% |
* Hipoglikemia jest definiowana jako epizod stężenia glukozy we krwi
Dane po wprowadzeniu do obrotu
Podczas stosowania NovoLog po zatwierdzeniu zidentyfikowano następujące dodatkowe działania niepożądane. Ponieważ te działania niepożądane są zgłaszane dobrowolnie w populacji o niepewnej wielkości, ogólnie nie jest możliwe wiarygodne oszacowanie ich częstości. Podczas stosowania po zatwierdzeniu zidentyfikowano błędy w lekach, w których inne insuliny zostały przypadkowo zastąpione produktem NovoLog.
Top
Interakcje z lekami
Wiele substancji wpływa na metabolizm glukozy i może wymagać dostosowania dawki insuliny oraz szczególnie ścisłego monitorowania.
- Poniżej podano przykłady substancji, które mogą nasilać działanie obniżające stężenie glukozy we krwi i podatność na hipoglikemię: doustne produkty przeciwcukrzycowe, pramlintid, ACE inhibitory, dizopiramid, fibraty, fluoksetyna, inhibitory monoaminooksydazy (MAO), propoksyfen, salicylany, analog somatostatyny (np. oktreotyd), sulfonamid antybiotyki
- Poniżej podano przykłady substancji, które mogą zmniejszać działanie obniżające stężenie glukozy we krwi: kortykosteroidy, niacyna, danazol, leki moczopędne, leki sympatykomimetyczne (np. epinefryna, salbutamol, terbutalina), izoniazyd, pochodne fenotiazyny, somatropina, hormony tarczycy, estrogeny, progestageny (np. doustne środki antykoncepcyjne), nietypowe leki przeciwpsychotyczne.
- Beta-adrenolityki, klonidyna, sole litu i alkohol mogą nasilać lub osłabiać działanie insuliny na obniżenie poziomu glukozy we krwi.
- Pentamidyna może powodować hipoglikemię, po której czasami może wystąpić hiperglikemia.
- Objawy hipoglikemii mogą być zmniejszone lub nieobecne u pacjentów przyjmujących produkty sympatykolityczne, takie jak beta-adrenolityki, klonidyna, guanetydyna i rezerpina.
Top
Użyj w określonych populacjach
Ciąża
Kategoria ciąży B. We wszystkich ciążach występuje ryzyko wady wrodzonej, utraty lub innego niekorzystnego wyniku niezależnie od ekspozycji na lek. Ryzyko to wzrasta w czasie ciąży powikłanej hiperglikemią i może być zmniejszone przy dobrej kontroli metabolicznej. U pacjentów z cukrzycą lub cukrzycą ciężarnych w wywiadzie istotne jest utrzymanie dobrej kontroli metabolicznej przed poczęciem i przez cały okres ciąży. Zapotrzebowanie na insulinę może zmniejszyć się w pierwszym trymestrze ciąży, ogólnie wzrosnąć w drugim i trzecim trymestrze ciąży i gwałtownie spaść po porodzie. U tych pacjentów niezbędne jest staranne monitorowanie kontroli stężenia glukozy. Dlatego pacjentki powinny zostać poinformowane o konieczności poinformowania lekarza o zamiarze zajścia w ciążę lub zajścia w ciążę podczas przyjmowania leku NovoLog.
W otwartym, randomizowanym badaniu porównano bezpieczeństwo i skuteczność NovoLog (n = 157) w porównaniu do zwykłej ludzkiej insuliny (n = 165) u 322 kobiet w ciąży z cukrzycą typu 1. Dwie trzecie włączonych pacjentów było już w ciąży, kiedy weszły do badania. Ponieważ tylko jedna trzecia pacjentów włączonych przed poczęciem, badanie nie było wystarczająco duże, aby ocenić ryzyko wad wrodzonych. Obie grupy osiągnęły średni poziom HbA1c wynoszący ~ 6% podczas ciąży i nie było znaczącej różnicy w częstości występowania hipoglikemii u matek.
Przeprowadzono badania podskórnego rozrodu i badań teratologicznych z użyciem NovoLog i zwykłej ludzkiej insuliny u szczurów i królików. W tych badaniach NovoLog podawano samicom szczurów przed kryciem, podczas krycia i przez całą ciążę oraz królikom podczas organogenezy. Działanie leku NovoLog nie różniło się od obserwowanego w przypadku podskórnej regularnej insuliny ludzkiej. NovoLog, podobnie jak ludzka insulina, powodował straty przed i po implantacji oraz nieprawidłowości trzewne / szkieletowe u szczurów w dawce 200 j./kg mc./dobę (około 32 razy więcej niż ludzka podskórna dawka 1,0 U / kg / dzień, w oparciu o U / powierzchnię ciała) oraz u królików w dawce 10 U / kg / dzień (około trzy razy większa niż dawka podskórna u ludzi 1,0 U / kg / dzień, w oparciu o U / powierzchnia ciała powierzchnia). Skutki są prawdopodobnie wtórne do matczynej hipoglikemii w dużych dawkach. Nie zaobserwowano znaczących efektów u szczurów w dawce 50 U / kg / dobę i u królików w dawce 3 U / kg / dobę. Dawki te są około 8 razy większe niż ludzka dawka podskórna 1,0 U / kg / dobę dla szczurów i równa ludzkiej dawce podskórnej 1,0 U / kg / dobę dla królików, w oparciu o U / powierzchnię ciała.
Matki karmiące
Nie wiadomo, czy insulina aspart przenika do mleka ludzkiego. Stosowanie NovoLog jest zgodne z karmieniem piersią, ale kobiety z cukrzycą karmiące piersią mogą wymagać dostosowania dawek insuliny.
Zastosowanie pediatryczne
NovoLog jest zatwierdzony do stosowania u dzieci w codziennych podskórnych zastrzykach oraz w ciągłym wlewie podskórnym za pomocą zewnętrznej pompy insulinowej. Patrz sekcja STUDIA KLINICZNE do streszczeń badań klinicznych.
Zastosowanie geriatryczne
Z ogólnej liczby pacjentów (n = 1375) leczonych produktem NovoLog w 3 kontrolowanych badaniach klinicznych 2,6% (n = 36) było w wieku 65 lat lub starszych. Połowa z tych pacjentów miała cukrzycę typu 1 (18/1285), a druga połowa miała cukrzycę typu 2 (18/90). Odpowiedź HbA1c na NovoLog w porównaniu z insuliną ludzką nie różniła się pod względem wieku, szczególnie u pacjentów z cukrzycą typu 2. Konieczne są dodatkowe badania w większych populacjach pacjentów w wieku 65 lat lub starszych, aby wyciągnąć wnioski dotyczące bezpieczeństwa NovoLog u osób starszych w porównaniu z młodszymi pacjentami. Nie przeprowadzono badań farmakokinetycznych / farmakodynamicznych w celu oceny wpływu wieku na początek działania NovoLog.
Top
Przedawkowanie
Nadmierne podawanie insuliny może powodować hipoglikemię, a zwłaszcza podanie dożylne, hipokaliemię. Łagodne epizody hipoglikemii zwykle można leczyć doustną glukozą. Konieczne może być dostosowanie dawki leku, schematów posiłków lub ćwiczeń fizycznych. Cięższe epizody ze śpiączką, drgawkami lub zaburzeniami neurologicznymi można leczyć domięśniowo / podskórnie glukagonem lub stężonym glukozą dożylną. Konieczne może być ciągłe przyjmowanie węglowodanów i obserwacja, ponieważ hipoglikemia może nawrócić po widocznym wyleczeniu klinicznym. Hipokaliemia musi zostać odpowiednio skorygowana.
Top
Opis
NovoLog (wstrzyknięcie insuliny aspart [rDNA]) jest szybko działającym analogiem ludzkiej insuliny stosowanym do obniżania poziomu glukozy we krwi. NovoLog jest homologiczny ze zwykłą ludzką insuliną, z wyjątkiem pojedynczego podstawienia aminokwasu proliny przez kwas asparaginowy w pozycji B28 i jest wytwarzany za pomocą technologii rekombinacji DNA z wykorzystaniem Saccharomyces cerevisiae (piekarni drożdże). Insulina aspart ma wzór empiryczny C.256H.381N.65079S.6 i masa cząsteczkowa 585,8.
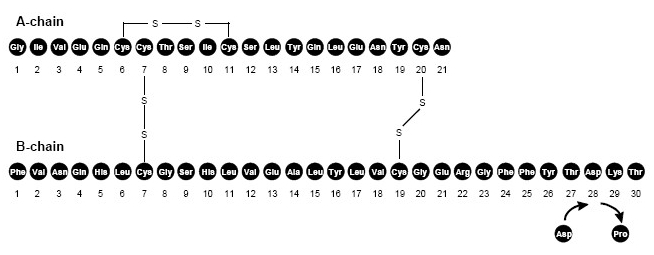
Rycina 1. Wzór strukturalny insuliny aspart.
NovoLog jest jałowym, wodnym, przezroczystym i bezbarwnym roztworem, który zawiera insulinę aspart 100 jednostek / ml, glicerynę 16 mg / ml, fenol 1,50 mg / ml, metakrezol 1,72 mg / ml, cynk 19,6 mcg / ml, disodu wodorofosforan dwuwodny 1,25 mg / ml i chlorek sodu 0,58 mg / ml PH NovoLog wynosi 7,2-7,6. Kwas solny 10% i / lub wodorotlenek sodu 10% można dodać w celu dostosowania pH.
Top
Farmakologia kliniczna
Mechanizm akcji
Podstawową aktywnością NovoLog jest regulacja metabolizmu glukozy. Insuliny, w tym NovoLog, wiążą się z receptorami insuliny w komórkach mięśniowych i tłuszczowych i obniżają poziom glukozy we krwi przez ułatwianie komórkowego wychwytu glukozy i jednoczesne hamowanie produkcji glukozy z wątróbka.
Farmakodynamika
Badania normalnych ochotników i pacjentów z cukrzycą wykazały, że podskórne podawanie NovoLog ma szybszy początek działania niż zwykła ludzka insulina.
W badaniu z udziałem pacjentów z cukrzycą typu 1 (n = 22) maksymalne działanie NovoLogu na obniżenie poziomu glukozy występowało między 1 a 3 godzinami po wstrzyknięciu podskórnym (patrz ryc. 2). Czas działania NovoLog wynosi od 3 do 5 godzin. Przebieg działania insuliny i analogów insuliny, takich jak NovoLog, może się znacznie różnić u różnych osób lub u tej samej osoby. Parametry aktywności NovoLog (czas rozpoczęcia, czas szczytu i czas trwania) określone na rycinie 2 należy traktować jedynie jako ogólne wytyczne. Na szybkość wchłaniania insuliny i początek aktywności wpływa miejsce wstrzyknięcia, wysiłek fizyczny i inne zmienne [patrz Ostrzeżenia i środki].
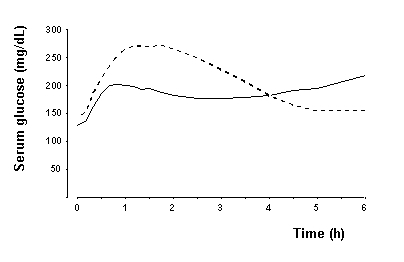
Rysunek 2. Średnie stężenie glukozy w surowicy zebrane do 6 godzin po podaniu pojedynczej dawki NovoLog przed posiłkiem (krzywa ciągła) lub zwykłą ludzką insulinę (krzywa kreskowa) wstrzykiwaną bezpośrednio przed posiłkiem u 22 pacjentów z typem 1 cukrzyca.
Podwójnie zaślepione, randomizowane, dwustronne badanie krzyżowe z udziałem 16 pacjentów z cukrzycą typu 1 wykazało, że dożylnie wlew NovoLog spowodował profil glukozy we krwi podobny do tego po wlewie dożylnym zwykłego człowieka insulina. NovoLog lub ludzka insulina była podawana w infuzji do momentu obniżenia poziomu glukozy we krwi pacjenta do 36 mg / dl lub do momentu, gdy pacjent wykazane oznaki hipoglikemii (wzrost częstości akcji serca i początek pocenia się), zdefiniowane jako czas reakcji autonomicznej (R) (patrz rysunek 3).
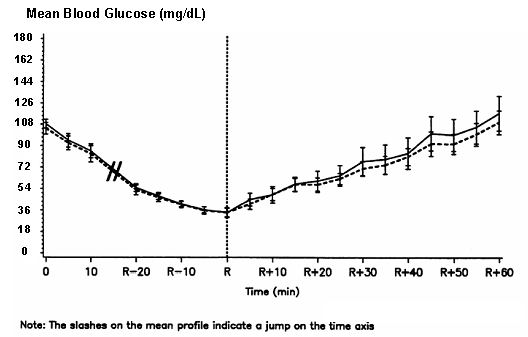
Rycina 3. Średnie stężenie glukozy w surowicy po wlewie dożylnym produktu NovoLog (krzywa kreskowa) i zwykłej ludzkiej insuliny (krzywa stała) u 16 pacjentów z cukrzycą typu 1. R oznacza czas reakcji autonomicznej.
Farmakokinetyka
Pojedyncze podstawienie aminokwasu proliny kwasem asparaginowym w pozycji B28 w NovoLog zmniejsza tendencję cząsteczki do tworzenia heksamerów, jak zaobserwowano w przypadku zwykłej ludzkiej insuliny. Dlatego NovoLog wchłania się szybciej po wstrzyknięciu podskórnym niż zwykła ludzka insulina.
W randomizowanym, podwójnie zaślepionym badaniu krzyżowym 17 zdrowych mężczyzn rasy białej w wieku od 18 do 40 lat wiek otrzymał wlew dożylny NovoLog lub zwykłej ludzkiej insuliny w dawce 1,5 mU / kg / min przez 120 minuty. Średni klirens insuliny był podobny dla dwóch grup ze średnimi wartościami 1,2 l / h / kg dla grupy NovoLog i 1,2 l / h / kg dla zwykłej grupy ludzkiej insuliny.
Biodostępność i wchłanianie - NovoLog ma szybsze wchłanianie, szybszy początek działania i krótszy czas działania niż zwykła ludzka insulina po wstrzyknięciu podskórnym (patrz ryc. 2 i Rycina 4). Względna dostępność biologiczna NovoLog w porównaniu do zwykłej ludzkiej insuliny wskazuje, że dwie insuliny są wchłaniane w podobnym stopniu.
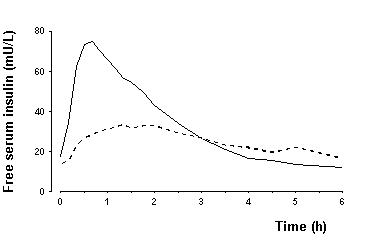
Rycina 4. Średnie seryjne średnie stężenie insuliny w surowicy zebrane do 6 godzin po podaniu pojedynczej dawki NovoLog przed posiłkiem (stała krzywa) lub zwykła ludzka insulina (krzywa kreskowa) wstrzykiwana bezpośrednio przed posiłkiem u 22 pacjentów z typem 1 cukrzyca.
W badaniach zdrowych ochotników (ogółem n = 1007) i pacjentów z cukrzycą typu 1 (ogółem n = 40), NovoLog konsekwentnie osiągał maksymalne stężenie w surowicy około dwa razy szybciej niż zwykły człowiek insulina. Mediana czasu do maksymalnego stężenia w tych badaniach wynosiła od 40 do 50 minut w przypadku NovoLog w porównaniu do 80 do 120 minut w przypadku zwykłej ludzkiej insuliny. W badaniu klinicznym z udziałem pacjentów z cukrzycą typu 1 podawano zarówno NovoLog, jak i zwykłą ludzką insulinę podskórnie w dawce 0,15 U / kg masy ciała osiągnął średnie maksymalne stężenie 82 i 36 mU / L, odpowiednio. Nie ustalono właściwości farmakokinetycznych / farmakodynamicznych insuliny aspart u pacjentów z cukrzycą typu 2.
Wewnątrzosobnicza zmienność w czasie do maksymalnego stężenia insuliny w surowicy u zdrowych ochotników płci męskiej była znacznie mniejsza dla NovoLog niż dla zwykłej ludzkiej insuliny. Znaczenie kliniczne tej obserwacji nie zostało ustalone.
W badaniu klinicznym u zdrowych nie otyłych osób różnice farmakokinetyczne między NovoLog a regularnymi insulinę ludzką opisaną powyżej obserwowano niezależnie od miejsca wstrzyknięcia (brzuch, udo lub górna część) ramię).
Dystrybucja i eliminacja - NovoLog ma niskie wiązanie z białkami osocza (<10%), podobnie jak w przypadku zwykłej ludzkiej insuliny. Po podaniu podskórnym normalnym ochotnikom płci męskiej (n = 24) NovoLog został szybciej wyeliminowany zwykła ludzka insulina o średnim pozornym okresie półtrwania wynoszącym 81 minut w porównaniu do 141 minut dla zwykłego człowieka insulina.
Określone populacje
Dzieci i młodzież - Oceniono właściwości farmakokinetyczne i farmakodynamiczne produktu NovoLog i zwykłej insuliny ludzkiej w badaniu z pojedynczą dawką u 18 dzieci (6-12 lat, n = 9) i młodzieży (13-17 lat [stopień Tannera> 2], n = 9) z typem 1 cukrzyca. Względne różnice w farmakokinetyce i farmakodynamice u dzieci i młodzieży z cukrzycą typu 1 między NovoLog a zwykłą insuliną ludzką były podobne do tych u zdrowych osób dorosłych i dorosłych z typem 1 cukrzyca.
Płeć - u zdrowych ochotników nie zaobserwowano żadnej różnicy w poziomie insuliny aspart między mężczyznami i kobietami, biorąc pod uwagę różnice masy ciała. Nie stwierdzono istotnej różnicy w skuteczności (ocenianej przez HbAlc) między płciami w badaniu z udziałem pacjentów z cukrzycą typu 1.
Otyłość - Pojedynczą dawkę podskórną 0,1 U / kg NovoLog podano w badaniu z udziałem 23 pacjentów z cukrzycą typu 1 i szerokim zakresem wskaźnika masy ciała (BMI, 22-39 kg / m2). BMI w różnych grupach na ogół nie wpływało na parametry farmakokinetyczne, AUC i Cmax NovoLog - BMI 19–23 kg / m2 (N = 4); BMI 23–27 kg / m2 (N = 7); BMI 27-32 kg / m2 (N = 6) i BMI> 32 kg / m2 (N = 6). Klirens NovoLog został zmniejszony o 28% u pacjentów z BMI> 32 kg / m2 w porównaniu do pacjentów z BMI
Zaburzenia czynności nerek - niektóre badania z ludzką insuliną wykazały zwiększony poziom insuliny w krążeniu u pacjentów z niewydolnością nerek. W badaniu podano pojedynczą dawkę podskórną 0,08 U / kg NovoLog u pacjentów z normalnym (N = 6) klirensem kreatyniny (CLcr) (> 80 ml / min) lub łagodnym (N = 7; CLcr = 50–80 ml / min), umiarkowany (N = 3; CLcr = 30-50 ml / min) lub ciężki (ale nie wymagający hemodializy) (N = 2; CLcr = Ostrzeżenia i środki ostrożności].
Zaburzenia czynności wątroby - niektóre badania z ludzką insuliną wykazały zwiększony poziom insuliny w krążeniu u pacjentów z niewydolnością wątroby. Pojedynczą dawkę podskórną 0,06 U / kg NovoLog podano w otwartym badaniu z pojedynczą dawką 24 pacjentów (N = 6 / grupę) z różnymi stopień upośledzenia czynności wątroby (łagodny, umiarkowany i ciężki) z wynikami Child-Pugh w zakresie od 0 (zdrowych ochotników) do 12 (ciężka wątroba osłabienie). W tym małym badaniu nie stwierdzono korelacji między stopniem niewydolności wątroby a jakimkolwiek parametrem farmakokinetycznym NovoLog. U pacjentów z zaburzeniami czynności wątroby może być konieczne dokładne monitorowanie stężenia glukozy i dostosowanie dawki insuliny, w tym NovoLog [patrz Ostrzeżenia i środki].
Wpływ wieku, pochodzenia etnicznego, ciąży i palenia tytoniu na farmakokinetykę i farmakodynamikę produktu NovoLog nie był badany.
Top
Toksykologia niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
Nie przeprowadzono standardowych 2-letnich badań rakotwórczości na zwierzętach, aby ocenić potencjał rakotwórczy NovoLog. W 52-tygodniowych badaniach szczurom Sprague-Dawley podawano podskórnie NovoLog w dawkach 10, 50 i 200 U / kg / dobę (około 2, 8 i 32-krotność dawki podskórnej dla człowieka wynoszącej 1,0 U / kg / dobę, w oparciu o U / powierzchnię ciała, odpowiednio). Przy dawce 200 j./kg mc./dobę NovoLog zwiększył częstość występowania guzów gruczołu sutkowego u kobiet w porównaniu z nieleczonymi kontrolami. Częstość występowania guzów sutka w przypadku NovoLog nie różniła się znacząco niż w przypadku zwykłej ludzkiej insuliny. Znaczenie tych wyników dla ludzi nie jest znane. NovoLog nie wykazywał działania genotoksycznego w następujących testach: test Amesa, test mutacji genu w przód komórki chłoniaka mysiego, ludzki obwodowy test aberracji chromosomowej limfocytów we krwi, test mikrojądrowy in vivo na myszach oraz test UDS ex vivo w wątrobie szczura hepatocyty. W badaniach płodności u samców i samic szczurów, w dawkach podskórnych do 200 U / kg / dobę (około 32-krotność dawki podskórnej u ludzi, na podstawie U / powierzchni ciała), nie stwierdzono bezpośredniego negatywnego wpływu na płodność samców i samic lub ogólnej reprodukcji zwierząt zauważony.
Toksykologia zwierząt i / lub farmakologia
W standardowych testach biologicznych na myszach i królikach jedna jednostka NovoLog ma takie samo działanie obniżające stężenie glukozy jak jedna jednostka zwykłej ludzkiej insuliny. U ludzi działanie leku NovoLog jest szybsze i trwa krócej niż w przypadku zwykłej ludzkiej insuliny, ze względu na jego szybsze wchłanianie po wstrzyknięciu podskórnym (patrz punkt FARMAKOLOGIA KLINICZNA Ryc. 2 i ryc. 4).
Top
Studia kliniczne
Codzienne zastrzyki podskórne
Przeprowadzono dwa sześciomiesięczne, otwarte badania z aktywną kontrolą w celu porównania bezpieczeństwa i skuteczności NovoLog i Novolin R u dorosłych pacjentów z cukrzycą typu 1. Ponieważ dwa schematy badań i wyniki były podobne, dane przedstawiono tylko dla jednego badania (patrz Tabela 3). NovoLog podawano we wstrzyknięciu podskórnym bezpośrednio przed posiłkami, a zwykłą ludzką insulinę podawano we wstrzyknięciu podskórnym 30 minut przed posiłkami. Insulinę NPH podawano jako insulinę podstawową w pojedynczych lub podzielonych dawkach dziennych. Zmiany poziomu HbA1c i częstości występowania ciężkiej hipoglikemii (określonej na podstawie liczby zdarzeń wymagających interwencji z trzeciej party) były porównywalne dla dwóch schematów leczenia w tym badaniu (Tabela 3), a także w innych badaniach klinicznych cytowanych w tym badaniu Sekcja. Cukrzycowa kwasica ketonowa nie była zgłaszana w żadnym badaniu z udziałem dorosłych w żadnej z grup leczenia.
Tabela 3. Podskórne podawanie NovoLog w cukrzycy typu 1 (24 tygodnie; n = 882)
| NovoLog + NPH | Novolin R + NPH | |
| N. | 596 | 286 |
| Wyjściowa HbA1c (%)* | 7.9 ±1.1 | 8.0 ± 1.2 |
| Zmiana od wyjściowej HbA1c (%) | -0.1 ± 0.8 | 0.0 ± 0.8 |
| Różnica w leczeniu w HbA1c, Średnia (95% przedział ufności) | -0.2 (-0.3, -0.1) | |
| Wyjściowa dawka insuliny (jm / kg / 24 godziny) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Dawka insuliny na koniec badania (jm / kg / 24 godziny) * | 0.7 ± 0.2 | 0.7 ± 0.2 |
| Pacjenci z ciężką hipoglikemią (n,%) - € | 104 (17%) | 54 (19%) |
|
Wyjściowa masa ciała (kg) * Zmiana masy ciała w stosunku do wartości początkowej (kg) * |
75.3 ± 14.5 0.5 ± 3.3 |
75.9 ± 13.1 0.9 ± 2.9 |
* Wartości oznaczają średnią ± SD
„Ciężka hipoglikemia odnosi się do hipoglikemii związanej z objawami ośrodkowego układu nerwowego i wymagającej interwencji innej osoby lub hospitalizacji.
24-tygodniowe, równoległe badanie grupy dzieci i młodzieży z cukrzycą typu 1 (n = 283) w wieku od 6 do 18 lat lata porównywały dwa schematy leczenia podskórnego z wieloma dawkami: NovoLog (n = 187) lub Novolin R (n = 96). Insulinę NPH podawano jako insulinę podstawową. NovoLog osiągnął kontrolę glikemii porównywalną do Novolin R, mierzoną zmianą HbA1c (Tabela 4), a obie grupy leczone miały porównywalną częstość występowania hipoglikemii. Podskórne podawanie NovoLog i zwykłej ludzkiej insuliny porównywano również u dzieci z cukrzycą typu 1 (n = 26) w wieku od 2 do 6 lat z podobnym wpływem na HbA1c i hipoglikemię.
Tabela 4 Pediatryczne podskórne podawanie NovoLog w cukrzycy typu 1 (24 tygodnie; n = 283)
| NovoLog + NPH | Novolin R + NPH | |
| N. | 187 | 96 |
| Wyjściowa HbA1c (%) * | 8.3 ± 1.2 | 8.3 ± 1.3 |
| Zmiana od wyjściowej HbA1c (%) | 0.1 ± 1.0 | 0.1 ± 1.1 |
| Różnica w leczeniu w HbA1c Średnia (95% przedział ufności) | 0.1 (-0.5, 0.1) | |
| Wyjściowa dawka insuliny (jm / kg / 24 godziny) * | 0.4 ± 0.2 | 0.6 ± 0.2 |
| Dawka insuliny na koniec badania (jm / kg / 24 godziny) * | 0.4 ± 0.2 | 0.7 ± 0.2 |
| Pacjenci z ciężką hipoglikemią (n,%) - € | 11 (6%) | 9 (9%) |
| Cukrzycowa kwasica ketonowa (n,%) | 10 (5%) | 2 (2%) |
|
Wyjściowa masa ciała (kg) * Zmiana masy ciała w stosunku do wartości początkowej (kg) * |
50.6 ± 19.6 2.7 ± 3.5 |
48.7 ± 15.8 2.4 ± 2.6 |
* Wartości oznaczają średnią ± SD
„Ciężka hipoglikemia odnosi się do hipoglikemii związanej z objawami ośrodkowego układu nerwowego i wymagającej interwencji innej osoby lub hospitalizacji.
Przeprowadzono jedno sześciomiesięczne, otwarte badanie z aktywną kontrolą w celu porównania bezpieczeństwa i skuteczności NovoLog i Novolin R u pacjentów z cukrzycą typu 2 (Tabela 5). NovoLog podawano we wstrzyknięciu podskórnym bezpośrednio przed posiłkami, a zwykłą ludzką insulinę podawano we wstrzyknięciu podskórnym 30 minut przed posiłkami. Insulinę NPH podawano jako insulinę podstawową w pojedynczych lub podzielonych dawkach dziennych. Zmiany HbAlc i częstości ciężkiej hipoglikemii (określonej na podstawie liczby zdarzeń wymagających interwencji ze strony trzeciej) były porównywalne dla dwóch schematów leczenia.
Tabela 5 Podskórne podawanie NovoLog w cukrzycy typu 2 (6 miesięcy; n = 176)
| NovoLog + NPH | Novolin R + NPH | |
| N. | 90 | 86 |
| Wyjściowa HbA1c (%) * | 8.1 ± 1.2 | 7.8 ± 1.1 |
| Zmiana od wyjściowej HbA1c (%) | -0.3 ± 1.0 | -0.1 ± 0.8 |
| Różnica w leczeniu w HbA1c Średnia (95% przedział ufności) | - 0.1 (-0.4, -0.1) | |
| Wyjściowa dawka insuliny (jm / kg / 24 godziny) * | 0.6 ± 0.3 | 0.6 ± 0.3 |
| Dawka insuliny na koniec badania (jm / kg / 24 godziny) * | 0.7 ± 0.3 | 0.7 ± 0.3 |
| Pacjenci z ciężką hipoglikemią (n,%) - € | 9 (10%) | 5 (8%) |
|
Wyjściowa masa ciała (kg) * Zmiana masy ciała w stosunku do wartości początkowej (kg) * |
88.4 ± 13.3 1.2 ± 3.0 |
85.8 ± 14.8 0.4 ± 3.1 |
* Wartości oznaczają średnią ± SD
„Ciężka hipoglikemia odnosi się do hipoglikemii związanej z objawami ośrodkowego układu nerwowego i wymagającej interwencji innej osoby lub hospitalizacji.
Ciągły podskórny wlew insuliny (CSII) przez pompę zewnętrzną
W dwóch otwartych, równoległych badaniach projektu (6 tygodni [n = 29] i 16 tygodni [n = 118]) porównywano NovoLog z buforowanym regularnym ludzka insulina (Velosulin) u dorosłych z cukrzycą typu 1 otrzymujących wlew podskórny z zewnętrzną insuliną pompa. Dwa schematy leczenia miały porównywalne zmiany w HbA1c i odsetkach ciężkiej hipoglikemii.
Tabela 6 Badanie pompy insulinowej u dorosłych w cukrzycy typu 1 (16 tygodni; n = 118)
| NovoLog | Buforowana ludzka insulina | |
| N. | 59 | 59 |
| Wyjściowa HbA1c (%) * | 7.3 ± 0.7 | 7.5 ± 0.8 |
| Zmiana od wyjściowej HbA1c (%) | 0.0 ± 0.5 | 0.2 ± 0.6 |
| Różnica w leczeniu w HbA1c Średnia (95% przedział ufności) | 0.3 (-0.1, 0.4) | |
| Wyjściowa dawka insuliny (jm / kg / 24 godziny) * | 0.7 ± 0.8 | 0.6 ± 0.2 |
| Dawka insuliny na koniec badania (jm / kg / 24 godziny) * | 0.7 ± 0.7 | 0.6 ± 0.2 |
| Pacjenci z ciężką hipoglikemią (n,%) - € | 1 (2%) | 2 (3%) |
|
Wyjściowa masa ciała (kg) * Zmiana masy ciała w stosunku do wartości początkowej (kg) * |
77.4 ± 16.1 0.1 ± 3.5 |
74.8 ± 13.8 -0.0 ± 1.7 |
* Wartości oznaczają średnią ± SD
„Ciężka hipoglikemia odnosi się do hipoglikemii związanej z objawami ośrodkowego układu nerwowego i wymagającej interwencji innej osoby lub hospitalizacji.
Randomizowane, 16-tygodniowe, otwarte, równoległe badanie z udziałem dzieci i młodzieży z cukrzycą typu 1 (n = 298) w wieku 4-18 lat lata porównywały dwa schematy infuzji podskórnej podawanej za pomocą zewnętrznej pompy insulinowej: NovoLog (n = 198) lub insulina lispro (n = 100). Te dwa terapie spowodowały porównywalne zmiany w stosunku do wartości wyjściowej HbA1c i porównywalne wskaźniki hipoglikemii po 16 tygodniach leczenia (patrz Tabela 7).
Tabela 7 Badanie pediatrycznej pompy insulinowej w cukrzycy typu 1 (16 tygodni; n = 298)
| NovoLog | Lispro | |
| N. | 198 | 100 |
| Wyjściowa HbA1c (%) * | 8.0 ± 0.9 | 8.2 ± 0.8 |
| Zmiana od wyjściowej HbA1c (%) | -0.1 ± 0.8 | -0.1 ± 0.7 |
| Różnica w leczeniu w HbA1c Średnia (95% przedział ufności) | -0.1 (-0.3, 0.1) | |
| Wyjściowa dawka insuliny (jm / kg / 24 godziny) * | 0.9 ± 0.3 | 0.9 ± 0.3 |
| Dawka insuliny na koniec badania (jm / kg / 24 godziny) * | 0.9 ± 0.2 | 0.9 ± 0.2 |
| Pacjenci z ciężką hipoglikemią (n,%) - € | 19 (10%) | 8 (8%) |
| Cukrzycowa kwasica ketonowa (n,%) | 1 (0.5%) | 0 (0) |
|
Wyjściowa masa ciała (kg) * Zmiana masy ciała w stosunku do wartości początkowej (kg) * |
54.1 ± 19.7 1.8 ± 2.1 |
55.5 ± 19.0 1.6 ± 2.1 |
* Wartości oznaczają średnią ± SD
„Ciężka hipoglikemia odnosi się do hipoglikemii związanej z objawami ośrodkowego układu nerwowego i wymagającej interwencji innej osoby lub hospitalizacji.
Otwarte, 16-tygodniowe badanie równoległe w porównaniu z przedsprzedażnym zastrzykiem NovoLog w połączeniu z Zastrzyki NPH do NovoLog podawane w ciągłym wlewie podskórnym u 127 osób dorosłych z typem 2 cukrzyca. Dwie grupy leczone miały podobne zmniejszenie HbA1c i częstości ciężkiej hipoglikemii (Tabela 8) [patrz Wskazania i zastosowanie, Dawkowanie i sposób podawania, Ostrzeżenia i środki i Jak dostarczane / Przechowywanie i obsługa].
Tabela 8 Terapia pompowa w cukrzycy typu 2 (16 tygodni; n = 127)
| Pompa NovoLog | NovoLog + NPH | |
| N. | 66 | 61 |
| Wyjściowa HbA1c (%) * | 8.2 ± 1.4 | 8.0 ± 1.1 |
| Zmiana od wyjściowej HbA1c (%) | -0.6 ± 1.1 | -0.5 ± 0.9 |
| Różnica w leczeniu w HbA1c Średnia (95% przedział ufności) | 0.1 (0.4, 0.3) | |
| Wyjściowa dawka insuliny (jm / kg / 24 godziny) * | 0.7 ± 0.3 | 0.8 ± 0.5 |
| Dawka insuliny na koniec badania (jm / kg / 24 godziny) * | 0.9 ± 0.4 | 0.9 ± 0.5 |
|
Wyjściowa masa ciała (kg) * Zmiana masy ciała w stosunku do wartości początkowej (kg) * |
96.4 ± 17.0 1.7 ± 3.7 |
96.9 ± 17.9 0.7 ± 4.1 |
* Wartości oznaczają średnią ± SD
Dożylne podawanie NovoLog
Patrz sekcja Farmakologia kliniczna / farmakodynamika.
Top
Jak dostarczane / Przechowywanie i obsługa
NovoLog jest dostępny w następujących wielkościach opakowań: każda prezentacja zawiera 100 jednostek insuliny aspart na ml (U-100).
| Fiolki 10 ml | NDC 0169-7501-11 |
| Wkłady PenFill o pojemności 3 ml * | NDC 0169-3303-12 |
| 3 ml ampułko-strzykawka NovoLog FlexPen | NDC 0169-6339-10 |
* Wkłady NovoLog PenFill są przeznaczone do użytku z wkładami Novo Nordisk 3 ml PenFill urządzenia do dostarczania insuliny (z dodatkiem NovoPen 3 PenMate lub bez niego) z jednorazowym NovoFine igły
Zalecane miejsce do przechowywania
Niewykorzystany NovoLog należy przechowywać w lodówce w temperaturze od 2 ° do 8 ° C (36–46 ° F). Nie przechowywać w zamrażarce lub bezpośrednio przy elemencie chłodzącym lodówki. Nie zamrażaj NovoLog i nie używaj NovoLog, jeśli został zamrożony. NovoLog nie powinien być pobierany do strzykawki i przechowywany do późniejszego użycia.
Fiolki: Po pierwszym użyciu fiolkę można przechowywać w temperaturze poniżej 30 ° C (86 ° F) przez okres do 28 dni, ale nie należy jej wystawiać na działanie nadmiernego ciepła lub światła słonecznego. Otwarte fiolki mogą być chłodzone.
Niefunkcjonalne fiolki można stosować do daty ważności wydrukowanej na etykiecie, jeśli są przechowywane w lodówce. Nieużywane fiolki przechowywać w kartonie, aby pozostały czyste i chronione przed światłem.
Wkłady PenFill lub ampułko-strzykawki NovoLog FlexPen:
Po nakłuciu wkładu lub ampułko-strzykawki NovoLog FlexPen, należy ją przechowywać w temperaturze poniżej 30 ° C przez maksymalnie 28 dni, ale nie należy narażać jej na działanie nadmiernego ciepła lub światła słonecznego. Używanych wkładów lub ampułko-strzykawek NovoLog FlexPen NIE wolno przechowywać w lodówce. Trzymaj wszystkie wkłady PenFill® i jednorazowe ampułko-strzykawki NovoLog FlexPen z dala od bezpośredniego ciepła i światła słonecznego. Nieprzerwane wkłady PenFill i ampułko-strzykawki NovoLog FlexPen można stosować do daty ważności wydrukowanej na etykiecie, jeśli są przechowywane w lodówce. Nieużywane wkłady PenFill i ampułko-strzykawki NovoLog FlexPen należy przechowywać w opakowaniu, aby pozostały czyste i chronione przed światłem.
Zawsze usuwaj igłę po każdym wstrzyknięciu i przechowuj urządzenie do podawania wkładu PenFill o pojemności 3 ml lub ampułko-strzykawkę NovoLog FlexPen bez założonej igły. Zapobiega to zanieczyszczeniu i / lub infekcji lub wyciekaniu insuliny i zapewnia dokładne dawkowanie. Zawsze używaj nowej igły do każdego wstrzyknięcia, aby zapobiec zanieczyszczeniu.
Pompa:
NovoLog ze zbiornika pompy należy wyrzucać co najmniej co 48 godzin użytkowania lub po wystawieniu na działanie temperatur przekraczających 37 ° C (98,6 ° F).
Podsumowanie warunków przechowywania:
Warunki przechowywania podsumowano w poniższej tabeli:
Tabela 9 Warunki przechowywania fiolki, wkładów PenFill i ampułko-strzykawki NovoLog FlexPen
|
NovoLog prezentacja |
Nieużywany (nieotwarty) Temperatura pokojowa (poniżej 30 ° C) | Nieużywany (nieotwarty) Chłodzony | W użyciu (otwarty) Temperatura pokojowa (poniżej 30 ° C) |
| Fiolka 10 ml | 28 dni | Do daty ważności | 28 dni (chłodnia / temperatura pokojowa) |
| Wkłady PenFill o pojemności 3 ml | 28 dni | Do daty ważności |
28 dni (Nie przechowywać w lodówce) |
| 3 ml ampułko-strzykawka NovoLog FlexPen | 28 dni | Do daty ważności |
28 dni (Nie przechowywać w lodówce) |
Przechowywanie rozcieńczonego NovoLog
NovoLog rozcieńczony pożywką rozcieńczającą insulinę dla NovoLog do stężenia równoważnego U-10 lub równoważnego U-50 może pozostawać w użyciu przez pacjenta w temperaturze poniżej 30 ° C (86 ° F) przez 28 dni.
Przechowywanie NovoLog w płynach infuzyjnych
Worki infuzyjne przygotowane zgodnie ze wskazaniami w części Dawkowanie i podawanie (2) są stabilne w temperaturze pokojowej przez 24 godziny. Część insuliny zostanie początkowo zaadsorbowana na materiale worka infuzyjnego.
ostatnia aktualizacja 12/2008
NovoLog, insulina aspart, informacje dla pacjentów (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę

