Avandia do leczenia cukrzycy
Nazwa marki: AVANDIA
Nazwa ogólna: maleinian rozyglitazonu
Zawartość:
Wskazania i zastosowanie
Dawkowanie i sposób podawania
Formy dawkowania i moce
Przeciwwskazania
Ostrzeżenia i środki
Działania niepożądane
Interakcje z lekami
Użyj w określonych populacjach
Przedawkowanie
Opis
Farmakologia kliniczna
Toksykologia niekliniczna
Studia kliniczne
Jak dostarczone
Avandia, maleinian rozyglitazonu, informacje dla pacjentów (w prostym angielskim)
OSTRZEŻENIE
KONGESTYWNA AWARIA SERCA I niedokrwienie mięśnia sercowego
- Tiazolidynodiony, w tym rozyglitazon, powodują lub nasilają zastoinową niewydolność serca u niektórych pacjentów [patrz OSTRZEŻENIA I ŚRODKI]. Po rozpoczęciu leczenia produktem AVANDIA i po zwiększeniu dawki należy uważnie obserwować pacjentów pod kątem objawów niewydolności serca (w tym nadmiernego, szybkiego przyrostu masy ciała, duszności i / lub obrzęku). Jeśli pojawią się te objawy, niewydolność serca należy leczyć zgodnie z obowiązującymi standardami opieki. Ponadto należy rozważyć przerwanie lub zmniejszenie dawki produktu AVANDIA.
- AVANDIA nie jest zalecana u pacjentów z objawową niewydolnością serca. Rozpoczęcie stosowania AVANDIA u pacjentów z niewydolnością serca klasy III lub IV według NYHA jest przeciwwskazane. [Widzieć PRZECIWWSKAZANIA i OSTRZEŻENIA I ŚRODKI.]
- Metaanaliza 42 badań klinicznych (średni czas trwania 6 miesięcy; 14 237 pacjentów ogółem), z których większość porównywała AVANDIA z placebo, wykazała, że AVANDIA wiąże się ze zwiększonym ryzykiem zdarzeń niedokrwiennych mięśnia sercowego, takich jak dławica piersiowa lub zawał mięśnia sercowego. Trzy inne badania (średni czas trwania 41 miesięcy; 14 067 pacjentów ogółem), porównując AVANDIA z innymi zatwierdzonymi doustnymi lekami przeciwcukrzycowymi lub placebo, nie potwierdziło ani nie wykluczyło tego ryzyka. W całości dostępne dane dotyczące ryzyka niedokrwienia mięśnia sercowego są niejednoznaczne. [Widzieć OSTRZEŻENIA I ŚRODKI.]
Top
Wskazania i zastosowanie
Monoterapia i terapia skojarzona
AVANDIA jest wskazana jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u osób dorosłych z cukrzycą typu 2.
Ważne ograniczenia użytkowania
- Ze względu na mechanizm działania AVANDIA jest aktywna tylko w obecności endogennej insuliny. Dlatego AVANDIA nie powinna być stosowana u pacjentów z cukrzycą typu 1 lub w leczeniu kwasicy ketonowej.
- Nie zaleca się jednoczesnego podawania preparatu AVANDIA i insuliny.
- Stosowanie AVANDIA z azotanami nie jest zalecane.
Top
Dawkowanie i sposób podawania
Postępowanie w leczeniu przeciwcukrzycowym powinno być zindywidualizowane. Wszyscy pacjenci powinni rozpocząć stosowanie produktu AVANDIA od najniższej zalecanej dawki. Dalszemu zwiększeniu dawki preparatu AVANDIA powinno towarzyszyć staranne monitorowanie pod kątem działań niepożądanych związanych z zatrzymywaniem płynów [patrz Ostrzeżenie w pudełku i Ostrzeżenia i środki].
AVANDIA można podawać w dawce początkowej 4 mg jako pojedynczą dawkę dobową lub w 2 dawkach podzielonych. U pacjentów, którzy reagują nieprawidłowo po 8 do 12 tygodniach leczenia, co określono na podstawie zmniejszenia stężenia glukozy w osoczu na czczo (FPG) dawkę można zwiększyć do 8 mg na dobę w monoterapii lub w skojarzeniu z metforminą, pochodną sulfonylomocznika lub pochodną sulfonylomocznika plus metformina. Zmniejszenie parametrów glikemicznych według dawki i schematu leczenia opisano w badaniach klinicznych. AVANDIA może być przyjmowana z jedzeniem lub bez jedzenia.
Całkowita dzienna dawka preparatu AVANDIA nie powinna przekraczać 8 mg.
Monoterapia
Zazwyczaj stosowana dawka początkowa preparatu AVANDIA to 4 mg, podawane w pojedynczej dawce raz na dobę lub w dawkach podzielonych dwa razy na dobę. W badaniach klinicznych schemat dawkowania 4 mg dwa razy na dobę spowodował największe zmniejszenie FPG i hemoglobiny A1c (HbA1c).
Połączenie z sulfonylomocznikiem lub metforminą
Po dodaniu AVANDIA do istniejącej terapii, obecna dawka (dawki) środka (środków) może być kontynuowana po rozpoczęciu leczenia preparatem AVANDIA.
Sulfonylomocznik: W przypadku stosowania w skojarzeniu z pochodną sulfonylomocznika zwykle stosowana dawka początkowa preparatu AVANDIA wynosi 4 mg podawana w pojedynczej dawce raz na dobę lub w dawkach podzielonych dwa razy na dobę. Jeśli pacjenci zgłaszają hipoglikemię, dawkę pochodnej sulfonylomocznika należy zmniejszyć.
Metformina: Zazwyczaj stosowana dawka początkowa preparatu AVANDIA w skojarzeniu z metforminą to 4 mg podawane w pojedynczej dawce raz na dobę lub w dawkach podzielonych dwa razy na dobę. Jest mało prawdopodobne, aby dawka metforminy wymagała dostosowania z powodu hipoglikemii podczas leczenia skojarzonego produktem AVANDIA.
W połączeniu z Sulfonylomocznikiem Metformina
Zazwyczaj stosowana dawka początkowa preparatu AVANDIA w skojarzeniu z pochodną sulfonylomocznika i metforminą to 4 mg podawane jako dawka pojedyncza raz na dobę lub dawki podzielone dwa razy na dobę. Jeśli pacjenci zgłaszają hipoglikemię, dawkę pochodnej sulfonylomocznika należy zmniejszyć.
Szczególne populacje pacjentów
Zaburzenia czynności nerek: Nie ma konieczności dostosowania dawki, gdy AVANDIA stosowana jest w monoterapii u pacjentów z zaburzeniami czynności nerek. Ponieważ metformina jest przeciwwskazana u takich pacjentów, jednoczesne podawanie metforminy i AVANDIA jest również przeciwwskazane u pacjentów z zaburzeniami czynności nerek.
Zaburzenia czynności wątroby: Enzymy wątrobowe należy oznaczyć przed rozpoczęciem leczenia preparatem AVANDIA. Nie należy rozpoczynać leczenia preparatem AVANDIA, jeśli u pacjenta występują kliniczne dowody aktywności choroba wątroby lub podwyższony poziom aminotransferaz w surowicy (AlAT> 2,5 x górna granica normy na początku terapia). Po rozpoczęciu stosowania AVANDIA należy okresowo monitorować enzymy wątrobowe zgodnie z oceną kliniczną pracownika służby zdrowia. [Widzieć Ostrzeżenia i środki i FARMAKOLOGIA KLINICZNA.]
Pediatryczny: Dane są niewystarczające, aby zalecić stosowanie produktu AVANDIA u dzieci [patrz UŻYWAĆ W SZCZEGÓLNYCH POPULACJACH].
Top
Formy dawkowania i mocne strony
Pięciokątna tabletka powlekana TILTAB zawiera rozyglitazon w postaci maleinianu w następujący sposób:
- 2 mg - różowy, z wytłoczonym napisem SB po jednej stronie i 2 po drugiej
- 4 mg - pomarańczowy, z wytłoczonym napisem SB po jednej stronie i 4 po drugiej
- 8 mg - czerwono-brązowy, z wytłoczonym napisem SB po jednej stronie i 8 po drugiej
Top
Przeciwwskazania
Rozpoczęcie stosowania AVANDIA u pacjentów z niewydolnością serca klasy III lub IV według NYHA (New York Heart Association) jest przeciwwskazane [patrz OSTRZEŻONE PUDEŁKO].
Top
Ostrzeżenia i środki
Zawał serca
AVANDIA, podobnie jak inne tiazolidynodiony, samodzielnie lub w połączeniu z innymi lekami przeciwcukrzycowymi, może powodować zatrzymywanie płynów, co może zaostrzać lub prowadzić do niewydolności serca. Pacjentów należy obserwować pod kątem objawów niewydolności serca. Jeśli pojawią się te objawy, niewydolność serca należy leczyć zgodnie z obowiązującymi standardami opieki. Ponadto należy rozważyć przerwanie lub zmniejszenie dawki rozyglitazonu [patrz OSTRZEŻONE PUDEŁKO].
Pacjenci z zastoinową niewydolnością serca (CHF) NYHA klasy I i II leczeni produktem AVANDIA mają zwiększone ryzyko wystąpienia zdarzeń sercowo-naczyniowych. 52-tygodniowe badanie echokardiograficzne z podwójnie ślepą próbą i kontrolą placebo przeprowadzono u 224 pacjentów z typem 2 cukrzyca i CHF klasy I lub II według NYHA (frakcja wyrzutowa 45%) na tle przeciwcukrzycowym i CHF terapia. Niezależny komitet przeprowadził ślepą ocenę zdarzeń związanych z płynami (w tym zastoinowa niewydolność serca) i hospitalizacje z przyczyn sercowo-naczyniowych według wcześniej określonych kryteriów (wyrok). Niezależnie od oceny, badacze zgłosili inne zdarzenia niepożądane dotyczące układu krążenia. Chociaż nie zaobserwowano żadnej różnicy w leczeniu w stosunku do wartości wyjściowych frakcji wyrzutowych, więcej zdarzenia niepożądane ze strony układu krążenia obserwowano po leczeniu preparatem AVANDIA w porównaniu z placebo podczas leczenia 52-tygodniowe badanie. (Patrz Tabela 1.)
Tabela 1. Nagłe zdarzenia niepożądane ze strony układu sercowo-naczyniowego u pacjentów z zastoinową niewydolnością serca (klasa I i II wg NYHA) leczonych preparatem AVANDIA lub placebo (oprócz podstawowego leczenia przeciwcukrzycowego i CHF)
| Wydarzenia | AVANDIA N = 110 n (%) |
Placebo N = 114 n (%) |
| Orzeczony | ||
| Zgony sercowo-naczyniowe | 5 (5%) | 4 (4%) |
| Pogorszenie CHF | 7 (6%) | 4 (4%) |
| - z hospitalizacją przez noc | 5 (5%) | 4 (4%) |
| - bez nocnej hospitalizacji | 2 (2%) | 0 (0%) |
| Nowy lub nasilający się obrzęk | 28 (25%) | 10 (9%) |
| Nowa lub nasilająca się duszność | 29 (26%) | 19 (17%) |
| Zwiększa leki na CHF | 36 (33%) | 20 (18%) |
| Hospitalizacja sercowo-naczyniowa * | 21 (19%) | 15 (13%) |
| Zgłoszone przez badacza, bez orzeczenia | ||
| Niedokrwienne zdarzenia niepożądane | 10 (9%) | 5 (4%) |
| - zawał mięśnia sercowego | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Obejmuje hospitalizację z jakiegokolwiek powodu sercowo-naczyniowego. |
Rozpoczęcie stosowania AVANDIA u pacjentów z niewydolnością serca klasy III lub IV według NYHA jest przeciwwskazane. AVANDIA nie jest zalecana u pacjentów z objawową niewydolnością serca. [Widzieć OSTRZEŻONE PUDEŁKO.]
Pacjenci z ostrymi zespołami wieńcowymi nie byli badani w kontrolowanych badaniach klinicznych. Ze względu na możliwość rozwoju niewydolności serca u pacjentów z ostrym incydentem wieńcowym rozpoczęcie stosowania AVANDIA nie jest zalecane dla pacjentów z ostrym incydentem wieńcowym, a przerwanie stosowania AVANDIA podczas tej ostrej fazy powinno być uważane.
Pacjenci ze stanem serca klasy III i IV według NYHA (z CHF lub bez CHF) nie byli badani w kontrolowanych badaniach klinicznych. AVANDIA nie jest zalecana u pacjentów ze stanem serca klasy III i IV według NYHA.
Niedokrwienie mięśnia sercowego
Metaanaliza niedokrwienia mięśnia sercowego w grupie 42 badań klinicznych
Metaanalizę przeprowadzono retrospektywnie w celu oceny zdarzeń niepożądanych ze strony układu krążenia zgłoszonych w 42 randomizowanych, kontrolowanych badaniach klinicznych z podwójnie ślepą próbą (średni czas trwania 6 miesięcy).1
Badania te zostały przeprowadzone w celu oceny skuteczności obniżania poziomu glukozy w cukrzycy typu 2, a prospektywne planowanie zdarzeń sercowo-naczyniowych nie wystąpiło w badaniach. Niektóre próby były kontrolowane placebo, a niektóre stosowały aktywne doustne leki przeciwcukrzycowe jako kontrole. Badania kontrolowane placebo obejmowały badania monoterapii (monoterapia produktem AVANDIA w porównaniu z monoterapią placebo) oraz badania dodatkowe (AVANDIA lub placebo, dodawane do pochodnej sulfonylomocznika, metforminy lub insuliny). Badania aktywnej kontroli obejmowały próby monoterapii (monoterapia produktem AVANDIA w porównaniu z pochodną sulfonylomocznika lub metforminą monoterapia) i badania dodatkowe (AVANDIA plus sulfonylomocznik lub AVANDIA plus metformina, w porównaniu z sulfonylomocznikiem plus metformina). Uwzględniono ogółem 14 237 pacjentów (8 604 w grupach terapeutycznych zawierających AVANDIA, 5633 w grupy porównawcze), z 4 143 pacjento-latami ekspozycji na AVANDIA i 2675 pacjento-latami ekspozycji komparator. Niedokrwienie mięśnia sercowego obejmowało dusznicę bolesną, zaostrzenie dusznicy bolesnej, niestabilną dusznicę bolesną, zatrzymanie akcji serca, ból w klatce piersiowej, wieńcową niedrożność tętnic, duszność, zawał mięśnia sercowego, zakrzepica wieńcowa, niedokrwienie mięśnia sercowego, choroba wieńcowa i tętnica wieńcowa nieład. W tej analizie podwyższone ryzyko niedokrwienia mięśnia sercowego po zastosowaniu preparatu AVANDIA w porównaniu z komparatorami zbiorczymi zaobserwowano (2% AVANDIA w porównaniu z 1,5% komparatorów, iloraz szans 1,4, 95% przedział ufności [CI] 1,1, 1.8). Zwiększone ryzyko zdarzeń niedokrwiennych mięśnia sercowego po zastosowaniu preparatu AVANDIA zaobserwowano w badaniach kontrolowanych placebo, ale nie w badaniach kontrolowanych aktywnie. (Patrz rysunek 1.)
W badaniach, w których dodano AVANDIA, zaobserwowano większe zwiększone ryzyko zdarzeń niedokrwiennych mięśnia sercowego na insulinę (2,8% dla AVANDIA plus insulina vs. 1,4% dla placebo plus insulina, [LUB 2,1, 95% CI 0,9, 5.1]). To zwiększone ryzyko odzwierciedla różnicę 3 zdarzeń na 100 pacjentolat (95% CI -0,1, 6,3) między grupami leczenia. [Widzieć OSTRZEŻENIA I ŚRODKI.]
Rycina 1. Leśny wykres ilorazów szans (95% przedziały ufności) dla zdarzeń niedokrwiennych mięśnia sercowego w metaanalizie 42 badań klinicznych
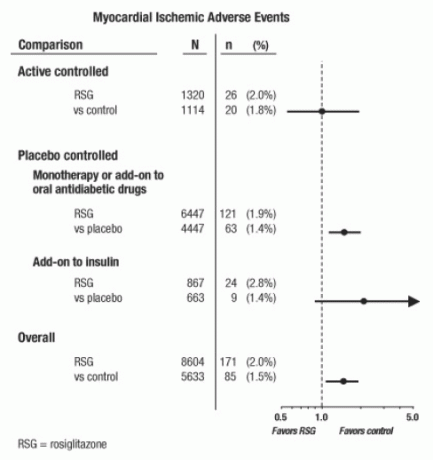
Większe ryzyko niedokrwienia mięśnia sercowego zaobserwowano również u pacjentów, którzy otrzymywali AVANDIA i podstawowe leczenie azotanami. Dla AVANDIA (N = 361) w porównaniu do kontroli (N = 244) u użytkowników azotanów, iloraz szans wynosił 2,9 (95% CI 1,4, 5,9), podczas gdy dla użytkowników bez azotanów (łącznie około 14 000 pacjentów) iloraz szans wyniósł 1,3 (95% CI 0,9, 1.7). To zwiększone ryzyko stanowi różnicę 12 zdarzeń niedokrwiennych mięśnia sercowego na 100 pacjentolat (95% CI 3,3, 21,4). Większość użytkowników azotanów miała chorobę wieńcową. Wśród pacjentów ze znaną chorobą niedokrwienną serca, którzy nie byli leczeni azotanami, nie wykazano zwiększonego ryzyka wystąpienia zdarzeń niedokrwiennych mięśnia sercowego dla AVANDIA w porównaniu z lekiem porównawczym.
Zdarzenia niedokrwienne mięśnia sercowego w dużych długoterminowych prospektywnych, kontrolowanych badaniach AVANDIA
Dane z 3 innych dużych, długoterminowych, prospektywnych, randomizowanych, kontrolowanych badań klinicznych AVANDIA oceniono osobno od metaanalizy. Te 3 próby obejmują łącznie 14 067 pacjentów (grupy terapeutyczne zawierające AVANDIA N = 6,311, lek porównawczy) grupy N = 7756), przy narażeniu na pacjenta wynoszącym 21 803 pacjento-lat dla AVANDIA i 25 998 pacjento-lat dla komparator. Czas trwania obserwacji przekraczał 3 lata w każdym badaniu. ADOPT (A Diabetes Outcome Progression Trial) było 4-6-letnim, randomizowanym, kontrolowanym aktywnie badaniem u niedawno zdiagnozowanych pacjentów z cukrzycą typu 2, którzy nie byli wcześniej leczeni lekami.
Było to badanie skuteczności i ogólnego bezpieczeństwa mające na celu zbadanie trwałości
AVANDIA w monoterapii (N = 1456) w celu kontroli glikemii w cukrzycy typu 2, z ramionami porównawczymi monoterapii sulfonylomocznikiem (N = 1444) i monoterapii metforminą (N = 1454). DREAM (ocena redukcji cukrzycy za pomocą rozyglitazonu i leków ramiprylu, opublikowany raport2) był 3 do 5-letnie randomizowane, kontrolowane placebo badanie u pacjentów z zaburzeniami tolerancji glukozy i (lub) z głodem glukoza. Miał układ czynnikowy 2x2, przeznaczony do oceny działania AVANDIA i oddzielnie ramiprylu (inhibitor enzymu konwertującego angiotensynę [ACEI]), na progresję do jawnej cukrzycy. W badaniu DREAM 2635 pacjentów było w grupach terapeutycznych zawierających AVANDIA, a 2634 było w grupach terapeutycznych niezawierających AVANDIA. Wyniki tymczasowe zostały opublikowane 3 dla RECORD (rozyglitazon oceniany pod kątem wyników kardiologicznych i regulacji glikemii w Cukrzyca), trwające otwarte 6-letnie badanie dotyczące wyników w zakresie układu sercowo-naczyniowego u pacjentów z cukrzycą typu 2 leczonych średnio czas trwania 3,75 lat. RECORD obejmuje pacjentów, którzy nie przeszli monoterapii metforminą lub pochodną sulfonylomocznika; ci, którzy zawiodli metforminę, są losowo przydzielani do grupy otrzymującej dodatek AVANDIA lub pochodną sulfonylomocznika, a ci, którym zawiodła pochodna sulfonylomocznika, są losowo przydzielani do otrzymywania dodatku AVANDIA lub dodatku metformina. W badaniu RECORD łącznie 2220 pacjentów otrzymuje dodatkowy AVANDIA, a 2227 pacjentów stosuje jeden z dodatkowych schematów niezawierających AVANDIA.
W tych 3 próbach przeprowadzono analizy, stosując zestaw głównych niepożądanych zdarzeń sercowo-naczyniowych (zawał mięśnia sercowego, śmierć sercowo-naczyniowa lub udar mózgu), zwanych dalej MACE. Ten punkt końcowy różnił się od szerokiego punktu końcowego metaanalizy zdarzeń niedokrwiennych mięśnia sercowego, z których ponad połowa to dławica piersiowa. Zawał mięśnia sercowego obejmował orzeczony śmiertelny i beztłuszczowy zawał mięśnia sercowego oraz nagłą śmierć. Jak pokazano na rycinie 2, wyniki dla 3 punktów końcowych (MACE, MI i całkowita śmiertelność) nie różniły się statystycznie znacząco między AVANDIA a komparatorami.

We wstępnych analizach badania DREAM częstość występowania zdarzeń sercowo-naczyniowych była większa wśród osób, które otrzymywał AVANDIA w połączeniu z ramiprylem niż wśród pacjentów, którzy otrzymywali sam ramipryl, jak pokazano w Rysunek 2. To stwierdzenie nie zostało potwierdzone w ADOPT i RECORD (badania kontrolowane aktywnie u pacjentów z cukrzycą), w których odpowiednio 30% i 40% pacjentów zgłosiło stosowanie inhibitora ACE na początku badania.
W całości dostępne dane dotyczące ryzyka niedokrwienia mięśnia sercowego są niejednoznaczne. Ostateczne wnioski dotyczące tego ryzyka czekają na zakończenie odpowiednio zaprojektowanego badania wyników sercowo-naczyniowych.
Nie przeprowadzono badań klinicznych, które potwierdzałyby jednoznaczne dowody zmniejszenia ryzyka makronaczyniowego za pomocą AVANDIA lub jakiegokolwiek innego doustnego leku przeciwcukrzycowego.
Zastoinowa niewydolność serca i niedokrwienie mięśnia sercowego podczas jednoczesnego podawania preparatu AVANDIA z insuliną
W badaniach, w których AVANDIA była dodawana do insuliny, AVANDIA zwiększała ryzyko zastoinowej niewydolności serca i niedokrwienia mięśnia sercowego. (Patrz Tabela 2.)
Jednoczesne podawanie produktu AVANDIA i insuliny nie jest zalecane. [Widzieć Wskazania i zastosowanie i OSTRZEŻENIA I ŚRODKI.]
W pięciu, 26-tygodniowych, kontrolowanych, randomizowanych badaniach z podwójnie ślepą próbą, które zostały uwzględnione w metaanalizie [patrz OSTRZEŻENIA I ŚRODKI], pacjenci z cukrzycą typu 2 zostali losowo przydzieleni do grupy otrzymującej AVANDIA i insulinę (N = 867) lub insulinę (N = 663). W tych 5 próbach AVANDIA została dodana do insuliny. W badaniach tych uczestniczyli pacjenci z długotrwałą cukrzycą (mediana czasu trwania 12 lat) i wysoką częstością wcześniejszych schorzenia, w tym neuropatia obwodowa, retinopatia, choroba niedokrwienna serca, choroba naczyniowa i zastoinowe serce niepowodzenie. Całkowita liczba pacjentów z zastoinową zastoinową niewydolnością serca wyniosła 21 (2,4%) i 7 (1,1%) odpowiednio w grupie AVANDIA plus insulina i insulina. Całkowita liczba pacjentów z pojawiającym się niedokrwieniem mięśnia sercowego wynosiła odpowiednio 24 (2,8%) i 9 (1,4%) w grupach AVANDIA plus odpowiednio insulina i insulina (OR 2,1 [95% CI 0,9, 5,1]). Chociaż częstość występowania zastoinowej niewydolności serca i niedokrwienia mięśnia sercowego była niska w badanych populacji, konsekwentnie wskaźnik zdarzeń był 2-krotny lub wyższy przy równoczesnym podawaniu AVANDIA i insulina. Te zdarzenia sercowo-naczyniowe odnotowano zarówno przy dawkach dobowych AVANDIA 4 mg, jak i 8 mg. (Patrz Tabela 2.)
Tabela 2. Występowanie zdarzeń sercowo-naczyniowych w 5 kontrolowanych próbach dodania preparatu AVANDIA do ustalonego leczenia insuliną
| Zdarzenie* | AVANDIA + Insulina (n = 867) n (%) |
Insulina (n = 663) n (%) |
| Zastoinowa niewydolność serca | 21 (2.4%) | 7 (1.1%) |
| Niedokrwienie mięśnia sercowego | 24 (2.8%) | 9 (1.4%) |
| Złożony ze śmierci sercowo-naczyniowej, zawału mięśnia sercowego lub udaru mózgu | 10 (1.2%) | 5 (0.8%) |
| Uderzenie | 5 (0.6%) | 4 (0.6%) |
| Zawał mięśnia sercowego | 4 (0.5%) | 1 (0.2%) |
| Śmierć sercowo-naczyniowa | 4 (0.5%) | 1 (0.2%) |
| Wszystkie zgony | 6 (0.7%) | 1 (0.2%) |
| * Wydarzenia nie są wyłączne; tj. pacjent z śmiercią sercowo-naczyniową z powodu zawału mięśnia sercowego można zaliczyć do 4 kategorii zdarzeń (niedokrwienie mięśnia sercowego; śmierć sercowo-naczyniowa, zawał mięśnia sercowego lub udar; zawał mięśnia sercowego; śmierć sercowo-naczyniowa). |
W szóstym, 24-tygodniowym, kontrolowanym, randomizowanym, podwójnie zaślepionym badaniu AVANDIA i jednoczesnym podawaniu insuliny, do AVANDAMET® dodano insulinę (maleinian rozyglitazonu i chlorowodorek metforminy) (n = 161) w porównaniu z insuliną plus placebo (n = 158) po oślepiającym pojedynczym 8-tygodniowym docieraniu z AVANDAMET. Pacjenci z obrzękiem wymagającym leczenia farmakologicznego i zastoinowa niewydolność serca zostali wykluczeni na początku badania i podczas okresu docierania.
W grupie otrzymującej AVANDAMET plus insulinę wystąpiło jedno niedokrwienie mięśnia sercowego i jedna nagła śmierć. W grupie insulinowej nie zaobserwowano niedokrwienia mięśnia sercowego, a w żadnej z grup terapeutycznych nie stwierdzono zastoinowej niewydolności serca.
Obrzęk
AVANDIA należy stosować ostrożnie u pacjentów z obrzękiem. W badaniu klinicznym z udziałem zdrowych ochotników, którzy otrzymywali 8 mg preparatu AVANDIA raz na dobę przez 8 tygodni, zaobserwowano statystycznie istotny wzrost mediany objętości osocza w porównaniu z placebo.
Ponieważ tiazolidynodiony, w tym rozyglitazon, mogą powodować zatrzymanie płynów, co może zaostrzyć lub prowadzące do zastoinowej niewydolności serca, AVANDIA należy stosować ostrożnie u pacjentów z ryzykiem serca niepowodzenie. Pacjentów należy monitorować pod kątem objawów niewydolności serca [patrz OSTRZEŻONE PUDEŁKO, OSTRZEŻENIA I ŚRODKI ].
W kontrolowanych badaniach klinicznych z udziałem pacjentów z cukrzycą typu 2 u pacjentów leczonych preparatem AVANDIA zgłaszano łagodny do umiarkowanego obrzęk, który może być zależny od dawki. U pacjentów z trwającym obrzękiem częściej występowały zdarzenia niepożądane związane z obrzękiem, jeśli rozpoczęto leczenie skojarzone z insuliną i preparatem AVANDIA [patrz DZIAŁANIA NIEPOŻĄDANE].
Przybranie na wadze
Przyrost masy ciała związany z dawką obserwowano w przypadku samej AVANDII oraz w skojarzeniu z innymi lekami hipoglikemicznymi (Tabela 3). Mechanizm przyrostu masy ciała jest niejasny, ale prawdopodobnie obejmuje połączenie zatrzymywania płynów i gromadzenia tłuszczu.
Po wprowadzeniu do obrotu zgłaszano przypadki niezwykle szybkiego wzrostu masy ciała i wzrostu przekraczającego ogólnie obserwowane w badaniach klinicznych. Pacjenci, u których wystąpi taki wzrost, powinni zostać zbadani pod kątem nagromadzenia płynów i zdarzeń związanych z objętością, takich jak nadmierny obrzęk i zastoinowa niewydolność serca [patrz OSTRZEŻONE PUDEŁKO].
Tabela 3. Zmiany masy ciała (kg) od wartości początkowej w punkcie końcowym podczas badań klinicznych
| Monoterapia | Trwanie | Grupa kontrolna | AVANDIA 4 mg Mediana (25, 75 percentyl) |
AVANDIA 8 mg Mediana (25, 75 percentyl) |
|
| Mediana (25, 75 percentyl) | |||||
| 26 tygodni | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 tygodnie | sulfonylomocznik | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Terapia skojarzona | |||||
| Sulfonylomocznik | 24-26 tygodni | sulfonylomocznik | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| Metformina | 26 tygodni | metformina | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulina | 26 tygodni | insulina | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonylomocznik + metformina | 26 tygodni | sulfonylomocznik + metformina | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
W trwającym od 4 do 6 lat monoterapii badaniu porównawczym (ADOPT) u pacjentów, u których niedawno zdiagnozowano cukrzycę typu 2, którzy wcześniej nie byli leczeni lekami przeciwcukrzycowymi [patrz Studium klinicznes], mediana zmiany masy ciała (25th, 75th percentyle) od wartości wyjściowej po 4 latach wynosiła 3,5 kg (0,0; 8,1) dla AVANDIA, 2,0 kg (-1,0; 4,8) dla gliburydu i -2,4 kg (-5,4; 0,5) dla metforminy.
W 24-tygodniowym badaniu z udziałem dzieci i młodzieży w wieku od 10 do 17 lat leczonych produktem AVANDIA od 4 do 8 mg na dobę, średni przyrost masy ciała wyniósł 2,8 kg (25th, 75th zgłoszono percentyle: 0,0, 5,8).
Wpływ na wątrobę
Enzymy wątrobowe należy mierzyć przed rozpoczęciem leczenia preparatem AVANDIA u wszystkich pacjentów, a następnie okresowo zgodnie z oceną kliniczną pracownika służby zdrowia. Nie należy rozpoczynać leczenia produktem AVANDIA u pacjentów ze zwiększonym wyjściowym poziomem enzymów wątrobowych (AlAT> 2,5 x górna granica normy). Pacjenci z umiarkowanie podwyższonymi enzymami wątrobowymi (poziomy ALT - 2,5 x górna granica normy) na początku lub podczas leczenia preparatem AVANDIA należy ocenić w celu ustalenia przyczyny enzymu wątrobowego podniesienie. Rozpoczęcie lub kontynuacja leczenia produktem AVANDIA u pacjentów z łagodnym zwiększeniem aktywności enzymów wątrobowych należy zachować ostrożność i obejmują ścisłą obserwację kliniczną, w tym monitorowanie enzymów wątrobowych, w celu ustalenia, czy podwyższenie poziomu enzymów wątrobowych ustąpiło lub pogarszać. Jeśli w dowolnym momencie poziom ALT wzrośnie do> 3X górnej granicy normy u pacjentów leczonych preparatem AVANDIA, należy jak najszybciej ponownie sprawdzić poziomy enzymów wątrobowych. Jeśli poziomy ALT utrzymają się> 3 razy powyżej górnej granicy normy, leczenie preparatem AVANDIA należy przerwać.
Jeśli u któregokolwiek pacjenta wystąpią objawy wskazujące na zaburzenia czynności wątroby, które mogą obejmować niewyjaśnione nudności, wymioty, ból brzucha, zmęczenie, anoreksję i / lub ciemne zabarwienie moczu, należy sprawdzić enzymy wątrobowe. Decyzja o kontynuowaniu leczenia produktem AVANDIA powinna opierać się na ocenie klinicznej do czasu oceny laboratoryjnej. W przypadku zaobserwowania żółtaczki należy przerwać leczenie farmakologiczne. [Widzieć DZIAŁANIA NIEPOŻĄDANE.]
Obrzęk plamki żółtej
Po wprowadzeniu produktu do obrotu zgłaszano obrzęk plamki żółtej u niektórych pacjentów z cukrzycą, którzy przyjmowali AVANDIA lub inny tiazolidynodion. Niektórzy pacjenci mieli niewyraźne widzenie lub zmniejszoną ostrość wzroku, ale u niektórych pacjentów zdiagnozowano rutynowe badanie okulistyczne. Większość pacjentów miała obrzęk obwodowy w momencie rozpoznania obrzęku plamki żółtej. U niektórych pacjentów poprawił się obrzęk plamki żółtej po odstawieniu tiazolidynodionu. Pacjenci z cukrzycą powinni mieć regularne badania okulistyczne przeprowadzane przez okulistę zgodnie ze Standardami Opieki Amerykańskiego Towarzystwa Diabetologicznego. Ponadto każdy cukrzyca, który zgłosi jakikolwiek objaw wizualny, powinien zostać niezwłocznie skierowany do okulisty, bez względu na podstawowe leki pacjenta lub inne ustalenia fizyczne. [Widzieć DZIAŁANIA NIEPOŻĄDANE.]
Złamania
W trwającym od 4 do 6 lat badaniu porównawczym (ADOPT) kontroli glikemii z monoterapią u pacjentów wcześniej nieleczonych zdiagnozowana cukrzyca typu 2 odnotowano zwiększoną częstość złamań kości u kobiet przyjmujących AVANDIA. W okresie od 4 do 6 lat częstość złamań kości u kobiet wynosiła 9,3% (60/645) w przypadku AVANDIA w porównaniu do 3,5% (21/605) w przypadku gliburydu i 5,1% (30/590) w przypadku metforminy. Ta zwiększona zapadalność została odnotowana po pierwszym roku leczenia i utrzymywała się w trakcie badania. Większość złamań u kobiet, które otrzymały preparat AVANDIA, wystąpiła w górnej części ramienia, ręki i stopy. Te miejsca złamania różnią się od miejsc zwykle związanych z osteoporozą pomenopauzalną (np. Biodro lub kręgosłup). Nie zaobserwowano wzrostu częstości złamań u mężczyzn leczonych preparatem AVANDIA. Ryzyko złamania należy wziąć pod uwagę w opiece nad pacjentami, zwłaszcza kobietami, leczonymi AVANDIA oraz uwagę poświęconą ocenie i utrzymaniu zdrowia kości zgodnie z aktualnymi standardami opieka.
Efekty hematologiczne
Zmniejszenie średniego stężenia hemoglobiny i hematokrytu wystąpiło w sposób zależny od dawki u dorosłych pacjentów leczonych preparatem AVANDIA [patrz DZIAŁANIA NIEPOŻĄDANE]. Obserwowane zmiany mogą być związane ze zwiększoną objętością osocza obserwowaną podczas leczenia preparatem AVANDIA.
Cukrzyca i kontrola glikemii
Pacjenci otrzymujący preparat AVANDIA w skojarzeniu z innymi lekami hipoglikemicznymi mogą być narażeni na hipoglikemię i konieczne może być zmniejszenie dawki jednocześnie stosowanego leku.
Należy okresowo wykonywać pomiary stężenia glukozy we krwi i HbA1c na czczo w celu monitorowania odpowiedzi terapeutycznej.
Jajeczkowanie
Leczenie preparatem AVANDIA, podobnie jak innych tiazolidynodionów, może powodować owulację u niektórych kobiet przed menopauzą bez jajeczkowania. W rezultacie pacjenci ci mogą być narażeni na większe ryzyko ciąży podczas przyjmowania leku AVANDIA [patrz Użyj w określonych populacjach]. Dlatego należy zalecić odpowiednią antykoncepcję u kobiet przed menopauzą. Ten możliwy efekt nie został szczegółowo zbadany w badaniach klinicznych; dlatego częstotliwość tego zjawiska nie jest znana.
Chociaż w badaniach przedklinicznych zaobserwowano nierównowagę hormonalną [patrz Toksykologia niekliniczna], znaczenie kliniczne tego odkrycia nie jest znane. Jeśli wystąpią nieoczekiwane zaburzenia miesiączkowania, należy rozważyć korzyści wynikające z kontynuacji leczenia preparatem AVANDIA.
Top
Działania niepożądane
Doświadczenie z próby klinicznej
Dorosły
W badaniach klinicznych około 9,900 pacjentów z cukrzycą typu 2 było leczonych preparatem AVANDIA.
Krótkoterminowe badania preparatu AVANDIA w monoterapii oraz w skojarzeniu z innymi lekami hipoglikemicznymi
Częstość występowania i rodzaje zdarzeń niepożądanych zgłaszanych w krótkoterminowych badaniach klinicznych produktu AVANDIA w monoterapii przedstawiono w tabeli 4.
Tabela 4 Zdarzenia niepożądane (5% w dowolnej grupie terapeutycznej) zgłaszane przez pacjentów w krótkoterminowych * podwójnie zaślepionych badaniach klinicznych z zastosowaniem preparatu AVANDIA w monoterapii
| Preferowany termin | AVANDIA Monoterapia N = 2526 % |
Placebo N = 601 % |
Metformina N = 225 % |
Sulfonylomoczniki N = 626 % |
| Zakażenia górnych dróg oddechowych | 9.9 | 8.7 | 8.9 | 7.3 |
| Zranienie | 7.6 | 4.3 | 7.6 | 6.1 |
| Bół głowy | 5.9 | 5.0 | 8.9 | 5.4 |
| Ból pleców | 4.0 | 3.8 | 4.0 | 5.0 |
| Hiperglikemia | 3.9 | 5.7 | 4.4 | 8.1 |
| Zmęczenie | 3.6 | 5.0 | 4.0 | 1.9 |
| Zapalenie zatok | 3.2 | 4.5 | 5.3 | 3.0 |
| Biegunka | 2.3 | 3.3 | 15.6 | 3.0 |
| Hipoglikemia | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Badania krótkoterminowe trwały od 8 tygodni do 1 roku. †Obejmuje pacjentów otrzymujących gliburyd (N = 514), gliklazyd (N = 91) lub glipizyd (N = 21). |
Ogólnie rzecz biorąc, rodzaje działań niepożądanych bez względu na związek przyczynowy zgłaszane, gdy zastosowano AVANDIA w skojarzeniu z pochodną sulfonylomocznika lub metforminą były podobne do tych podczas monoterapii AVANDIA.
Zdarzenia niedokrwistości i obrzęku były zgłaszane częściej przy wyższych dawkach i miały na ogół nasilenie łagodne do umiarkowanego i zwykle nie wymagały przerwania leczenia preparatem AVANDIA.
W badaniach z podwójnie ślepą próbą niedokrwistość odnotowano u 1,9% pacjentów otrzymujących AVANDIA w monoterapii w porównaniu do 0,7% w grupie placebo, 0,6% w grupie pochodnej sulfonylomocznika i 2,2% w przypadku metforminy. Doniesienia o anemii były większe u pacjentów leczonych kombinacją AVANDIA i metforminy (7,1%) oraz kombinacji AVANDIA i pochodna sulfonylomocznika plus metformina (6,7%) w porównaniu do monoterapii preparatem AVANDIA lub w skojarzeniu z pochodną sulfonylomocznika (2.3%). Niższe poziomy hemoglobiny / hematokrytu przed leczeniem u pacjentów włączonych do badań klinicznych skojarzonych z metforminą mogły przyczynić się do wyższego odsetka zgłaszanych anemii w tych badaniach [patrz DZIAŁANIA NIEPOŻĄDANE].
W badaniach klinicznych obrzęki zgłaszano u 4,8% pacjentów otrzymujących preparat AVANDIA w monoterapii w porównaniu do 1,3% w grupie placebo, 1,0% w grupie pochodnych sulfonylomocznika i 2,2% w przypadku metforminy. Wskaźnik zgłaszania obrzęku był wyższy dla AVANDIA 8 mg w kombinacjach pochodnych sulfonylomocznika (12,4%) w porównaniu do innych kombinacji, z wyjątkiem insuliny. Obrzęki zgłaszano u 14,7% pacjentów otrzymujących AVANDIA w badaniach skojarzonych z insuliną w porównaniu do 5,4% w przypadku samej insuliny. Zgłoszenia nowego wystąpienia lub zaostrzenia zastoinowej niewydolności serca występowały z częstością 1% dla samej insuliny oraz 2% (4 mg) i 3% (8 mg) dla insuliny w połączeniu z AVANDIA [patrz OSTRZEŻONE PUDEŁKO i OSTRZEŻENIA I ŚRODKI].
W kontrolowanych badaniach terapii skojarzonej z pochodnymi sulfonylomocznika zgłaszano łagodne do umiarkowanych objawy hipoglikemii, które wydają się być zależne od dawki. Niewielu pacjentów wycofano z powodu hipoglikemii (<1%), a kilka epizodów hipoglikemii uznano za ciężkie (<1%). Hipoglikemia była najczęściej zgłaszanym działaniem niepożądanym w badaniach skojarzonych insuliny o ustalonej dawce, chociaż niewielu pacjentów wycofało się z powodu hipoglikemii (4 z 408 dla AVANDIA plus insulina i 1 z 203 dla insuliny sam). Wskaźniki hipoglikemii, potwierdzone stężeniem glukozy we krwi włośniczkowej - 50 mg / dL, wynosiły 6% dla samej insuliny i 12% (4 mg) i 14% (8 mg) dla insuliny w połączeniu z AVANDIA. [Widzieć OSTRZEŻENIA I ŚRODKI.]
Długoterminowa próba preparatu AVANDIA jako monoterapii
W badaniu trwającym od 4 do 6 lat (ADOPT) porównywano stosowanie AVANDIA (n = 1456), gliburydu (n = 1441) i metforminy (n = 1454) jako monoterapia u pacjentów z niedawno zdiagnozowaną cukrzycą typu 2, którzy wcześniej nie byli leczeni lekami przeciwcukrzycowymi lek. Tabela 5 przedstawia działania niepożądane bez względu na związek przyczynowy; wskaźniki są wyrażane na ekspozycję na 100 pacjento-lat (PY), aby uwzględnić różnice w ekspozycji na badany lek w 3 grupach leczenia.
W ADOPT złamania zgłaszano u większej liczby kobiet leczonych preparatem AVANDIA (9,3%, 2,7 / 100 pacjentolat) w porównaniu do gliburydu (3,5%, 1,3 / 100 pacjentolat) lub metforminy (5,1%, 1,5 / 100 pacjentolat).
Większość złamań u kobiet, które otrzymywały rozyglitazon, odnotowano w górnej części ramienia, dłoni i stopy. [Widzieć OSTRZEŻENIA I ŚRODKI.] Obserwowana częstość złamań u mężczyzn była podobna w 3 grupach leczenia.
Tabela 5 Zdarzenia niepożądane po terapii (¥ 5 zdarzeń / 100 pacjento-lat [PY]) w dowolnej grupie terapeutycznej zgłoszone w 4- do 6-letnim badaniu klinicznym produktu AVANDIA w monoterapii (ADOPT)
| AVANDIA N = 1,456 PY = 4,954 |
Gliburyd N = 1,441 PY = 4,244 |
Metformina N = 1,454 PY = 4,906 |
|
| Zapalenie nosogardzieli | 6.3 | 6.9 | 6.6 |
| Ból pleców | 5.1 | 4.9 | 5.3 |
| Ból stawów | 5.0 | 4.8 | 4.2 |
| Nadciśnienie | 4.4 | 6.0 | 6.1 |
| Zakażenia górnych dróg oddechowych | 4.3 | 5.0 | 4.7 |
| Hipoglikemia | 2.9 | 13.0 | 3.4 |
| Biegunka | 2.5 | 3.2 | 6.8 |
Pediatryczny
Preparat Avandia oceniano pod kątem bezpieczeństwa w jednym, aktywnie kontrolowanym badaniu z udziałem dzieci i młodzieży z cukrzycą typu 2, w którym 99 było leczonych produktem Avandia, a 101 leczono metforminą. Najczęstsze działania niepożądane (> 10%) bez względu na związek przyczynowy zarówno ze szczepionką Avandia, jak i metforminą były ból głowy (17% w porównaniu z 14%), nudności (4% w porównaniu z 11%), zapalenie nosogardzieli (3% w porównaniu z 12%) i biegunka (1% w porównaniu z 13%). W tym badaniu zgłoszono jeden przypadek kwasicy ketonowej w grupie leczonej metforminą. Ponadto w grupie rozyglitazonu znajdowało się 3 pacjentów, u których FPG wyniosło 300300 mg / dl, 2+ ketonurii i podwyższoną szczelinę anionową.
Nieprawidłowości laboratoryjne
Hematologiczny
Zmniejszenie średniej hemoglobiny i hematokrytu wystąpiło w sposób zależny od dawki u leczonych dorosłych pacjentów z Avandia (średni spadek w poszczególnych badaniach aż o 1,0 g / dl hemoglobiny i aż o 3,3% hematokryt). Zmiany wystąpiły głównie w ciągu pierwszych 3 miesięcy po rozpoczęciu leczenia produktem Avandia lub po zwiększeniu dawki leku Avandia. Przebieg czasowy i wielkość spadków były podobne u pacjentów leczonych preparatem Avandia i innymi lekami hipoglikemicznymi lub monoterapią produktem Avandia. Poziomy hemoglobiny i hematokrytu przed leczeniem były niższe u pacjentów w badaniach skojarzonych metforminy i mogły przyczynić się do wyższego odsetka zgłaszanych anemii. W jednym badaniu z udziałem dzieci i młodzieży odnotowano zmniejszenie stężenia hemoglobiny i hematokrytu (średnie zmniejszenie odpowiednio o 0,29 g / dl i 0,95%). Mały spadek stężenia hemoglobiny i hematokrytu obserwowano również u dzieci leczonych produktem Avandia. Liczba białych krwinek również nieznacznie spadła u dorosłych pacjentów leczonych produktem Avandia. Zmniejszenie parametrów hematologicznych może być związane ze zwiększoną objętością osocza obserwowaną podczas leczenia produktem Avandia.
Lipidy
Zmiany lipidów w surowicy obserwowano po leczeniu produktem Avandia u dorosłych [patrz Farmakologia kliniczna ]. Małe zmiany parametrów lipidów w surowicy zgłaszano u dzieci leczonych produktem Avandia przez 24 tygodnie.
Poziomy transaminaz w surowicy
W badaniach klinicznych poprzedzających zatwierdzenie 4598 pacjentów leczonych produktem Avandia (3600 pacjento-lat ekspozycji) oraz w długotrwałym 6-letnie badanie z udziałem 1456 pacjentów leczonych produktem Avandia (4 954 pacjento-lat ekspozycji), brak dowodów na działanie leku hepatotoksyczność.
W kontrolowanych badaniach poprzedzających zatwierdzenie u 0,2% pacjentów leczonych produktem Avandia stwierdzono zwiększenie aktywności AlAT> 3X górnej granicy normy w porównaniu z 0,2% w grupie placebo i 0,5% w grupie porównawczej. Zwiększenie aktywności AlAT u pacjentów leczonych produktem Avandia było odwracalne. Hiperbilirubinemię stwierdzono u 0,3% pacjentów leczonych produktem Avandia w porównaniu z 0,9% leczonych placebo i 1% u pacjentów leczonych aktywnymi lekami porównawczymi. W badaniach klinicznych poprzedzających rejestrację nie stwierdzono przypadków idiosynkratycznych reakcji na leki prowadzących do niewydolności wątroby. [Widzieć Ostrzeżenia i środki]
W trwającym od 4 do 6 lat badaniu ADOPT pacjenci leczeni produktem Avandia (4 954 pacjentolat), gliburyd (4 244 pacjentolat) lub metformina (ekspozycja na 4906 pacjento-lat), w monoterapii, miała ten sam wskaźnik wzrostu ALT do> 3-krotności górnej granicy normy (0,3 na 100 pacjento-lat ekspozycja).
Doświadczenie po wprowadzeniu do obrotu
Oprócz działań niepożądanych zgłaszanych z badań klinicznych, zdarzenia opisane poniżej zostały zidentyfikowane podczas stosowania preparatu Avandia po zatwierdzeniu. Ponieważ zdarzenia te są zgłaszane dobrowolnie z populacji o nieznanej wielkości, nie można wiarygodnie oszacować ich częstości lub zawsze ustalić związek przyczynowy z ekspozycją na lek.
U pacjentów otrzymujących leczenie tiazolidynodionem potencjalnie mogą wystąpić poważne zdarzenia niepożądane zakończone zgonem lub bez niego związane ze zwiększeniem objętości (np. zastoinowa niewydolność serca, obrzęk płuc i wysięk opłucnowy) [widzieć Ostrzeżenie w pudełku i Ostrzeżenia i środki].
Istnieją doniesienia po wprowadzeniu leku Avandia do obrotu dotyczące zapalenia wątroby, zwiększenia aktywności enzymów wątrobowych do 3 lub więcej razy górna granica normy i niewydolności wątroby z wynikiem śmiertelnym i bez niego, chociaż przyczynowość nie była ustanowiony.
Rzadko zgłaszano wysypkę, świąd, pokrzywkę, obrzęk naczynioruchowy, reakcję anafilaktyczną i zespół Stevensa-Johnsona.
Otrzymano również doniesienia o nowym początku lub nasileniu cukrzycowego obrzęku plamki żółtej ze zmniejszoną ostrością widzenia [patrz Ostrzeżenia i środki].
Top
Interakcje z lekami
Inhibitory i induktory CYP2C8
Inhibitor CYP2C8 (np. Gemfibrozyl) może zwiększać AUC rozyglitazonu, a induktor CYP2C8 (np. Ryfampina) może zmniejszać AUC rozyglitazonu. Dlatego, jeśli inhibitor lub induktor CYP2C8 zostanie uruchomiony lub zatrzymany podczas leczenia rozyglitazonem, mogą być potrzebne zmiany w leczeniu cukrzycy na podstawie odpowiedzi klinicznej. [Widzieć FARMAKOLOGIA KLINICZNA.]
Top
Użyj w określonych populacjach
Ciąża
Ciąża Kategoria C.
We wszystkich ciążach występuje ryzyko wady wrodzonej, utraty lub innego niekorzystnego wyniku niezależnie od ekspozycji na lek. Ryzyko to wzrasta w czasie ciąży powikłanej hiperglikemią i może być zmniejszone przy dobrej kontroli metabolicznej. U pacjentów z cukrzycą lub cukrzycą ciężarnych w wywiadzie istotne jest utrzymanie dobrej kontroli metabolicznej przed poczęciem i przez cały okres ciąży. U takich pacjentów niezbędne jest staranne monitorowanie kontroli stężenia glukozy. Większość ekspertów zaleca stosowanie monoterapii insuliną w czasie ciąży, aby utrzymać poziom glukozy we krwi tak blisko normy, jak to możliwe.
Dane ludzkie: Doniesiono, że rozyglitazon przenika przez łożysko ludzkie i jest wykrywalny w tkance płodu. Znaczenie kliniczne tych wyników nie jest znane. Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. AVANDIA nie powinna być stosowana podczas ciąży.
Badania na zwierzętach: U szczurów nie stwierdzono wpływu na implantację ani zarodek podczas leczenia rozyglitazonem we wczesnej ciąży leczenie w połowie późnej ciąży wiązało się ze śmiercią płodu i opóźnieniem wzrostu u szczurów i królików. Teratogenność nie była obserwowana po dawkach do 3 mg / kg u szczurów i 100 mg / kg u królików (odpowiednio około 20 i 75-krotność wartości AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi). Rozyglitazon powodował patologię łożyska u szczurów (3 mg / kg / dobę). Leczenie szczurów podczas ciąży poprzez laktację zmniejszało rozmiar ściółki, żywotność noworodków i wzrost pourodzeniowy, z opóźnieniem wzrostu odwracalnym po okresie dojrzewania. W przypadku wpływu na łożysko, zarodek / płód i potomstwo dawka niepowodująca zmian wyniosła 0,2 mg / kg / dobę u szczurów i 15 mg / kg / dobę u królików. Te poziomy niepowodujące zmian są około 4-krotne AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi. Rozyglitazon zmniejszał liczbę implantacji macicy i żyje potomstwa, gdy młode samice szczurów były leczone w wieku 40 lat mg / kg / dzień od 27 dnia życia do dojrzałości płciowej (około 68-krotna wartość AUC dla człowieka przy maksymalnej zalecanej dawce dziennie dawka). Poziom braku efektu wynosił 2 mg / kg / dzień (około 4-krotność AUC dla człowieka przy maksymalnej zalecanej dawce dziennej). Nie stwierdzono wpływu na przeżycie ani wzrost przed i po urodzeniu dziecka.
Praca i dostawa
Wpływ rozyglitazonu na poród i poród u ludzi nie jest znany.
Matki karmiące
Materiał związany z lekiem wykryto w mleku od szczurów w okresie laktacji. Nie wiadomo, czy AVANDIA przenika do mleka ludzkiego. Ponieważ wiele leków przenika do mleka ludzkiego, preparatu AVANDIA nie należy podawać kobietom karmiącym.
Zastosowanie pediatryczne
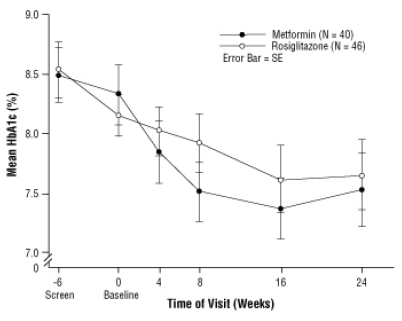
Po uruchomieniu placebo, w tym po poradach dietetycznych, dzieci z cukrzycą typu 2, w wieku od 10 do 17 lat i ze średnim wskaźnikiem masy ciała (BMI) wynoszącym 33 kg / m2 przydzielono losowo do leczenia preparatem AVANDIA 2 mg dwa razy na dobę (n = 99) lub 500 mg metforminy dwa razy na dobę (n = 101) w 24-tygodniowym badaniu klinicznym z podwójnie ślepą próbą próba. Zgodnie z oczekiwaniami FPG zmniejszyła się u pacjentów wcześniej nieleczonych na cukrzycę (n = 104) i wzrosła u pacjentów wycofanych z wcześniejszego leczenia (zwykle metforminy) (n = 90) w okresie docierania. Po co najmniej 8 tygodniach leczenia u 49% pacjentów leczonych preparatem AVANDIA i 55% pacjentów leczonych metforminą podwojono dawkę, jeśli FPG> 126 mg / dL. W ogólnej populacji, której leczenie było planowane, w 24. tygodniu średnia zmiana HbA1c w stosunku do wartości wyjściowej wyniosła -0,14% dla AVANDIA i -0,49% dla metforminy. W tym badaniu liczba pacjentów była niewystarczająca, aby ustalić statystycznie, czy ci pacjenci
zaobserwowane średnie efekty leczenia były podobne lub różne. Efekty leczenia różniły się u pacjentów wcześniej nieleczonych lekami przeciwcukrzycowymi iu pacjentów uprzednio leczonych lekami przeciwcukrzycowymi (Tabela 6).
Tabela 6 Tydzień 24 Zmiana FPG i HbA1c w stosunku do wartości wyjściowej ostatniej obserwacji przeprowadzonej u dzieci z wyjściową wartością HbA1c> 6,5%
| Pacjenci naiwni | Wcześniej leczeni pacjenci | |||
|
Metformina N = 40 |
Rozyglitazon N = 45 |
Metformina N = 43 |
Rozyglitazon N = 32 |
|
| FPG (mg / dL) | ||||
| Wartość początkowa (średnia) | 170 | 165 | 221 | 205 |
| Zmiana od wartości początkowej (średnia) | -21 | -11 | -33 | -5 |
| Skorygowana różnica w leczeniu * (rozyglitazon-metformina) - 95% CI | 8 (-15, 30) |
21 (-9, 51) |
||
| % pacjentów ze spadkiem o 30 mg / dL w stosunku do wartości początkowej | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Wartość początkowa (średnia) | 8.3 | 8.2 | 8.8 | 8.5 |
| Zmiana od wartości początkowej (średnia) | -0.7 | -0.5 | -0.4 | 0.1 |
| Skorygowana różnica w leczeniu * (rozyglitazon-metformina) - 95% CI | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % pacjentów z 0,7% spadkiem w stosunku do wartości początkowej | 63% | 52% | 54% | 31% |
|
* Zmiana w stosunku do wartości wyjściowych oznacza wartość najmniejszych kwadratów dostosowującą się do wyjściowej wartości HbA1c, płci i regionu. †Dodatnie wartości różnicy sprzyjają metforminie. |
Różnice w leczeniu zależały od wyjściowego BMI lub masy ciała, tak że efekty AVANDIA i metforminy wydawały się bardziej porównywalne u cięższych pacjentów. Mediana przyrostu masy ciała wyniosła 2,8 kg w przypadku rozyglitazonu i 0,2 kg w przypadku metforminy [patrz OSTRZEŻENIA I ŚRODKI]. Pięćdziesiąt cztery procent pacjentów leczonych rozyglitazonem i 32% pacjentów leczonych metforminą zyskało ¥ 2 kg, a 33% pacjentów leczonych rozyglitazonem i 7% pacjentów leczonych metforminą zyskało ¥ 5 kg na nauka.
Zdarzenia niepożądane zaobserwowane w tym badaniu opisano w Reakcje niepożądane).
Rycina 3. Średni poziom HbA1c w czasie w 24-tygodniowym badaniu AVANDIA i metforminy u pacjentów pediatrycznych - podgrupa leku
Zastosowanie geriatryczne
Wyniki populacyjnej analizy farmakokinetycznej wykazały, że wiek nie wpływa znacząco na farmakokinetykę rozyglitazonu [patrz FARMAKOLOGIA KLINICZNA]. Dlatego nie ma konieczności dostosowania dawki u osób starszych. W kontrolowanych badaniach klinicznych nie zaobserwowano ogólnych różnic w zakresie bezpieczeństwa i skuteczności między starszymi (¥ 65 lat) a młodszymi (<65 lat) pacjentami.
Top
Przedawkowanie
Dostępne są ograniczone dane dotyczące przedawkowania u ludzi. W badaniach klinicznych z udziałem ochotników preparat AVANDIA podawano w pojedynczych dawkach doustnych do 20 mg i był dobrze tolerowany. W przypadku przedawkowania należy rozpocząć odpowiednie leczenie podtrzymujące, zależnie od stanu klinicznego pacjenta.
Top
Opis
AVANDIA (maleinian rozyglitazonu) jest doustnym lekiem przeciwcukrzycowym, który działa przede wszystkim poprzez zwiększenie wrażliwości na insulinę. AVANDIA poprawia kontrolę glikemii przy jednoczesnym obniżeniu poziomu krążącej insuliny.
Maleinian rozyglitazonu nie jest chemicznie ani funkcjonalnie powiązany z pochodnymi sulfonylomocznika, biguanidami lub inhibitorami alfa-glukozydazy.
Chemicznie, maleinian rozyglitazonu jest (±) -5 - [[4- [2- (metylo-2-pirydynyloamino) etoksy] fenylo] metylo] -2,4-tiazolidynodionem, (Z) -2-butenodionian (1: 1) o masie cząsteczkowej 473,52 (357,44 wolnej zasady). Cząsteczka ma pojedyncze centrum chiralne i jest obecna jako racemat. Ze względu na szybką interkonwersję enancjomery są funkcjonalnie nie do odróżnienia. Wzór strukturalny maleinianu rozyglitazonu jest następujący:
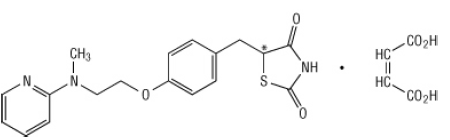
Wzór cząsteczkowy to C18H19N3O3S-C4H4O4. Maleinian rozyglitazonu jest białym lub prawie białym ciałem stałym o temperaturze topnienia od 122 do 123 ° C. Wartości pKa maleinianu rozyglitazonu wynoszą 6,8 i 6,1. Jest łatwo rozpuszczalny w etanolu i a buforowany roztwór wodny o pH 2,3; rozpuszczalność spada wraz ze wzrostem pH w fizjologii zasięg.
Każda pięciokątna tabletka powlekana TILTAB zawiera maleinian rozyglitazonu równoważny rozyglitazonowi, 2 mg, 4 mg lub 8 mg, do podawania doustnego. Nieaktywne składniki to: Hypromeloza 2910, laktoza jednowodna, stearynian magnezu, celuloza mikrokrystaliczna, glikol polietylenowy 3000, sodowy glikolan skrobi, dwutlenek tytanu, triacetyna i 1 lub więcej z poniższych: Syntetyczne czerwone i żółte tlenki żelaza i talk.
Top
Farmakologia kliniczna
Mechanizm akcji
Rozyglitazon, członek grupy leków przeciwcukrzycowych z grupy tiazolidynodionów, poprawia kontrolę glikemii poprzez poprawę wrażliwości na insulinę. Rozyglitazon jest wysoce selektywnym i silnym agonistą receptora gamma aktywowanego przez proliferator peroksysomów (PPARγ). U ludzi receptory PPAR znajdują się w kluczowych tkankach docelowych dla działania insuliny, takich jak tkanka tłuszczowa, mięśnie szkieletowe i wątroba. Aktywacja receptorów jądrowych PPARγ reguluje transkrypcję genów wrażliwych na insulinę zaangażowanych w kontrolę produkcji, transportu i wykorzystania glukozy. Ponadto geny reagujące na PPARγ biorą również udział w regulacji metabolizmu kwasów tłuszczowych.
Odporność na insulinę jest częstą cechą charakteryzującą patogenezę cukrzycy typu 2. Działanie przeciwcukrzycowe rozyglitazonu wykazano w modelach zwierzęcych cukrzycy typu 2 w której hiperglikemia i / lub upośledzona tolerancja glukozy jest konsekwencją oporności na insulinę w celu tkanki. Rozyglitazon zmniejsza stężenie glukozy we krwi i zmniejsza hiperinsulinemię u myszy otyłych ob / ob, myszy z cukrzycą db / db i szczurów Zucker z otyłością fa / fa.
W modelach zwierzęcych wykazano, że w działaniu przeciwcukrzycowym rozyglitazonu pośredniczy zwiększona wrażliwość na działanie insuliny w wątrobie, mięśniach i tkankach tłuszczowych. Badania farmakologiczne na modelach zwierzęcych wskazują, że rozyglitazon hamuje wątrobową glukoneogenezę. Ekspresja regulowanego przez insulinę transportera glukozy GLUT-4 była zwiększona w tkance tłuszczowej. Rozyglitazon nie indukował hipoglikemii w modelach zwierzęcych cukrzycy typu 2 i / lub upośledzonej tolerancji glukozy.
Farmakodynamika
Pacjenci z zaburzeniami lipidowymi nie zostali wykluczeni z badań klinicznych produktu AVANDIA.
We wszystkich 26-tygodniowych kontrolowanych badaniach, w zalecanym zakresie dawek, AVANDIA w monoterapii była związana ze wzrostem całkowitego cholesterolu, LDL i HDL oraz spadkiem wolnych kwasów tłuszczowych. Zmiany te były statystycznie istotnie różne od kontroli placebo lub gliburydu (Tabela 7).
Wzrost LDL wystąpił przede wszystkim podczas pierwszych 1–2 miesięcy leczenia preparatem AVANDIA, a poziomy LDL pozostawały podwyższone powyżej wartości wyjściowej w trakcie badań. W przeciwieństwie do tego, HDL nadal rośnie z czasem. W rezultacie stosunek LDL / HDL osiągnął szczyt po 2 miesiącach terapii, a następnie wydawał się zmniejszać z czasem. Ze względu na czasowy charakter zmian lipidów 52-tygodniowe badanie kontrolowane gliburydem jest najbardziej odpowiednie do oceny długoterminowego wpływu na lipidy. W punkcie początkowym, w 26. tygodniu i 52. tygodniu średni stosunek LDL / HDL wynosił odpowiednio 3,1, 3,2 i 3,0 dla AVANDIA 4 mg dwa razy na dobę. Odpowiednie wartości dla gliburydu wynosiły 3,2, 3,1 i 2,9. Różnice w zmianie od wartości początkowej między AVANDIA a gliburydem w 52 tygodniu były statystycznie istotne.
Schemat zmian LDL i HDL po leczeniu preparatem AVANDIA w skojarzeniu z innymi lekami hipoglikemicznymi był ogólnie podobny do obserwowanego w przypadku preparatu AVANDIA w monoterapii.
Zmiany w triglicerydach podczas terapii preparatem AVANDIA były zmienne i zasadniczo nie różniły się statystycznie od kontroli placebo lub gliburydu.
Tabela 7 Podsumowanie średnich zmian lipidów w 26-tygodniowych badaniach monoterapii kontrolowanej placebo i 52-tygodniowych kontrolowanych gliburydem
| Tydzień kontrolowany placebo 26 | Badanie kontrolowane gliburydem Tydzień 26 i Tydzień 52 | ||||||
| Placebo | AVANDIA | Miareczkowanie gliburydu | AVANDIA 8 mg | ||||
| 4 mg dziennie * | 8 mg dziennie * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| Wolne kwasy tłuszczowe | |||||||
| N. | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Wyjściowy (średnia)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Zmiana od wartości początkowej (średnia) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N. | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Wyjściowy (średnia)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Zmiana od wartości początkowej (średnia) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N. | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Wyjściowy (średnia)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Zmiana od wartości początkowej (średnia) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Grupy dawkowania raz dziennie i dwa razy dziennie zostały połączone. |
Farmakokinetyka
Maksymalne stężenie w osoczu (Cmax) i pole pod krzywą (AUC) rozyglitazonu zwiększają się proporcjonalnie do dawki w zakresie dawek terapeutycznych (Tabela 8). Okres półtrwania w fazie eliminacji wynosi od 3 do 4 godzin i jest niezależny od dawki.
Tabela 8 Średnie (SD) parametry farmakokinetyczne rozyglitazonu po pojedynczych dawkach doustnych (N = 32)
| Parametr | 1 mg na czczo | 2 mg na czczo | 8 mg na czczo | 8 mg Fed |
| AUC0-inf [ng-hr / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Pół życia [godz.] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / godz.] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = klirens doustny. |
Wchłanianie
Bezwzględna dostępność biologiczna rozyglitazonu wynosi 99%. Maksymalne stężenie w osoczu obserwuje się około 1 godzinę po podaniu. Podawanie rozyglitazonu z jedzeniem nie spowodowało zmiany całkowitej ekspozycji (AUC), ale wystąpiło około 28% zmniejszenie Cmax i opóźnienie w Tmax (1,75 godziny). Zmiany te prawdopodobnie nie będą znaczące klinicznie; dlatego AVANDIA może być podawana z posiłkiem lub bez posiłku.
Dystrybucja
Na podstawie analizy farmakokinetyki populacyjnej średnia (CV%) objętość dystrybucji doustnej (Vss / F) rozyglitazonu wynosi około 17,6 (30%) litrów. Rozyglitazon wiąże się w około 99,8% z białkami osocza, głównie z albuminami.
Metabolizm
Rozyglitazon jest intensywnie metabolizowany, a niezmieniony lek wydalany jest z moczem. Głównymi drogami metabolizmu były N-demetylacja i hydroksylacja, a następnie sprzęganie z siarczanem i kwasem glukuronowym. Wszystkie krążące metabolity są znacznie słabsze niż substancje macierzyste i dlatego nie oczekuje się, aby przyczyniały się do działania uczulającego na insulinę rozyglitazonu.
Dane in vitro pokazują, że rozyglitazon jest metabolizowany głównie przez izoenzym 2C8 cytochromu P450 (CYP), przy czym CYP2C9 odgrywa niewielką rolę.
Wydalanie
Po doustnym lub dożylnym podaniu maleinianu [14C] rozyglitazonu około 64% i 23% dawki zostało wydalone odpowiednio z moczem i kałem. Okres półtrwania w osoczu materiału związanego z [14C] wynosił od 103 do 158 godzin.
Populacja Farmakokinetyka u pacjentów z cukrzycą typu 2
Populacyjne analizy farmakokinetyczne z 3 dużych badań klinicznych z udziałem 642 mężczyzn i 405 kobiet z cukrzycą typu 2 (w wieku 35 lat do 80 lat) wykazało, że na farmakokinetykę rozyglitazonu nie ma wpływu wiek, rasa, palenie ani alkohol konsumpcja. Wykazano, że zarówno klirens po podaniu doustnym (CL / F), jak i objętość dystrybucji w stanie stacjonarnym (Vss / F) zwiększają się wraz ze wzrostem masy ciała. W przedziale wagowym zaobserwowanym w tych analizach (50 do 150 kg) zakres przewidywanych wartości CL / F i Vss / F zmieniał się odpowiednio <1,7-krotnie i <2,3-krotnie.
Ponadto wykazano, że zarówno na masę ciała, jak i płeć wpływ na rozyglitazon CL / F jest niższy (około 15%) u kobiet.
Specjalne populacje
Geriatryczny
Wyniki populacyjnej analizy farmakokinetycznej (n = 716 <65 lat; n = 331–65 lat) wykazał, że wiek nie wpływa znacząco na farmakokinetykę rozyglitazonu.
Płeć
Wyniki analizy farmakokinetyki populacyjnej wykazały, że średni klirens rozyglitazonu po podaniu doustnym kobiety (n = 405) były o około 6% niższe niż mężczyźni o tej samej masie ciała (n = 642).
W monoterapii iw połączeniu z metforminą AVANDIA poprawiła kontrolę glikemii zarówno u mężczyzn, jak iu kobiet. W badaniach skojarzonych metforminy wykazano skuteczność bez różnic płciowych w odpowiedzi glikemicznej.
W badaniach monoterapii większą odpowiedź terapeutyczną zaobserwowano u kobiet; jednak u bardziej otyłych pacjentów różnice płci były mniej widoczne. Dla danego wskaźnika masy ciała (BMI) kobiety mają zwykle większą masę tłuszczową niż mężczyźni. Ponieważ cel molekularny PPARγ jest wyrażany w tkankach tłuszczowych, ta cecha różnicująca może przynajmniej częściowo tłumaczyć większą odpowiedź na AVANDIA u kobiet. Ponieważ terapia powinna być zindywidualizowana, dostosowanie dawki nie jest konieczne w zależności od płci.
Zaburzenia czynności wątroby
Niezwiązany klirens rozyglitazonu po podaniu doustnym był znacznie niższy u pacjentów z umiarkowaną do ciężkiej chorobą wątroby (klasa B / C wg Childa-Pugha) w porównaniu do osób zdrowych. W rezultacie niezwiązane Cmax i AUC0-inf wzrosły odpowiednio 2- i 3-krotnie. Okres półtrwania w fazie eliminacji rozyglitazonu był o około 2 godziny dłuższy u pacjentów z chorobą wątroby w porównaniu do zdrowych osób.
Nie należy rozpoczynać leczenia preparatem AVANDIA, jeśli u pacjenta występują kliniczne dowody aktywności choroba wątroby lub podwyższony poziom transaminaz w surowicy (AlAT> 2,5 x górna granica normy) na początku badania [widzieć OSTRZEŻENIA I ŚRODKI].
Pediatryczny
Parametry farmakokinetyczne rozyglitazonu u dzieci zostały ustalone na podstawie populacyjnej analizy farmakokinetycznej z rzadkimi danymi z 96 dzieci w jednym badaniu klinicznym z udziałem populacji pediatrycznej obejmującym 33 mężczyzn i 63 kobiety w wieku od 10 do 17 lat (waga od 35 do 178,3 kg). Średnia populacja CL / F i V / F rozyglitazonu wynosiła odpowiednio 3,15 l / h i 13,5 l. Te oszacowania CL / F i V / F były zgodne z typowymi oszacowaniami parametrów z wcześniejszej analizy populacji dorosłych.
Zaburzenia czynności nerek
Nie ma istotnych klinicznie różnic w farmakokinetyce rozyglitazonu u pacjentów z łagodnymi do ciężkich zaburzeń czynności nerek lub u pacjentów zależnych od hemodializy w porównaniu do pacjentów z prawidłową nerką funkcjonować. Dlatego nie jest konieczne dostosowanie dawki u takich pacjentów otrzymujących AVANDIA. Ponieważ metformina jest przeciwwskazana u pacjentów z zaburzeniami czynności nerek, jednoczesne stosowanie metforminy z produktem AVANDIA jest przeciwwskazane u tych pacjentów.
Wyścigi
Wyniki populacyjnej analizy farmakokinetycznej obejmującej osoby rasy białej, czarnej i innych pochodzenia etnicznego wskazują, że rasa nie ma wpływu na farmakokinetykę rozyglitazonu.
Interakcje między lekami
Leki, które hamują, indukują lub są metabolizowane przez cytochrom P450
Badania metabolizmu leków in vitro sugerują, że rozyglitazon nie hamuje żadnego z głównych enzymów P450 w klinicznie istotnych stężeniach. Dane in vitro pokazują, że rozyglitazon jest metabolizowany głównie przez CYP2C8, aw mniejszym stopniu 2C9. Wykazano, że AVANDIA (4 mg dwa razy na dobę) nie ma klinicznie istotnego wpływu na farmakokinetykę nifedypina i doustne środki antykoncepcyjne (etynyloestradiol i noretyndron), które są głównie metabolizowane przez CYP3A4.
Gemfibrozil
Jednoczesne podawanie gemfibrozylu (600 mg dwa razy na dobę), inhibitora CYP2C8 i rozyglitazonu (4 mg raz dziennie) przez 7 dni zwiększało AUC rozyglitazonu o 127% w porównaniu z podawaniem rozyglitazonu (4 mg raz na dobę) sam. Biorąc pod uwagę możliwość wystąpienia działań niepożądanych związanych z dawką rozyglitazonu, może być konieczne zmniejszenie dawki rozyglitazonu po wprowadzeniu gemfibrozylu [patrz INTERAKCJE NARKOTYKOWE].
Ryfampina
Podaje się, że podawanie ryfampiny (600 mg raz na dobę), induktora CYP2C8, przez 6 dni zmniejsza AUC rozyglitazonu o 66% w porównaniu z podawaniem samego rozyglitazonu (8 mg) [patrz INTERAKCJE NARKOTYKOWE].4
Gliburyd
AVANDIA (2 mg dwa razy na dobę) przyjmowane jednocześnie z gliburydem (3,75 do 10 mg / dobę) przez 7 dni nie zmieniało się średnie 24-godzinne stężenie glukozy w osoczu w stanie stacjonarnym u pacjentów z cukrzycą ustabilizowało się na gliburyd terapia. Powtarzanie dawek preparatu AVANDIA (8 mg raz na dobę) przez 8 dni u zdrowych dorosłych pacjentów rasy białej spowodowało zmniejszenie AUC i Cmax gliburydu o około 30%. U Japończyków AUC i Cmax gliburydu nieznacznie wzrosły po jednoczesnym podaniu preparatu AVANDIA.
Glimepiryd
Pojedyncze dawki doustne glimepirydu u 14 zdrowych dorosłych osób nie miały klinicznie istotnego wpływu na farmakokinetykę AVANDIA w stanie stacjonarnym. Brak klinicznie istotnego zmniejszenia AUC i C glimepirydumax obserwowano po wielokrotnych dawkach preparatu AVANDIA (8 mg raz na dobę) przez 8 dni u zdrowych dorosłych osób.
Metformina
Jednoczesne podawanie produktu AVANDIA (2 mg dwa razy na dobę) i metforminy (500 mg dwa razy na dobę) zdrowym osobom ochotnicy przez 4 dni nie mieli wpływu na farmakokinetykę stanu stacjonarnego metforminy lub rozyglitazon.
Akarboza
Jednoczesne podawanie akarbozy (100 mg trzy razy na dobę) przez 7 dni zdrowym ochotnikom nie miało klinicznie istotnego wpływu na farmakokinetykę pojedynczej dawki doustnej preparatu AVANDIA.
Digoksyna
Powtarzane doustne podawanie preparatu AVANDIA (8 mg raz na dobę) przez 14 dni nie wpłynęło na farmakokinetykę digoksyny w stanie stacjonarnym (0,375 mg raz na dobę) u zdrowych ochotników.
Warfaryna
Wielokrotne podawanie produktu AVANDIA nie miało klinicznie istotnego wpływu na farmakokinetykę enancjomerów warfaryny w stanie stacjonarnym.
Etanol
Pojedyncze podanie umiarkowanej ilości alkoholu nie zwiększyło ryzyka ostrej hipoglikemii u pacjentów z cukrzycą typu 2 leczonych preparatem AVANDIA.
Ranitydyna
Wstępne leczenie ranitydyną (150 mg dwa razy na dobę przez 4 dni) nie wpłynęło na farmakokinetykę pojedynczej doustnej lub dożylnej dawki rozyglitazonu u zdrowych ochotników.
Wyniki te sugerują, że wchłanianie rozyglitazonu podawanego doustnie nie zmienia się w warunkach, którym towarzyszy wzrost pH w przewodzie pokarmowym.
Top
Toksykologia niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
Rakotwórczość:
Dwuletnie badanie rakotwórczości przeprowadzono na myszach CD-1 Charles River w dawkach 0,4, 1,5 i 6 mg / kg / dobę w dieta (najwyższa dawka odpowiadająca około 12-krotnej wartości AUC ludzkiej przy maksymalnej zalecanej dziennej dawce dla człowieka dawka). Szczurom Sprague-Dawley podawano przez 2 lata przez zgłębnik doustny dawki 0,05, 0,3 i 2 mg / kg / dzień (najwyższy równoważnik dawki do około 10 i 20-krotności wartości AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla mężczyzn i samic szczurów odpowiednio).
Rozyglitazon nie wykazywał (a) działania rakotwórczego u myszy. Wystąpiło zwiększenie częstości przerostu tkanki tłuszczowej u myszy przy dawkach 1,5 mg / kg / dobę (około 2-krotność wartości AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi). U szczurów stwierdzono znaczny wzrost częstości występowania łagodnych nowotworów tkanki tłuszczowej (tłuszczaki) w dawkach 0,3 mg / kg / dobę (około 2-krotność AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi). Te zmiany proliferacyjne u obu gatunków są rozważane z powodu utrzymującego się farmakologicznego nadmiernego pobudzenia tkanki tłuszczowej.
Mutageneza:
Rozyglitazon nie wykazywał działania mutagennego ani klastogennego w testach bakteryjnych in vitro na mutację genu, in vitro test aberracji chromosomowej w ludzkich limfocytach, mysi test mikrojądrowy in vivo oraz UDS szczura in vivo / in vitro analiza. Wystąpił niewielki (około 2-krotny) wzrost mutacji w teście chłoniaka myszy in vitro w obecności aktywacji metabolicznej.
Upośledzenie płodności:
Rozyglitazon nie miał wpływu na łączenie się w pary ani płodność samców szczurów, którym podawano do 40 mg / kg mc./dobę (około 116-krotność wartości AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi). Rozyglitazon zmieniał cykliczność rujową (2 mg / kg / dobę) i zmniejszał płodność (40 mg / kg / dobę) samic szczurów w związku z niższą poziomy progesteronu i estradiolu w osoczu (około 20 i 200-krotność AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi, odpowiednio). Nie odnotowano takich skutków przy dawce 0,2 mg / kg / dobę (około 3-krotność AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla ludzi). U młodych szczurów, którym podano dawkę w wieku od 27 dni do dojrzałości płciowej (w dawce do 40 mg / kg / dobę), nie stwierdzono wpływu na zdolność rozrodczą samców lub na cykliczność rujową, wydajność krycia lub występowanie w ciąży u kobiet (około 68-krotność wartości AUC dla człowieka przy maksymalnej zalecanej wartości dla człowieka dziennie dawka). U małp rozyglitazon (0,6 i 4,6 mg / kg / dobę; odpowiednio około 3 i 15 razy więcej niż AUC człowieka przy maksymalnej zalecanej dawce dobowej u człowieka) zmniejszyło wzrost fazy pęcherzykowej w estradiolu w surowicy z następczym zmniejszeniem wzrostu hormonu luteinizującego, niższym poziomem progesteronu w fazie lutealnej i brak menstruacji. Mechanizmem tych efektów wydaje się być bezpośrednie hamowanie steroidogenezy jajników.
Toksykologia Zwierząt
Masy serca wzrosły u myszy (3 mg / kg / dzień), szczurów (5 mg / kg / dzień) i psów (2 mg / kg / dzień) z rozyglitazonem leczenie (odpowiednio około 5, 22 i 2-krotna wartość AUC dla człowieka przy maksymalnej zalecanej dziennej dawce dla człowieka). Skutki u młodych szczurów były zgodne z obserwowanymi u dorosłych. Pomiary morfometryczne wykazały, że w tkankach serca występuje przerost serca, co może być spowodowane zwiększoną pracą serca w wyniku zwiększenia objętości osocza.
Top
Studia kliniczne
Monoterapia
W badaniach klinicznych leczenie preparatem AVANDIA spowodowało poprawę kontroli glikemii, mierzoną za pomocą FPG i HbA1c, przy jednoczesnym obniżeniu poziomu insuliny i peptydu C. Zmniejszono również poposiłkowe stężenie glukozy i insuliny. Jest to zgodne z mechanizmem działania preparatu AVANDIA jako sensybilizatora insuliny.
Maksymalna zalecana dawka dobowa wynosi 8 mg. Badania dotyczące różnych dawek sugerowały, że nie uzyskano dodatkowych korzyści z całkowitą dawką dobową 12 mg.
Krótkoterminowe badania kliniczne: W sumie 2315 pacjentów z cukrzycą typu 2, wcześniej leczonych samą dietą lub lekami przeciwcukrzycowymi, leczono preparatem AVANDIA w monoterapii u 6 podwójnie zaślepionych badania, które obejmowały dwa 26-tygodniowe badania kontrolowane placebo, jedno 52-tygodniowe badanie kontrolowane gliburydem oraz 3 badania kontrolowane placebo w zakresie dawek trwające od 8 do 12 tygodni. Poprzednie leki przeciwcukrzycowe zostały wycofane, a pacjenci rozpoczęli 2–4 tygodniowy okres docierania placebo przed randomizacją.
Dwa 26-tygodniowe badania z podwójnie ślepą próbą, kontrolowane placebo, u pacjentów z cukrzycą typu 2 (n = 1401) z nieodpowiednią glikemią kontrola (średnia wyjściowa FPG około 228 mg / dL [101 do 425 mg / dL] i średnia wyjściowa HbA1c 8,9% [5,2% do 16,2%]) prowadzone. Leczenie preparatem AVANDIA spowodowało statystycznie istotną poprawę FPG i HbA1c w porównaniu do wartości wyjściowej i względem placebo. Dane z jednego z tych badań podsumowano w tabeli 9.
Tabela 9: Parametry glikemiczne w 26-tygodniowej próbie kontrolowanej placebo
| Placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg raz na dobę N = 180 |
2 mg dwa razy dziennie N = 186 |
8 mg raz na dobę N = 181 |
4 mg dwa razy dziennie N = 187 |
||
| FPG (mg / dL) | |||||
| Wartość początkowa (średnia) | 225 | 229 | 225 | 228 | 228 |
| Zmiana od wartości początkowej (średnia) | 8 | -25 | -35 | -42 | -55 |
| Różnica w stosunku do placebo (skorygowana średnia) | - | -31* | -43* | -49* | -62* |
| % pacjentów ze spadkiem o 30 mg / dL w stosunku do wartości początkowej | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Wartość początkowa (średnia) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Zmiana od wartości początkowej (średnia) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Różnica w stosunku do placebo (skorygowana średnia) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % pacjentów z 0,7% spadkiem w stosunku do wartości początkowej | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 w porównaniu z placebo. |
Przy podawaniu w tej samej całkowitej dawce dziennej AVANDIA był ogólnie bardziej skuteczny w zmniejszaniu FPG i HbA1c przy podawaniu w podzielonych dawkach dwa razy dziennie w porównaniu do dawek raz dziennie. Jednak w przypadku HbA1c różnica między dawkami 4 mg raz na dobę a 2 mg dwa razy na dobę nie była statystycznie istotna.
Długoterminowe badania kliniczne
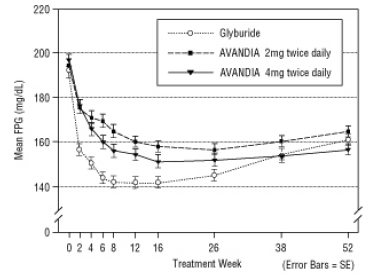
Długotrwałe utrzymanie efektu oceniano w 52-tygodniowym, podwójnie zaślepionym, kontrolowanym gliburydem badaniu u pacjentów z cukrzycą typu 2. Pacjenci zostali losowo przydzieleni do leczenia produktem AVANDIA 2 mg dwa razy na dobę (N = 195) lub AVANDIA 4 mg dwa razy na dobę (N = 189) lub gliburydem (N = 202) przez 52 tygodnie. Pacjentom otrzymującym gliburyd podawano początkową dawkę 2,5 mg / dobę lub 5,0 mg / dobę. Dawkę miareczkowano następnie w przyrostach 2,5 mg / dzień przez następne 12 tygodni, do maksymalnej dawki 15,0 mg / dzień w celu zoptymalizowania kontroli glikemii. Następnie dawkę gliburydu utrzymywano na stałym poziomie.
Mediana zwiększonej dawki gliburydu wynosiła 7,5 mg. Wszystkie terapie spowodowały statystycznie znaczącą poprawę kontroli glikemii w stosunku do wartości początkowej (ryc. 4 i ryc. 5). Pod koniec 52 tygodnia zmniejszenie FPG i HbA1c wyniosło -40,8 mg / dl i -0,53% dla AVANDIA 4 mg dwa razy na dobę; -25,4 mg / dl i -0,27% z AVANDIA 2 mg dwa razy dziennie; i -30,0 mg / dl i -0,72% z gliburydem. W przypadku HbA1c różnica między AVANDIA 4 mg dwa razy na dobę a gliburydem nie była statystycznie istotna w 52 tygodniu. Początkowy spadek FPG w przypadku gliburydu był większy niż w przypadku AVANDII; efekt ten był jednak z czasem mniej trwały.
Poprawa kontroli glikemii obserwowana po podaniu AVANDIA w dawce 4 mg dwa razy na dobę w 26 tygodniu utrzymywała się przez 52 tydzień badania.
Rycina 4. Średnia FPG w czasie w 52-tygodniowym badaniu kontrolowanym gliburydem
Rycina 5. Średni poziom HbA1c w czasie w 52-tygodniowym badaniu kontrolowanym gliburydem
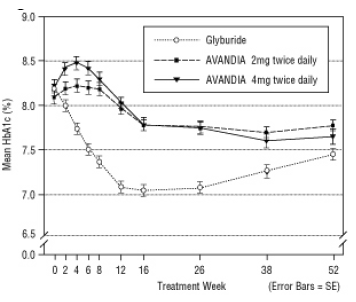
Hipoglikemię zgłaszano u 12,1% pacjentów leczonych gliburydem w porównaniu z 0,5% (2 mg dwa razy na dobę) i 1,6% (4 mg dwa razy na dobę) pacjentów leczonych preparatem AVANDIA. Poprawa kontroli glikemii była związana ze średnim przyrostem masy o 1,75 kg i 2,95 kg dla pacjenci leczeni odpowiednio 2 mg i 4 mg produktu AVANDIA w porównaniu z 1,9 kg leczonymi gliburydem pacjenci U pacjentów leczonych preparatem AVANDIA stosowano peptydy C, insulinę, pro-insulinę i pro-insulinę znacznie zmniejszony w sposób uporządkowany według dawki, w porównaniu ze wzrostem leczonego gliburydem pacjenci
Badanie progresji wyników cukrzycy (ADOPT) było wieloośrodkowym, podwójnie zaślepionym, kontrolowanym badaniem (N = 4 351) przeprowadzonym przez 4 do 6 lat w celu porównania bezpieczeństwa i skuteczności preparatu AVANDIA, metforminy i gliburydu w monoterapii u pacjentów, u których niedawno zdiagnozowano cukrzycę typu 2 (¤ 3 lata) niedostatecznie kontrolowanych za pomocą diety i ćwiczenie. Średni wiek pacjentów w tym badaniu wynosił 57 lat, a większość pacjentów (83%) nie miała historii chorób sercowo-naczyniowych w wywiadzie. Średnie wyjściowe FPG i HbA1c wynosiły odpowiednio 152 mg / dl i 7,4%. Pacjenci zostali losowo przydzieleni do grupy otrzymującej AVANDIA 4 mg raz na dobę, gliburyd 2,5 mg raz na dobę lub metforminę 500 mg raz na dobę, a dawki miareczkowane do optymalnej kontroli glikemii do maksymalnie 4 mg dwa razy dziennie dla AVANDIA, 7,5 mg dwa razy dziennie dla gliburydu i 1000 mg dwa razy dziennie dla metformina. Pierwszorzędowym wynikiem skuteczności był czas do kolejnych FPG> 180 mg / dl po co najmniej 6 tygodniach leczenia maksymalnie tolerowana dawka badanego leku lub czas do nieodpowiedniej kontroli glikemii, jak określono na podstawie niezależnego orzeczenia komisja.
Skumulowana częstość występowania pierwotnego wyniku skuteczności po 5 latach wyniosła 15% dla preparatu AVANDIA, 21% dla metforminy i 34% z gliburydem (współczynnik ryzyka 0,68 [95% CI 0,55, 0,85] w porównaniu z metforminą, HR 0,37 [95% CI 0,30, 0,45] w porównaniu z gliburydem).
Dane dotyczące zdarzeń sercowo-naczyniowych i zdarzeń niepożądanych (w tym wpływ na masę ciała i złamania kości) z ADOPT dla AVANDIA, metforminy i gliburydu opisano w OSTRZEŻENIA I ŚRODKI i DZIAŁANIA NIEPOŻĄDANEodpowiednio. Podobnie jak w przypadku wszystkich leków, wyniki skuteczności należy rozważyć wraz z informacjami dotyczącymi bezpieczeństwa, aby ocenić potencjalne korzyści i ryzyko dla pojedynczego pacjenta.
Połączenie z metforminą lub sulfonylomocznikiem
Dodanie preparatu AVANDIA do metforminy lub pochodnej sulfonylomocznika spowodowało znaczne zmniejszenie hiperglikemii w porównaniu z jednym z tych samych środków. Wyniki te są zgodne z addytywnym działaniem na kontrolę glikemii, gdy AVANDIA jest stosowana jako terapia skojarzona.
Połączenie z metforminą
W sumie 670 pacjentów z cukrzycą typu 2 uczestniczyło w dwóch 26-tygodniowych, randomizowanych, podwójnie zaślepionych, badania kontrolowane placebo / aktywne mające na celu ocenę skuteczności preparatu AVANDIA w połączeniu z metformina. AVANDIA, podawana w schematach dawkowania raz dziennie lub dwa razy dziennie, została dodana do terapii pacjentów, którzy nie byli odpowiednio kontrolowani maksymalną dawką metforminy (2,5 grama / dzień).
W jednym badaniu pacjenci nieodpowiednio kontrolowani przy 2,5 g / dobę metforminy (średnia wartość wyjściowa FPG 216 mg / dl i średnia wartość wyjściowa HbA1c 8,8%) losowo przydzielono do grupy otrzymującej 4 mg AVANDIA raz na dobę, 8 mg AVANDIA raz na dobę lub placebo oprócz metformina. U pacjentów leczonych kombinacjami zaobserwowano statystycznie istotną poprawę FPG i HbA1c metformina i 4 mg AVANDIA raz na dobę i 8 mg AVANDIA raz na dobę, w porównaniu do pacjentów kontynuujących leczenie samą metforminą (Tabela 10).
Tabela 10 Parametry glikemiczne w 26-tygodniowym badaniu skojarzonym preparatu AVANDIA Plus Metformina
| Metformina N = 113 |
AVANDIA 4 mg raz na dobę + metformina N = 116 |
AVANDIA 8 mg raz na dobę + metformina N = 110 |
|
| FPG (mg / dL) | |||
| Wartość początkowa (średnia) | 214 | 215 | 220 |
| Zmiana od wartości początkowej (średnia) | 6 | -33 | -48 |
| Różnica w stosunku do samej metforminy (skorygowana średnia) | - | -40* | -53* |
| % pacjentów ze spadkiem o 30 mg / dL w stosunku do wartości początkowej | 20% | 45% | 61% |
| HbA1c (%) | |||
| Wartość początkowa (średnia) | 8.6 | 8.9 | 8.9 |
| Zmiana od wartości początkowej (średnia) | 0.5 | -0.6 | -0.8 |
| Różnica w stosunku do samej metforminy (skorygowana średnia) | - | -1.0* | -1.2* |
| % pacjentów z 0,7% spadkiem w stosunku do wartości początkowej | 11% | 45% | 52% |
| * p <0,0001 w porównaniu z metforminą. |
W drugim 26-tygodniowym badaniu pacjenci z cukrzycą typu 2 nieodpowiednio kontrolowani za pomocą 2,5 g / dobę metforminy, którzy zostali losowo przydzieleni do grupy otrzymującej preparat AVANDIA w dawce 4 mg dwa razy na dobę i metformina (N = 105) wykazała statystycznie istotną poprawę kontroli glikemii ze średnim efektem leczenia FPG wynoszącym -56 mg / dL i średnim efektem leczenia HbA1c wynoszącym -0,8% powyżej sama metformina. Kombinacja metforminy i AVANDIA skutkowała niższymi poziomami FPG i HbA1c w porównaniu z każdym innym środkiem osobno.
Pacjenci, którzy nie byli odpowiednio kontrolowani maksymalną dawką metforminy (2,5 g / dzień) i którzy byli przejście na monoterapię preparatem AVANDIA wykazało utratę kontroli glikemii, o czym świadczy wzrost FPG i HbA1c. W tej grupie zaobserwowano również wzrost LDL i VLDL.
W połączeniu z sulfonylomocznikiem
Łącznie 3457 pacjentów z cukrzycą typu 2 uczestniczyło w dziesięciu 24- i 26-tygodniowych randomizowanych badaniach z podwójnie ślepą próbą, kontrolowanych placebo / aktywnie oraz jednym Dwuletnie badanie z podwójnie ślepą próbą, kontrolowane aktywnie u pacjentów w podeszłym wieku, mające na celu ocenę skuteczności i bezpieczeństwa preparatu AVANDIA w połączeniu z sulfonylomocznik. AVANDIA podawano 2 mg, 4 mg lub 8 mg dziennie, albo raz dziennie (3 badania) lub w dawkach podzielonych dwa razy dziennie (7 badań) pacjentom niedostatecznie kontrolowanym przy submaksymalnej lub maksymalnej dawce wynoszącej sulfonylomocznik.
W tych badaniach połączenie preparatu AVANDIA w dawce 4 mg lub 8 mg na dobę (podawane w dawkach podzielonych pojedynczo lub dwa razy na dobę) i sulfonylomocznik znacznie zmniejszył FPG i HbA1c w porównaniu z placebo plus pochodną sulfonylomocznika lub dalszym zwiększaniem dawki sulfonylomocznik. Tabela 11 pokazuje zbiorcze dane dla 8 badań, w których AVANDIA dodana do pochodnej sulfonylomocznika była porównywana z placebo plus pochodną sulfonylomocznika.
Tabela 11 Parametry glikemiczne w 24- i 26-tygodniowych badaniach kombinacji preparatu AVANDIA Plus Sulfonylomocznik
| Dwa razy dziennie podzielone dawkowanie (5 badań) | Sulfonylomocznik N = 397 |
AVANDIA 2 mg dwa razy dziennie + sulfonylomocznik N = 497 |
Sulfonylomocznik N = 248 |
AVANDIA 4 mg dwa razy dziennie + sulfonylomocznik N = 346 |
| FPG (mg / dL) | ||||
| Wartość początkowa (średnia) | 204 | 198 | 188 | 187 |
| Zmiana od wartości początkowej (średnia) | 11 | -29 | 8 | -43 |
| Różnica w stosunku do samej pochodnej sulfonylomocznika (skorygowana średnia) | - | -42* | - | -53* |
| % pacjentów ze spadkiem o 30 mg / dL w stosunku do wartości początkowej | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Wartość początkowa (średnia) | 9.4 | 9.5 | 9.3 | 9.6 |
| Zmiana od wartości początkowej (średnia) | 0.2 | -1.0 | 0.0 | -1.6 |
| Różnica w stosunku do samej pochodnej sulfonylomocznika (skorygowana średnia) | - | -1.1* | - | -1.4* |
| % pacjentów z 0,7% spadkiem w stosunku do wartości początkowej | 21% | 60% | 23% | 75% |
| Dawkowanie raz dziennie (3 badania) | Sulfonylomocznik N = 172 |
AVANDIA 4 mg raz na dobę + pochodna sulfonylomocznika N = 172 |
Sulfonylomocznik N = 173 |
AVANDIA 8 mg raz na dobę + pochodna sulfonylomocznika N = 176 |
| FPG (mg / dL) | ||||
| Wartość początkowa (średnia) | 198 | 206 | 188 | 192 |
| Zmiana od wartości początkowej (średnia) | 17 | -25 | 17 | -43 |
| Różnica w stosunku do samej pochodnej sulfonylomocznika (skorygowana średnia) | - | -47* | - | -66* |
| % pacjentów ze spadkiem o 30 mg / dL w stosunku do wartości początkowej | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Wartość początkowa (średnia) | 8.6 | 8.8 | 8.9 | 8.9 |
| Zmiana od wartości początkowej (średnia) | 0.4 | -0.5 | 0.1 | -1.2 |
| Różnica w stosunku do samej pochodnej sulfonylomocznika (skorygowana średnia) | - | -0.9* | - | -1.4* |
| % pacjentów z 0,7% spadkiem w stosunku do wartości początkowej | 11% | 36% | 20% | 68% |
| * p <0,0001 w porównaniu do samego sulfonylomocznika. |
Jedno z 24- i 26-tygodniowych badań obejmowało pacjentów, u których nie uzyskano odpowiedniej kontroli maksymalnych dawek gliburydu i którzy zmienili dawkę AVANDIA na 4 mg na dobę w monoterapii; w tej grupie wykazano utratę kontroli glikemii, o czym świadczy wzrost FPG i HbA1c.
W dwuletnim badaniu z podwójnie ślepą próbą pacjenci w podeszłym wieku (w wieku od 59 do 89 lat) leczeni do połowy maksymalnej pochodnej sulfonylomocznika (glipizyd 10 mg dwa razy na dobę) zostali losowo przydzieleni do grupy dodanie preparatu AVANDIA (n = 115, 4 mg raz dziennie do 8 mg w razie potrzeby) lub dalsze zwiększanie dawki glipizydu (n = 110), maksymalnie do 20 mg dwa razy codziennie. Średnie wartości wyjściowe FPG i HbA1c wynosiły odpowiednio 157 mg / dl i 7,72% dla ramienia AVANDIA plus glipizyd oraz 159 mg / dl i 7,65% odpowiednio dla ramienia zwiększania dawki glipizydu. Utrata kontroli glikemii (FPG - 180 mg / dl) wystąpiła u znacznie niższego odsetka pacjentów (2%) otrzymujących AVANDIA plus glipizyd w porównaniu do pacjentów w grupie zwiększającej dawkę glipizydu (28,7%). Około 78% pacjentów poddanych terapii skojarzonej ukończyło 2 lata terapii, a tylko 51% ukończyło monoterapię glipizydem. Wpływ terapii skojarzonej na FPG i HbA1c był trwały przez 2 lata badania z udziałem pacjentów osiągając średnio 132 mg / dl dla FPG i średnio 6,98% dla HbA1c w porównaniu z brakiem zmian w glipizydie ramię.
W połączeniu z Sulfonylomocznikiem Metformina
W dwóch 24- i 26-tygodniowych badaniach z podwójnie ślepą próbą, kontrolowanych placebo, mających na celu ocenę skuteczności i bezpieczeństwa preparatu AVANDIA w skojarzeniu z pochodną sulfonylomocznika i metforminą, AVANDIA w dawce 4 mg lub 8 mg codziennie podawano w podzielonych dawkach dwa razy dziennie pacjentom niedostatecznie kontrolowanym przy submaksymalnych (10 mg) i maksymalnych (20 mg) dawkach gliburydu i maksymalnej dawki metforminy (2) g / dzień). U pacjentów leczonych kombinacjami pochodnych sulfonylomocznika zaobserwowano statystycznie istotną poprawę FPG i HbA1c plus metformina i 4 mg AVANDIA i 8 mg AVANDIA w porównaniu z pacjentami kontynuowali leczenie pochodną sulfonylomocznika plus metforminą, jak pokazano w tabeli 12.
Tabela 12 Parametry glikemiczne w 26-tygodniowym badaniu skojarzonym preparatu AVANDIA Plus Sulfonylomocznik i metformina
| Sulfonylomocznik + metformina N = 273 |
AVANDIA 2 mg dwa razy codziennie + sulfonylomocznik + metformina N = 276 |
AVANDIA 4 mg dwa razy dziennie + sulfonylomocznik + metformina N = 277 |
|
| FPG (mg / dL) | |||
| Wartość początkowa (średnia) | 189 | 190 | 192 |
| Zmiana od wartości początkowej (średnia) | 14 | -19 | -40 |
| Różnica w porównaniu z pochodną sulfonylomocznika i metforminą (skorygowana średnia) | - | -30* | -52* |
| % pacjentów ze spadkiem o 30 mg / dL w stosunku do wartości początkowej | 16% | 46% | 62% |
| HbA1c (%) | |||
| Wartość początkowa (średnia) | 8.7 | 8.6 | 8.7 |
| Zmiana od wartości początkowej (średnia) | 0.2 | -0.4 | -0.9 |
| Różnica w porównaniu z pochodną sulfonylomocznika i metforminą (skorygowana średnia) | - | -0.6* | -1.1* |
| % pacjentów z 0,7% spadkiem w stosunku do wartości początkowej | 16% | 39% | 63% |
| * p <0,0001 w porównaniu z placebo. |
Top
Bibliografia
- Dokument informacyjny administracji żywności i leków. Wspólne posiedzenie komitetów doradczych dotyczących endokrynologicznych leków oraz bezpieczeństwa leków i zarządzania ryzykiem. Ju 2007.
- DREAM Trial Investigators. Wpływ rozyglitazonu na częstość cukrzycy z upośledzoną tolerancją glukozy lub upośledzoną glukozą na czczo: kontrola losowa Lancet 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, i in. Rozyglitazon poddany ocenie pod kątem wyników kardiologicznych - analiza śródokresowa. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH i in. Wpływ ryfampicyny na farmakokinetykę rozyglitazonu u zdrowych osób. Clin Pharmacol Ther 2004; 75: 157-162.
Top
Jak dostarczane / Przechowywanie i obsługa
Każda pięciokątna tabletka powlekana TILTAB zawiera rozyglitazon w postaci maleinianu w następujący sposób: 2 mg-różowy, z wytłoczonym SB na jednej stronie i 2 na drugiej; 4 mg pomarańczowe, z wytłoczonym napisem SB po jednej stronie i 4 po drugiej; 8 mg czerwono-brązowy, z wytłoczonym napisem SB po jednej stronie i 8 po drugiej.
- Butelki 2 mg o pojemności 60: NDC 0029-3158-18
- Butelki 4 mg 30: NDC 0029-3159-13
- Butelki 4 mg 90: NDC 0029-3159-00
- Butelki 8 mg 30: NDC 0029-3160-13
- Butelki 8 mg 90: NDC 0029-3160-59
Przechowywać w temperaturze 25 ° C (77 ° F); zmiany temperatury od 15 do 30 ° C (59 do 86 F). Dozować w szczelnym, odpornym na światło pojemniku.
ostatnia aktualizacja 02/2008
Avandia, maleinian rozyglitazonu, informacje dla pacjentów (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do:Przeglądaj wszystkie leki na cukrzycę

![[Autotest] Zaburzenia przetwarzania sensorycznego u dzieci](/uploads/acceptor/source/74/2020-01-06_22.41.59.jpg)
