Janumet do leczenia cukrzycy
Nazwa marki: Janumet
Nazwa ogólna: Sitagliptyna i chlorowodorek metforminy
Zawartość:
Wskazania i zastosowanie
Dawkowanie i sposób podawania
Formy dawkowania i mocne strony
Przeciwwskazania
Ostrzeżenia i środki
Działania niepożądane
Interakcje z lekami
Użyj w określonych populacjach
Przedawkować
Opis
Farmakologia
Toksykologia niekliniczna
Studia kliniczne
Jak dostarczone
Informacje dotyczące poradnictwa dla pacjenta
Janumet, Sitagliptyna i chlorowodorek metforminy, informacje dla pacjentów (w prostym angielskim)
OSTRZEŻENIE: KWAS LAKTYCZNY
Kwasica mleczanowa jest rzadkim, ale poważnym powikłaniem, które może wystąpić z powodu kumulacji metforminy. Ryzyko wzrasta wraz z takimi stanami, jak posocznica, odwodnienie, nadmierne spożycie alkoholu, niewydolność wątroby, niewydolność nerek i ostra zastoinowa niewydolność serca.
Początek jest często subtelny, czemu towarzyszą jedynie niespecyficzne objawy, takie jak złe samopoczucie, bóle mięśni, zaburzenia oddechowe, nasilająca się senność i niespecyficzne zaburzenia brzucha. Nieprawidłowości laboratoryjne obejmują niskie pH, zwiększoną lukę anionową i podwyższony mleczan we krwi.
Jeśli podejrzewa się kwasicę, Janumet1 należy przerwać i natychmiast hospitalizować pacjenta. [Widzieć Ostrzeżenia i środki]
Wskazania i zastosowanie
Janumet jest wskazany jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u osób dorosłych z cukrzycą typu 2, gdy właściwe jest leczenie zarówno sitagliptyną, jak i metforminą. [Widzieć Studia kliniczne.]
Ważne ograniczenia użytkowania
Janumet nie powinien być stosowany u pacjentów z cukrzycą typu 1 lub w leczeniu cukrzycowej kwasicy ketonowej, ponieważ nie byłby skuteczny w tych warunkach.
Janumet nie był badany w połączeniu z insuliną.
Top
Dawkowanie i sposób podawania
Zalecane dawkowanie
Dawkowanie terapii przeciwhiperglikemicznej za pomocą Janumet powinno być zindywidualizowane na podstawie aktualnego schematu leczenia pacjenta, skuteczność i tolerancja, nie przekraczając maksymalnej zalecanej dziennej dawki 100 mg sitagliptyny i 2000 mg metformina. Początkowa terapia skojarzona lub kontynuacja terapii skojarzonej powinna być zindywidualizowana i pozostawiona w gestii lekarza.
Janumet należy na ogół podawać dwa razy dziennie z posiłkami, ze stopniowym zwiększaniem dawki, aby zmniejszyć działania niepożądane ze strony przewodu pokarmowego wywołane metforminą.
Dawka początkowa leku Janumet powinna być oparta na aktualnym schemacie leczenia pacjenta. Janumet należy podawać dwa razy dziennie z posiłkami. Dostępne są następujące dawki:
50 mg sitagliptyny / 500 mg metforminy chlorowodorku
50 mg sitagliptyny / 1000 mg metforminy chlorowodorku.
Pacjenci niedostatecznie kontrolowani za pomocą samej diety i ćwiczeń fizycznych
Jeśli leczenie za pomocą tabletki złożonej zawierającej sitagliptynę i metforminę uważa się za odpowiednie dla pacjenta z cukrzycą typu 2 niedostatecznie kontrolowana samą dietą i ćwiczeniami, zalecana dawka początkowa wynosi 50 mg sitagliptyny / 500 mg metforminy chlorowodorku dwa razy codziennie. U pacjentów z niedostateczną kontrolą glikemii w tej dawce można stopniowo zwiększać dawkę do 50 mg sitagliptyny / 1000 mg metforminy chlorowodorku dwa razy na dobę.
Pacjenci nieodpowiednio kontrolowani monoterapią metforminą
Jeśli leczenie tabletką złożoną zawierającą sitagliptynę i metforminę zostanie uznane za odpowiednie dla pacjenta, który nie jest odpowiednio kontrolowany za pomocą samej metforminy, zalecana dawka początkowa preparatu Janumet powinna zapewnić sitagliptynę w dawce 50 mg dwa razy na dobę (całkowita dawka dobowa 100 mg), a dawka metforminy już jest wzięty. U pacjentów przyjmujących metforminę 850 mg dwa razy na dobę zalecana dawka początkowa leku Janumet to 50 mg sitagliptyny / 1000 mg metforminy chlorowodorku dwa razy na dobę.
Pacjenci niedostatecznie kontrolowani monoterapią sitagliptyną
Jeśli leczenie tabletką złożoną zawierającą sitagliptynę i metforminę uważa się za nieodpowiednie dla pacjenta w niewystarczający sposób kontrolowana za pomocą samej sitagliptyny, zalecana dawka początkowa leku Janumet to 50 mg sitagliptyny / 500 mg metforminy chlorowodorku dwa razy codziennie. U pacjentów z niedostateczną kontrolą tej dawki można zwiększyć dawkę do 50 mg sitagliptyny / 1000 mg metforminy chlorowodorku dwa razy na dobę. Pacjentów przyjmujących sitagliptynę w monoterapii dostosowanych do dawki z powodu niewydolności nerek nie należy zmieniać na Janumet [patrz Przeciwwskazania].
Pacjenci przechodzący z jednoczesnego podawania sitagliptyny i metforminy
W przypadku pacjentów przechodzących z sitagliptyny podawanej jednocześnie z metforminą, można rozpocząć leczenie produktem Janumet od już przyjętej dawki sitagliptyny i metforminy.
Pacjenci nieodpowiednio kontrolowani podczas terapii skojarzonej dwoma dowolnymi z następujących leków przeciwhiperglikemicznych: sitagliptyna, metformina lub pochodna sulfonylomocznika
Jeśli leczenie za pomocą tabletki złożonej zawierającej sitagliptynę i metforminę uważa się za odpowiednie w tym przypadku W ustawieniach zwykle stosowana dawka początkowa preparatu Janumet powinna zapewniać sitagliptynę w dawce 50 mg dwa razy na dobę (łącznie 100 mg) dzienna dawka). Przy określaniu dawki początkowej składnika metforminy należy wziąć pod uwagę poziom kontroli glikemii u pacjenta i aktualną dawkę (jeśli występuje) metforminy. Należy rozważyć stopniowe zwiększanie dawki w celu zmniejszenia skutków ubocznych przewodu pokarmowego związanych z metforminą. Pacjenci aktualnie przyjmujący sulfonylomocznik lub rozpoczynający go mogą wymagać mniejszych dawek sulfonylomocznika, aby zmniejszyć ryzyko hipoglikemii [patrz Ostrzeżenia i środki].
Nie przeprowadzono żadnych badań oceniających bezpieczeństwo i skuteczność preparatu Janumet u pacjentów wcześniej leczonych innymi doustnymi lekami przeciwhiperglikemicznymi i zmienionych na Janumet. Wszelkie zmiany w leczeniu cukrzycy typu 2 należy podejmować ostrożnie i odpowiednio monitorować, ponieważ mogą wystąpić zmiany w kontroli glikemii.
Top
Formy dawkowania i mocne strony
- Tabletki 50 mg / 500 mg są jasnoróżowe, w kształcie kapsułek, tabletki powlekane z wytłoczonym napisem „575” po jednej stronie.
- Tabletki 50 mg / 1000 mg to czerwone tabletki powlekane w kształcie kapsułki z wytłoczonym napisem „577” po jednej stronie.
Top
Przeciwwskazania
Janumet (sitagliptyna / metformina HCl) jest przeciwwskazany u pacjentów z:
- Choroby nerek lub zaburzenia czynności nerek, np. Sugerowane przez stężenie kreatyniny w surowicy - 1,5 mg / dl [mężczyźni], - 1,4 mg / dl [kobiety] lub nieprawidłowe klirens kreatyniny, który może również wynikać z takich stanów, jak zapaść sercowo-naczyniowa (wstrząs), ostry zawał mięśnia sercowego i posocznica [widzieć Ostrzeżenia i środki].
- Ostra lub przewlekła kwasica metaboliczna, w tym cukrzycowa kwasica ketonowa, ze śpiączką lub bez.
- Historia poważnej reakcji nadwrażliwości na Janumet lub sitagliptynę (jeden ze składników leku Janumet), taka jak anafilaksja lub obrzęk naczynioruchowy. [Widzieć Ostrzeżenia i środki i Działania niepożądane.]
Janumet należy tymczasowo odstawić u pacjentów poddawanych badaniom radiologicznym z udziałem wewnątrznaczyniowym podawanie jodowanych materiałów kontrastowych, ponieważ stosowanie takich produktów może spowodować ostrą zmianę czynności nerek funkcja [patrz Ostrzeżenia i środki].
Top
Ostrzeżenia i środki
Kwasica mleczanowa
Chlorowodorek metforminy
Kwasica mleczanowa jest rzadkim, ale poważnym powikłaniem metabolicznym, które może wystąpić z powodu kumulacji metforminy podczas leczenia produktem Janumet; kiedy to nastąpi, jest śmiertelne w około 50% przypadków. Kwasica mleczanowa może również występować w związku z wieloma stanami patofizjologicznymi, w tym cukrzycą, i zawsze, gdy występuje znaczna hipoperfuzja tkanek i hipoksemia. Kwasica mleczanowa charakteryzuje się podwyższonym poziomem mleczanu we krwi (> 5 mmol / l), zmniejszonym pH krwi, zaburzeniami elektrolitowymi ze zwiększoną szczeliną anionową oraz zwiększonym stosunkiem mleczanu do pirogronianu. Gdy metformina jest uważana za przyczynę kwasicy mleczanowej, zwykle stwierdza się jej stężenie w osoczu> 5 μg / ml.
Zgłaszana częstość kwasicy mleczanowej u pacjentów otrzymujących chlorowodorek metforminy jest bardzo mała (około 0,03 przypadków / 1000 pacjento-lat, z około 0,015 przypadków śmiertelnych / 1000 pacjentolat). Podczas ponad 20 000 pacjento-lat ekspozycji na metforminę w badaniach klinicznych nie odnotowano kwasicy mleczanowej. Zgłoszone przypadki występowały przede wszystkim u pacjentów z cukrzycą ze znaczną niewydolnością nerek, w tym zarówno wewnętrzną nerką choroba i hipoperfuzja nerek, często w przypadku wielu współistniejących problemów medycznych / chirurgicznych i wielu współistniejących leki Pacjenci z zastoinową niewydolnością serca wymagającą leczenia farmakologicznego, w szczególności ci z niestabilną lub ostra zastoinowa niewydolność serca, zagrożona hipoperfuzją i hipoksemią, jest narażona na zwiększone ryzyko wystąpienia kwasu mlekowego kwasica. Ryzyko kwasicy mleczanowej wzrasta wraz ze stopniem zaburzenia czynności nerek i wiekiem pacjenta. Ryzyko kwasicy mleczanowej może zatem zostać znacznie zmniejszone poprzez regularne monitorowanie czynności nerek u pacjentów przyjmujących metforminę i stosowanie minimalnej skutecznej dawki metforminy. W szczególności leczeniu osób starszych powinno towarzyszyć staranne monitorowanie czynności nerek. Leczenia metforminą nie należy rozpoczynać u pacjentów w wieku 80 lat, chyba że pomiar klirensu kreatyniny pokazuje, że czynność nerek nie jest zmniejszona, ponieważ ci pacjenci są bardziej podatni na rozwój kwasicy mleczanowej. Ponadto metforminę należy niezwłocznie przerwać w przypadku wystąpienia jakiegokolwiek stanu związanego z hipoksemią, odwodnieniem lub posocznicą. Ponieważ zaburzona czynność wątroby może znacznie ograniczyć zdolność do usuwania mleczanu, u pacjentów z klinicznymi lub laboratoryjnymi objawami choroby wątroby należy zasadniczo unikać metforminy. Podczas przyjmowania metforminy należy ostrzec pacjentów przed nadmiernym spożywaniem alkoholu, zarówno ostrym, jak i przewlekłym, ponieważ alkohol nasila wpływ chlorowodorku metforminy na metabolizm mleczanu. Ponadto metforminę należy tymczasowo odstawić przed jakimkolwiek wewnątrznaczyniowym badaniem kontrastu radiologicznego i jakimkolwiek zabiegiem chirurgicznym [patrz Ostrzeżenia i środki].
Początek kwasicy mleczanowej często jest subtelny i towarzyszą jej jedynie niespecyficzne objawy, takie jak złe samopoczucie, bóle mięśni, zaburzenia oddechowe, nasilająca się senność i niespecyficzne zaburzenia brzucha. Może wystąpić powiązana hipotermia, niedociśnienie i oporne bradyarytmie z bardziej wyraźną kwasicą. Pacjent i lekarz muszą być świadomi możliwego znaczenia takich objawów, a pacjent powinien zostać poinstruowany, aby niezwłocznie powiadomił lekarza, jeśli wystąpią [patrz Ostrzeżenia i środki]. Metforminę należy odstawić do czasu wyjaśnienia sytuacji. Przydatne mogą być elektrolity w surowicy, ketony, poziom glukozy we krwi, a jeśli wskazane, pH krwi, poziomy mleczanu, a nawet poziomy metforminy we krwi. Gdy pacjent ustabilizuje się na dowolnym poziomie dawki metforminy, objawy żołądkowo-jelitowe, które występują często na początku leczenia, prawdopodobnie nie są związane z lekami. Późniejsze występowanie objawów żołądkowo-jelitowych może być spowodowane kwasicą mleczanową lub inną poważną chorobą.
Poziom mleczanu w osoczu na czczo powyżej górnej granicy normy, ale mniej niż 5 mmol / L u pacjentów przyjmujących metforminę, niekoniecznie wskazuje na zbliżający się poziom mleczanu kwasica i może być wyjaśniona innymi mechanizmami, takimi jak źle kontrolowana cukrzyca lub otyłość, intensywna aktywność fizyczna lub problemy techniczne w postępowaniu z próbkami [widzieć Ostrzeżenia i środki].
Kwasicę mleczanową należy podejrzewać u każdego chorego na cukrzycę z kwasicą metaboliczną, której brak dowodów na kwasicę ketonową (ketonuria i ketonemia).
Kwasica mleczanowa to nagły przypadek medyczny, który należy leczyć w warunkach szpitalnych. U pacjenta z kwasicą mleczanową przyjmującego metforminę należy natychmiast przerwać stosowanie leku i niezwłocznie zastosować ogólne środki wspomagające. Ponieważ chlorowodorek metforminy można dializować (z klirensem do 170 ml / min przy dobrej hemodynamice warunki), zaleca się szybką hemodializę w celu skorygowania kwasicy i usunięcia nagromadzonego metformina. Takie postępowanie często skutkuje szybkim odwróceniem objawów i wyzdrowieniem [patrz Przeciwwskazania; Ostrzeżenia i środki].
Upośledzona czynność wątroby
Ponieważ upośledzenie czynności wątroby jest związane z niektórymi przypadkami kwasicy mleczanowej, należy ogólnie unikać stosowania Janumet u pacjentów z klinicznymi lub laboratoryjnymi objawami choroby wątroby.
Ocena czynności nerek
Metformina i sitagliptyna są zasadniczo wydalane przez nerki. Ryzyko kumulacji metforminy i kwasicy mleczanowej wzrasta wraz ze stopniem upośledzenia czynności nerek. Dlatego pacjenci z poziomem kreatyniny w surowicy powyżej górnej granicy normy dla swojego wieku nie powinni otrzymywać Janumet. U osób w podeszłym wieku należy ostrożnie zwiększać dawkę produktu Janumet, aby ustalić minimalną dawkę zapewniającą odpowiedni efekt glikemiczny, ponieważ starzenie może wiązać się ze zmniejszoną czynnością nerek. [Widzieć Ostrzeżenia i środki i Użyj w określonych populacjach.]
Przed rozpoczęciem leczenia produktem Janumet, a następnie co najmniej raz w roku, czynność nerek należy ocenić i zweryfikować jako normalną. U pacjentów, u których przewiduje się rozwój zaburzeń czynności nerek, szczególnie u pacjentów w podeszłym wieku, nerki czynność należy oceniać częściej, a Janumet należy przerwać, jeśli istnieją dowody na zaburzenia czynności nerek obecny.
Aneuryna12 Poziomy
W kontrolowanych badaniach klinicznych metforminy trwających 29 tygodni zmniejszenie do poniżej normy poziomów wcześniej normalnej witaminy B w surowicy12 poziomy, bez objawów klinicznych, obserwowano u około 7% pacjentów. Taki spadek, prawdopodobnie z powodu interferencji z B.12 absorpcja z B12- kompleks czynników wewnętrznych jest jednak bardzo rzadko związany z niedokrwistością i wydaje się być szybko odwracalny po odstawieniu metforminy lub witaminy B12 suplementacja. U pacjentów leczonych produktem Janumet zaleca się coroczny pomiar parametrów hematologicznych, a wszelkie widoczne nieprawidłowości należy odpowiednio zbadać i kontrolować. [Widzieć Działania niepożądane.]
Niektóre osoby (osoby z nieodpowiednią witaminą B12 lub przyjmowanie lub wchłanianie wapnia) wydaje się być predysponowane do rozwoju nienormalnej witaminy B12 poziomy. U tych pacjentów rutynowa witamina B w surowicy12 przydatne mogą być pomiary w odstępach od dwóch do trzech lat.
Spożycie alkoholu
Wiadomo, że alkohol nasila wpływ metforminy na metabolizm mleczanu. Dlatego należy ostrzec pacjentów przed nadmiernym spożywaniem alkoholu, ostrym lub przewlekłym podczas przyjmowania leku Janumet.
Zabiegi chirurgiczne
Stosowanie preparatu Janumet należy tymczasowo zawiesić w przypadku każdego zabiegu chirurgicznego (z wyjątkiem drobnych zabiegów niezwiązanych z ograniczonym przyjmowaniem żywności i płynów) i nie należy go wznawiać, dopóki nie zostanie wznowione przyjmowanie doustne przez pacjenta, a czynność nerek zostanie oceniona jako normalna.
Zmiana stanu klinicznego pacjentów z wcześniej kontrolowaną cukrzycą typu 2
Pacjent z cukrzycą typu 2, wcześniej dobrze kontrolowany na Janumet, u którego występują nieprawidłowości laboratoryjne lub kliniczne choroba (szczególnie niejasna i źle zdefiniowana) powinna być niezwłocznie oceniona pod kątem występowania kwasicy ketonowej lub kwasu mlekowego kwasica. Ocena powinna obejmować elektrolity i ketony w surowicy, poziom glukozy we krwi oraz, jeśli wskazane, pH krwi, mleczan, pirogronian i poziomy metforminy. Jeśli wystąpi kwasica którejkolwiek z postaci, należy natychmiast przerwać stosowanie Janumet i podjąć inne odpowiednie działania naprawcze.
Używaj z lekami, które mogą powodować hipoglikemię
Sitagliptyna
Jak to typowe w przypadku innych leków przeciwhiperglikemicznych stosowanych w połączeniu z pochodną sulfonylomocznika, gdy sitagliptyna była stosowana w połączeniu z metforminą i sulfonylomocznik, lek wywołujący hipoglikemię, częstość występowania hipoglikemii wzrosła w porównaniu z placebo w połączeniu z metforminą i sulfonylomocznik [patrz Działania niepożądane]. Dlatego też pacjenci otrzymujący lek wydzielający insulinę (np. Sulfonylomocznik, meglitinid) mogą wymagać mniejszej dawki leku wydzielającego insulinę, aby zmniejszyć ryzyko hipoglikemii [patrz Dawkowanie i sposób podawania].
Chlorowodorek metforminy
Hipoglikemia nie występuje u pacjentów otrzymujących samą metforminę w zwykłych okolicznościach stosowania, ale może wystąpić, gdy spożycie kalorii jest niewystarczające, gdy forsowne ćwiczenia nie są kompensowane przez suplementację kaloryczną lub podczas jednoczesnego stosowania z innymi środkami obniżającymi stężenie glukozy (takimi jak sulfonylomoczniki i insulina) lub etanol. Osoby w podeszłym wieku, osłabione lub niedożywione oraz osoby z niewydolnością nadnerczy lub przysadki mózgowej lub zatruciem alkoholem są szczególnie podatne na działanie hipoglikemiczne. Hipoglikemia może być trudna do rozpoznania u osób w podeszłym wieku oraz u osób przyjmujących leki blokujące receptory ren2-adrenergiczne.
Jednoczesne leki wpływające na czynność nerek lub dyspozycję metforminy
Jednoczesne leki, które mogą wpływać na czynność nerek lub powodować znaczące zmiany hemodynamiczne lub mogą zakłócają dyspozycję metforminy, takiej jak leki kationowe, które są eliminowane przez wydzielanie kanalikowe przez nerki [widzieć Interakcje z lekami], należy stosować ostrożnie.
Badania radiologiczne z wewnątrznaczyniowymi jodowymi materiałami kontrastowymi
Badania kontrastu wewnątrznaczyniowego z materiałami jodowanymi (na przykład urogram dożylny, cholangiografia dożylna, angiografia i tomografia komputerowa (CT) z wewnątrznaczyniowymi materiałami kontrastowymi) może prowadzić do ostrej zmiany czynności nerek i wiązać się z kwasicą mleczanową u pacjentów otrzymujących metforminę [patrz Przeciwwskazania]. Dlatego u pacjentów, u których planuje się takie badanie, należy tymczasowo przerwać stosowanie Janumet w momencie lub przed i wstrzymano na 48 godzin po zabiegu, a wznowiono dopiero po ponownej ocenie czynności nerek i stwierdzeniu, że bądź normalny.
Stany niedotlenienia
Zapaść sercowo-naczyniowa (wstrząs) z jakiejkolwiek przyczyny, ostra zastoinowa niewydolność serca, ostry zawał mięśnia sercowego i inne stany charakteryzujące się hipoksemią były związane z kwasicą mleczanową i mogą również powodować przednerkę azotemia. Gdy takie zdarzenia wystąpią u pacjentów leczonych produktem Janumet, lek należy natychmiast przerwać.
Utrata kontroli poziomu glukozy we krwi
Gdy pacjent ustabilizowany w dowolnym schemacie cukrzycowym jest narażony na stres, taki jak gorączka, uraz, infekcja lub operacja, może wystąpić przejściowa utrata kontroli glikemii. W takich przypadkach może być konieczne wstrzymanie podawania Janumet i tymczasowe podanie insuliny. Janumet może zostać przywrócony po rozwiązaniu ostrego epizodu.
Reakcje nadwrażliwości
Po wprowadzeniu do obrotu zgłaszano poważne reakcje nadwrażliwości u pacjentów leczonych sitagliptyną, jednym ze składników leku Janumet. Reakcje te obejmują anafilaksję, obrzęk naczynioruchowy i złuszczające stany skóry, w tym zespół Stevensa-Johnsona. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, jest to na ogół niemożliwe jest wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek. Te reakcje wystąpiły w ciągu pierwszych 3 miesięcy po rozpoczęciu leczenia sitagliptyną, a niektóre doniesienia pojawiły się po pierwszej dawce. Jeśli podejrzewa się reakcję nadwrażliwości, przerwij Janumet, sprawdź inne potencjalne przyczyny zdarzenia i zastosuj alternatywne leczenie cukrzycy. [Widzieć Działania niepożądane.]
Wyniki makronaczyniowe
Nie przeprowadzono badań klinicznych, które potwierdziłyby jednoznaczne dowody na zmniejszenie ryzyka makronaczyniowego za pomocą Janumet lub jakiegokolwiek innego leku przeciwcukrzycowego.
Top
Działania niepożądane
Doświadczenia z badań klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo różnych warunkach, częstość występowania działań niepożądanych obserwowana w badaniach klinicznych a leku nie można bezpośrednio porównać ze wskaźnikami w badaniach klinicznych innego leku i może nie odzwierciedlać wskaźników obserwowanych w ćwiczyć.
Jednoczesne podawanie sitagliptyny i metforminy u pacjentów z cukrzycą typu 2 niedostatecznie kontrolowanymi w diecie i ćwiczeniach
Tabela 1 podsumowuje najczęstsze (5% pacjentów) zgłaszane działania niepożądane (niezależnie od oceny związku przyczynowego przez badacza) w ciągu 24 tygodni badanie czynnikowe kontrolowane placebo, w którym sitagliptyna i metformina były podawane jednocześnie pacjentom z cukrzycą typu 2 niedostatecznie kontrolowanym na diecie i ćwiczenia.
Tabela 1: Sitagliptyna i metformina podawane jednocześnie pacjentom z cukrzycą typu 2 niedostatecznie kontrolowanymi w diecie i ćwiczeniach: działania niepożądane Zgłoszone (niezależnie od oceny przyczynowości badacza) u 5% pacjentów otrzymujących terapię skojarzoną (i więcej niż u pacjentów otrzymujących Placebo)*
| Liczba pacjentów (%) | ||||
Placebo |
Sitagliptyna 100 mg QD |
Metformina 500 mg / Metformina 1000 mg bid†|
Sitagliptyna 50 mg bid + Metformina 500 mg / Metformina 1000 mg bid†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Biegunka | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Zakażenia górnych dróg oddechowych | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Bół głowy | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Terapia dodatkowa sitagliptyną u pacjentów z cukrzycą typu 2 niewystarczająco kontrolowanych w monoterapii metforminą
W 24-tygodniowym kontrolowanym placebo badaniu sitagliptyny 100 mg podawanej raz dziennie dodawanej do schematu metforminy dwa razy dziennie, nie było zgłaszane działania niepożądane niezależnie od oceny związku przyczynowo-skutkowego u 5% pacjentów i częściej niż u pacjentów placebo. Przerwanie leczenia z powodu klinicznych działań niepożądanych było podobne jak w grupie placebo (sitagliptyna i metformina, 1,9%; placebo i metformina, 2,5%).
Hipoglikemia
Działania niepożądane hipoglikemii oparto na wszystkich zgłoszeniach hipoglikemii; jednoczesny pomiar glukozy nie był wymagany. Ogólna częstość wcześniej określonych działań niepożądanych hipoglikemii u pacjentów z cukrzycą typu 2 nieodpowiednio kontrolowanych za pomocą diety i ćwiczeń wyniosła 0,6% w pacjenci otrzymujący placebo, 0,6% u pacjentów otrzymujących samą sitagliptynę, 0,8% u pacjentów otrzymujących samą metforminę i 1,6% u pacjentów otrzymujących sitagliptynę w skojarzeniu z metformina. U pacjentów z cukrzycą typu 2 niewystarczająco kontrolowanych samą metforminą ogólna częstość występowania działań niepożądanych reakcje hipoglikemii wyniosły 1,3% u pacjentów otrzymujących leczenie sitagliptyną i 2,1% u pacjentów otrzymujących leczenie placebo.
Działania niepożądane ze strony przewodu pokarmowego
Częstość wcześniej wybranych działań niepożądanych ze strony przewodu pokarmowego u pacjentów leczonych sitagliptyną i metforminą była podobna do zgłaszanej u pacjentów leczonych samą metforminą. Tabela 2.
Tabela 2: Wstępnie wybrane działania niepożądane ze strony przewodu pokarmowego (niezależnie od oceny przyczynowości badacza) zgłoszone u pacjentów z cukrzycą typu 2 otrzymujących sitagliptynę i metforminę.
| Liczba pacjentów (%) | ||||||
| Badanie sitagliptyny i metforminy u pacjentów niedostatecznie kontrolowanych w sprawie diety i ćwiczeń |
Badanie dodatku sitagliptyny u pacjentów niedostatecznie kontrolowanych za pomocą samej metforminy | |||||
Placebo |
Sitagliptyna 100 mg QD |
Metformina 500 mg / Metformina 1000 mg bid* |
Sitagliptyna 50 mg bid + Metformina 500 mg / Metformina 1000 mg bid* |
Placebo i metformina • 1500 mg na dobę |
Sitagliptyna 100 mg QD i metformina • 1500 mg na dobę |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Biegunka | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Nudności | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Wymioty | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Ból brzucha†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptyna w połączeniu z metforminą i glimepirydem
W 24-tygodniowym kontrolowanym placebo badaniu z sitagliptyną w dawce 100 mg jako terapią dodatkową u pacjentów z cukrzycą typu 2 nieodpowiednio kontrolowaną za pomocą metforminy i glimepirydu (sitagliptyna, N = 116; placebo, N = 113), zgłaszane działania niepożądane niezależnie od oceny związku przyczynowego przez badacza u 5% pacjentów leczeni sitagliptyną i częściej niż u pacjentów leczonych placebo: hipoglikemia (sitagliptyna, 16,4%; placebo, 0,9%) i ból głowy (6,9%, 2,7%).
Nie obserwowano klinicznie znaczących zmian w parametrach życiowych ani w EKG (w tym w odstępie QTc) po połączeniu sitagliptyny i metforminy.
Najczęstsze działania niepożądane związane z monoterapią sitagliptyną zgłaszane niezależnie od badacza ocena przyczynowości u 5% pacjentów i częściej niż u pacjentów otrzymujących placebo była zapalenie nosogardzieli.
Najczęstsze (> 5%) stwierdzone działania niepożądane związane z rozpoczęciem leczenia metforminą to biegunka, nudności / wymioty, wzdęcia, dyskomfort w jamie brzusznej, niestrawność, osłabienie i ból głowy.
Testy laboratoryjne
Sitagliptyna
Częstość występowania niepożądanych działań laboratoryjnych była podobna u pacjentów leczonych sitagliptyną i metforminą (7,6%) w porównaniu do pacjentów leczonych placebo i metforminą (8,7%). W większości, ale nie we wszystkich badaniach, niewielki wzrost liczby białych krwinek (około 200 komórek / mikroL różnica w WBC w porównaniu z placebo; średnia wyjściowa liczba białych krwinek wynosiła około 6600 komórek / mikrolit) ze względu na niewielki wzrost liczby granulocytów obojętnochłonnych. Ta zmiana parametrów laboratoryjnych nie jest uważana za istotną klinicznie.
Chlorowodorek metforminy
W kontrolowanych badaniach klinicznych metforminy trwających 29 tygodni zmniejszenie do poniżej normy poziomów wcześniej normalnej witaminy B w surowicy12 poziomy, bez objawów klinicznych, obserwowano u około 7% pacjentów. Taki spadek, prawdopodobnie z powodu interferencji z B.12 absorpcja z B12- kompleks czynników wewnętrznych jest jednak bardzo rzadko związany z niedokrwistością i wydaje się być szybko odwracalny po odstawieniu metforminy lub witaminy B12 suplementacja. [Widzieć Ostrzeżenia i środki.]
Doświadczenie po wprowadzeniu do obrotu
Podczas stosowania produktu Janumet lub sitagliptyny, jednego ze składników leku Janumet, zidentyfikowano następujące dodatkowe działania niepożądane. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, jest to na ogół niemożliwe jest wiarygodne oszacowanie ich częstości lub ustalenie związku przyczynowego z ekspozycją na lek.
Reakcje nadwrażliwości obejmują anafilaksję, obrzęk naczynioruchowy, wysypkę, pokrzywkę, zapalenie naczyń skóry i złuszczające stany skóry, w tym zespół Stevensa-Johnsona [patrz Ostrzeżenia i środki]; zakażenia górnych dróg oddechowych; zwiększenie aktywności enzymów wątrobowych; zapalenie trzustki.
Top
Interakcje z lekami
Leki kationowe
Leki kationowe (np. Amiloryd, digoksyna, morfina, prokainamid, chinidyna, chinina, ranitydyna, triamteren, trimetoprim lub wankomycyna) wydalane przez nerkowe wydzielanie kanalikowe teoretycznie mają potencjał do interakcji z metforminą poprzez rywalizację o wspólny transport kanalików nerkowych systemy. Takie interakcje między metforminą a doustną cymetydyną obserwowano u zdrowych zdrowych ochotników zarówno w przypadku pojedynczej dawki, jak i wielokrotnych dawek metforminy-cymetydyny badania interakcji leków, z 60% wzrostem maksymalnego stężenia metforminy w osoczu i pełnej krwi oraz o 40% wzrostem metforminy w osoczu i pełnej krwi AUC. Okres półtrwania w fazie eliminacji nie zmienił się w badaniu z pojedynczą dawką. Metformina nie miała wpływu na farmakokinetykę cymetydyny. Chociaż takie interakcje pozostają teoretyczne (z wyjątkiem cymetydyny), uważne monitorowanie pacjenta i dostosowanie dawki produktu Janumet i (lub) lek interferujący jest zalecany u pacjentów przyjmujących leki kationowe, które są wydalane przez bliższe wydzielanie kanalikowe nerkowe system.
Digoksyna
Nastąpił niewielki wzrost obszaru pod krzywą (AUC, 11%) i średnie maksymalne stężenie leku (Cmax, 18%) digoksyny przy jednoczesnym podawaniu 100 mg sitagliptyny przez 10 dni. Wzrostów tych nie uważa się za mające znaczenie kliniczne. Digoksyna, jako lek kationowy, może potencjalnie konkurować z metforminą o powszechne nerkowe układy transportu cewkowego, wpływając w ten sposób na stężenie digoksyny, metforminy lub obu tych substancji w surowicy. Pacjentów otrzymujących digoksynę należy odpowiednio monitorować. Nie zaleca się dostosowywania dawki digoksyny ani preparatu Janumet.
Gliburyd
W badaniu interakcji z pojedynczą dawką u pacjentów z cukrzycą typu 2, jednoczesne podawanie metforminy i gliburydu nie spowodowało żadnych zmian ani w farmakokinetyce, ani w farmakodynamice metforminy. Zmniejszenie AUC i C gliburydumax zaobserwowano, ale były one bardzo zmienne. Charakter tego badania z pojedynczą dawką i brak korelacji między poziomem gliburydu we krwi a efektami farmakodynamicznymi sprawiają, że znaczenie kliniczne tej interakcji jest niepewne.
Furosemid
Badanie interakcji metformina-furosemid z pojedynczą dawką u zdrowych osób wykazało, że jednoczesne podawanie wpłynęło na parametry farmakokinetyczne obu związków. Furosemid zwiększał stężenie metforminy w osoczu i we krwi Cmax o 22% i AUC we krwi o 15%, bez znaczącej zmiany klirensu nerkowego metforminy. Przy podawaniu z metforminą Cmax i AUC furosemidu były odpowiednio o 31% i 12% mniejsze niż w przypadku podawania samego oraz końcowy okres półtrwania zmniejszył się o 32%, bez znaczącej zmiany w nerkach furosemidu luz. Brak dostępnych informacji na temat interakcji metforminy i furosemidu podczas długotrwałego równoczesnego podawania.
Nifedypina
Badanie interakcji pojedynczej dawki metforminy z nifedypiną u zdrowych zdrowych ochotników wykazało, że jednoczesne podawanie nifedypiny zwiększało stężenie metforminy C w osoczumax i AUC odpowiednio o 20% i 9% oraz zwiększyły ilość wydalaną z moczem. T.max i okres półtrwania nie uległy zmianie. Nifedypina wydaje się zwiększać wchłanianie metforminy. Metformina miała minimalny wpływ na nifedypinę.
Zastosowanie metforminy z innymi lekami
Niektóre leki powodują hiperglikemię i mogą prowadzić do utraty kontroli glikemii. Leki te obejmują tiazydy i inne leki moczopędne, kortykosteroidy, fenotiazyny, produkty tarczycy, estrogeny, doustne środki antykoncepcyjne, fenytoina, kwas nikotynowy, sympatykomimetyki, leki blokujące kanały wapniowe oraz izoniazyd. Gdy takie leki są podawane pacjentowi otrzymującemu Janumet, należy ściśle obserwować pacjenta, aby zachować odpowiednią kontrolę glikemii.
U zdrowych ochotników farmakokinetyka metforminy i propranololu oraz metforminy i ibuprofenu nie uległa zmianie w przypadku jednoczesnego podawania w badaniach interakcji z pojedynczą dawką.
Metformina jest w niewielkim stopniu związana z białkami osocza i dlatego jest mniej prawdopodobne, że będzie oddziaływać z lekami silnie związanymi z białkami, takimi jak salicylany, sulfonamidy, chloramfenikol i probenecyd, w porównaniu do pochodnych sulfonylomocznika, które są silnie związane z surowicą białka
Top
Użyj w określonych populacjach
Ciąża
Kategoria ciąży B:
Janumet
Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży z produktem Janumet lub jego poszczególnymi składnikami; dlatego bezpieczeństwo produktu Janumet u kobiet w ciąży nie jest znane. Janumet należy stosować w okresie ciąży tylko wtedy, gdy jest to bezwzględnie konieczne.
Merck & Co., Inc. prowadzi rejestr w celu monitorowania wyników ciąży kobiet narażonych na Janumet podczas ciąży. Zachęcamy pracowników służby zdrowia do zgłaszania wszelkich przypadków prenatalnej ekspozycji na Janumet, dzwoniąc do Rejestru Ciąży pod numerem (800) 986-8999.
Nie przeprowadzono badań na zwierzętach z połączonymi produktami w Janumet w celu oceny wpływu na reprodukcję. Poniższe dane oparte są na wynikach badań przeprowadzonych indywidualnie z sitagliptyną lub metforminą.
Sitagliptyna
Badania dotyczące rozmnażania przeprowadzono na szczurach i królikach. Dawki sitagliptyny do 125 mg / kg (około 12-krotność ekspozycji u ludzi przy maksymalnej zalecanej dawce dla ludzi) nie wpływały na płodność ani nie uszkadzały płodu. Brak jest jednak odpowiednich i dobrze kontrolowanych badań z sitagliptyną u kobiet w ciąży.
Sitagliptyna podawana ciężarnym samicom szczurów i królików od 6 do 20 dnia ciąży (organogeneza) nie wykazywała działania teratogennego w dawkach doustnych do 250 mg / kg (szczury) i 125 mg / kg (króliki) lub około 30 i 20-krotna ekspozycja u ludzi przy maksymalnej zalecanej dawce dla ludzi (MRHD) wynoszącej 100 mg / dzień w oparciu o AUC porównania. Wyższe dawki zwiększały częstość występowania wad rozwojowych żeber u potomstwa przy 1000 mg / kg lub około 100-krotnej ekspozycji człowieka na MRHD.
Sitagliptyna podawana samicom szczurów od dnia 6 ciąży do dnia 21 laktacji zmniejszała masę ciała samców i samic potomstwa przy 1000 mg / kg. Nie obserwowano toksyczności funkcjonalnej ani behawioralnej u potomstwa szczurów.
Przeniesienie sitagliptyny przez łożysko ciężarnym szczurom wyniosło około 45% po 2 godzinach i 80% po 24 godzinach od podania. Transfer sitagliptyny przez łożysko ciężarnym królikom wynosił około 66% po 2 godzinach i 30% po 24 godzinach.
Chlorowodorek metforminy
Metformina nie wykazywała działania teratogennego u szczurów i królików w dawkach do 600 mg / kg / dobę. Stanowi to narażenie około 2 i 6 razy większe niż maksymalna zalecana dawka dobowa dla ludzi wynosząca 2000 mg na podstawie porównań powierzchni ciała, odpowiednio u szczurów i królików. Oznaczenie stężeń u płodu wykazało częściową barierę łożyskową dla metforminy.
Matki karmiące
Nie przeprowadzono badań na zwierzętach w okresie laktacji z połączonymi składnikami preparatu Janumet. W badaniach przeprowadzonych z poszczególnymi składnikami zarówno sitagliptyna, jak i metformina są wydzielane do mleka szczurów w okresie laktacji. Nie wiadomo, czy sitagliptyna przenika do mleka ludzkiego. Ponieważ wiele leków przenika do mleka kobiecego, należy zachować ostrożność, gdy Janumet jest podawany kobiecie karmiącej.
Zastosowanie pediatryczne
Nie ustalono bezpieczeństwa i skuteczności preparatu Janumet u dzieci i młodzieży w wieku poniżej 18 lat.
Zastosowanie geriatryczne
Janumet
Ponieważ sitagliptyna i metformina są zasadniczo wydalane przez nerki, a ponieważ starzenie może wiązać się ze zmniejszoną czynnością nerek, należy zachować ostrożność podczas stosowania leku Janumet w miarę starzenia się. Należy zachować ostrożność przy doborze dawki i opierać się na starannym i regularnym monitorowaniu czynności nerek. [Widzieć Ostrzeżenia i środki; Farmakologia kliniczna.]
Sitagliptyna
Z ogólnej liczby pacjentów (N = 3884) w badaniach klinicznych fazy II i III sitagliptyny 725 pacjentów miało 65 lat i więcej, a 61 pacjentów miało 75 lat i więcej. Nie zaobserwowano ogólnych różnic w bezpieczeństwie lub skuteczności między pacjentami w wieku 65 lat i starszymi a młodszymi osobami. Podczas gdy to i inne zgłaszane doświadczenia kliniczne nie wykazały różnic w odpowiedziach wśród starszych i młodszych pacjentów większa wrażliwość niektórych starszych osób nie może być wykluczone.
Chlorowodorek metforminy
Kontrolowane badania kliniczne metforminy nie obejmowały wystarczającej liczby pacjentów w podeszłym wieku, aby ustalić, czy reagują inaczej od młodszych pacjentów, chociaż inne zgłaszane doświadczenia kliniczne nie wykazały różnic w odpowiedziach między osobami starszymi i młodymi pacjenci Metforminę należy stosować wyłącznie u pacjentów z prawidłową czynnością nerek. Dawka początkowa i podtrzymująca metforminy powinna być zachowawcza u pacjentów w podeszłym wieku, ze względu na możliwość pogorszenia czynności nerek w tej populacji. Dostosowanie dawki powinno opierać się na dokładnej ocenie czynności nerek. [Widzieć Przeciwwskazania; Ostrzeżenia i środki; i Farmakologia kliniczna.]
Top
Przedawkować
Sitagliptyna
Podczas kontrolowanych badań klinicznych z udziałem zdrowych osób podawano pojedyncze dawki sitagliptyny do 800 mg. Maksymalne średnie zwiększenie QTc o 8,0 ms obserwowano w jednym badaniu przy dawce 800 mg sitagliptyny, średni efekt, który nie jest uważany za klinicznie ważny [patrz Farmakologia kliniczna]. Brak doświadczenia z dawkami powyżej 800 mg u ludzi. W badaniach fazy I wielokrotnych dawek nie obserwowano zależnych od dawki klinicznych działań niepożądanych sitagliptyny w dawkach do 400 mg na dobę przez okres do 28 dni.
W przypadku przedawkowania uzasadnione jest zastosowanie zwykłych środków wspomagających, np. Usunięcie niewchłoniętego materiału z przewodu pokarmowego przewód, zastosować monitorowanie kliniczne (w tym uzyskanie elektrokardiogramu) i rozpocząć leczenie wspomagające zgodnie ze wskazaniami klinicznymi pacjenta status.
Sitagliptyna jest w niewielkim stopniu dializowana. W badaniach klinicznych około 13,5% dawki zostało usunięte podczas 3- do 4-godzinnej sesji hemodializy. W przypadku, gdy jest to klinicznie uzasadnione, można rozważyć przedłużoną hemodializę. Nie wiadomo, czy sitagliptyna jest dializowana za pomocą dializy otrzewnowej.
Chlorowodorek metforminy
Wystąpiło przedawkowanie chlorowodorku metforminy, w tym spożycie większych niż 50 gramów. Hipoglikemię zgłoszono w około 10% przypadków, ale nie stwierdzono związku przyczynowego z chlorowodorkiem metforminy. Kwasicę mleczanową odnotowano w około 32% przypadków przedawkowania metforminy [patrz Ostrzeżenia i środki]. Metforminę można dializować z klirensem do 170 ml / min w dobrych warunkach hemodynamicznych. Dlatego hemodializa może być przydatna do usuwania nagromadzonego leku od pacjentów, u których podejrzewa się przedawkowanie metforminy.
Top
Opis
Tabletki Janumet (sitagliptyna / metformina HCl) zawierają dwa doustne leki przeciwhiperglikemiczne stosowane w leczeniu cukrzycy typu 2: sitagliptyna i chlorowodorek metforminy.
Sitagliptyna
Sitagliptyna jest doustnie aktywnym inhibitorem enzymu dipeptydylopeptydazy-4 (DPP-4). Sitagliptyna jest obecna w tabletkach Janumet w postaci monohydratu fosforanu sitagliptyny. Fosforan sitagliptyny monohydrat jest opisywany chemicznie jako 7 - [(3R) - 3 - amino - 1 - okso - 4 - (2,4,5 - trifluorofenylo) butylo] - 5,6,7,8 - tetrahydro - 3 - (trifluorometylo) - 1,2,4 - triazolo [4,3 - a] pirazyno fosforan (1: 1) monohydrat o wzorze empirycznym z C.16H.15fa6N.5O3PO4-H2O i masa cząsteczkowa 523,32. Wzór strukturalny jest następujący:
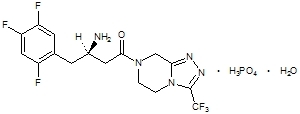
Fosforan sitagliptyny jest białym lub prawie białym, krystalicznym, niehigroskopijnym proszkiem. Jest rozpuszczalny w wodzie i N, N-dimetyloformamidzie; słabo rozpuszczalny w metanolu; bardzo słabo rozpuszczalny w etanolu, acetonie i acetonitrylu; i nierozpuszczalny w izopropanolu i octanie izopropylu.
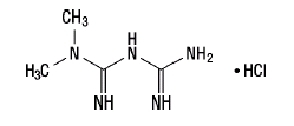
Chlorowodorek metforminy
Chlorowodorek metforminy (chlorowodorek diamidu N, N-dimetyloimidodikarbonimidowego) nie jest chemicznie ani farmakologicznie powiązany z żadną inną klasą doustnych leków przeciwhiperglikemicznych. Metformina chlorowodorek jest białym do białawego krystalicznym związkiem o wzorze cząsteczkowym C4H.11N.5-HCl i masa cząsteczkowa 165,63. Chlorowodorek metforminy jest łatwo rozpuszczalny w wodzie i jest praktycznie nierozpuszczalny w acetonie, eterze i chloroformie. PKza metforminy wynosi 12,4. Wartość pH 1% wodnego roztworu chlorowodorku metforminy wynosi 6,68. Wzór strukturalny jest taki, jak pokazano:
Janumet
Janumet jest dostępny do podawania doustnego w postaci tabletek zawierających 64,25 mg monohydratu fosforanu sitagliptyny i równoważnika chlorowodorku metforminy na: 50 mg sitagliptyny w postaci wolnej zasady i 500 mg metforminy chlorowodorku (Janumet 50 mg / 500 mg) lub 1000 mg metforminy chlorowodorku (Janumet 50 mg / 1000 mg). Każda tabletka powlekana Janumet zawiera następujące nieaktywne składniki: celulozę mikrokrystaliczną, poliwinylopirolidon, laurylosiarczan sodu i stearylofumaran sodu. Ponadto powłoczka zawiera następujące nieaktywne składniki: alkohol poliwinylowy, glikol polietylenowy, talk, dwutlenek tytanu, czerwony tlenek żelaza i czarny tlenek żelaza.
Top
Farmakologia kliniczna
Mechanizm akcji
Janumet
Janumet łączy dwa leki przeciwhiperglikemiczne z uzupełniającymi się mechanizmami działania w celu poprawy kontroli glikemii u pacjentów z cukrzyca typu 2: sitagliptyna, inhibitor dipeptydylopeptydazy-4 (DPP-4) i chlorowodorek metforminy, członek biguanidu klasa.
Sitagliptyna
Sitagliptyna jest inhibitorem DPP-4, który, jak się uważa, wywiera swoje działanie u pacjentów z cukrzycą typu 2, spowalniając inaktywację hormonów inkretynowych. Stężenia aktywnych nienaruszonych hormonów są zwiększane przez sitagliptynę, tym samym zwiększając i przedłużając działanie tych hormonów. Hormony inkretyny, w tym peptyd glukagonopodobny-1 (GLP-1) i insulinotropowa zależna od glukozy polipeptyd (GIP), są uwalniane przez jelito w ciągu dnia, a poziomy wzrastają w odpowiedzi do posiłku. Hormony te są szybko inaktywowane przez enzym DPP-4. Inkretyny są częścią układu endogennego zaangażowanego w fizjologiczną regulację homeostazy glukozy. Gdy stężenie glukozy we krwi jest prawidłowe lub podwyższone, GLP-1 i GIP zwiększają syntezę insuliny i uwalnianie z trzustkowych komórek beta poprzez wewnątrzkomórkowe szlaki sygnałowe obejmujące cykliczny AMP. GLP-1 obniża również wydzielanie glukagonu z komórek alfa trzustki, co prowadzi do zmniejszenia produkcji glukozy w wątrobie. Zwiększając i przedłużając poziomy aktywnej inkretyny, sitagliptyna zwiększa uwalnianie insuliny i zmniejsza poziomy glukagonu w krążeniu w sposób zależny od glukozy. Sitagliptyna wykazuje selektywność wobec DPP-4 i nie hamuje aktywności DPP-8 ani DPP-9 in vitro w stężeniach zbliżonych do dawek terapeutycznych.
Chlorowodorek metforminy
Metformina jest lekiem przeciwhiperglikemicznym, który poprawia tolerancję glukozy u pacjentów z cukrzycą typu 2, obniżając poziom glukozy w osoczu zarówno po podaniu podstawowym, jak i poposiłkowym. Jego farmakologiczne mechanizmy działania różnią się od innych klas doustnych leków przeciwhiperglikemicznych. Metformina zmniejsza wytwarzanie glukozy w wątrobie, zmniejsza wchłanianie glukozy w jelitach i poprawia wrażliwość na insulinę poprzez zwiększenie obwodowego wychwytu i zużycia glukozy. W przeciwieństwie do pochodnych sulfonylomocznika, metformina nie powoduje hipoglikemii ani u pacjentów z cukrzycą typu 2, ani u osób zdrowych (z wyjątkiem szczególnych okoliczności [patrz Ostrzeżenia i środki]) i nie powoduje hiperinsulinemii. Podczas leczenia metforminą wydzielanie insuliny pozostaje niezmienione, podczas gdy poziomy insuliny na czczo i całodzienna odpowiedź na insulinę w osoczu mogą faktycznie ulec zmniejszeniu.
12.2 Farmakodynamika
Sitagliptyna
Generał
U pacjentów z cukrzycą typu 2 podawanie sitagliptyny prowadziło do zahamowania aktywności enzymu DPP-4 przez 24 godziny. Po doustnym obciążeniu glukozą lub posiłku to hamowanie DPP-4 spowodowało 2- do 3-krotny wzrost poziomów krążącego aktywnego GLP-1 i GIP, zmniejszone stężenie glukagonu i zwiększona reaktywność uwalniania insuliny na glukozę, co prowadzi do wyższego peptydu C i insuliny koncentracje. Wzrost insuliny wraz ze spadkiem glukagonu był związany z niższymi stężeniami glukozy na czczo i zmniejszonym skokiem glukozy po doustnym obciążeniu glukozą lub posiłku.
Jednoczesne podawanie sitagliptyny i chlorowodorku metforminy
W dwudniowym badaniu z udziałem zdrowych osób sama sitagliptyna zwiększała stężenia aktywnego GLP-1, podczas gdy sama metformina zwiększała stężenia aktywne i całkowite GLP-1 w podobnym stopniu. Jednoczesne podawanie sitagliptyny i metforminy miało addytywny wpływ na aktywne stężenia GLP-1. Sitagliptyna, ale nie metformina, zwiększała stężenia aktywnego GIP. Nie jest jasne, co te odkrycia oznaczają dla zmian w kontroli glikemii u pacjentów z cukrzycą typu 2.
W badaniach z udziałem zdrowych osób sitagliptyna nie obniżała poziomu glukozy we krwi ani nie powodowała hipoglikemii.
Elektrofizjologia serca
W randomizowanym, kontrolowanym placebo badaniu krzyżowym 79 zdrowym osobom podano pojedynczą doustną dawkę sitagliptyny 100 mg, sitagliptyny 800 mg (8-krotność zalecanej dawki) i placebo. Przy zalecanej dawce 100 mg nie stwierdzono wpływu na odstęp QTc uzyskany przy maksymalnym stężeniu w osoczu ani w żadnym innym momencie badania. Po podaniu dawki 800 mg maksymalny wzrost średniej QTc skorygowanej o placebo w stosunku do wartości wyjściowej po 3 godzinach od podania wynosił 8,0 ms. Ten wzrost nie jest uważany za klinicznie znaczący. Przy dawce 800 mg maksymalne stężenie sitagliptyny w osoczu było około 11 razy wyższe niż maksymalne stężenie po dawce 100 mg.
U pacjentów z cukrzycą typu 2 podawanych codziennie sitagliptyna 100 mg (N = 81) lub sitagliptyna 200 mg (N = 63) na dobę nie stwierdzono istotnych zmian odstępu QTc na podstawie danych EKG uzyskanych w czasie oczekiwanego maksymalnego osocza stężenie.
Farmakokinetyka
Janumet
Wyniki badania biorównoważności u zdrowych osób wykazały, że Janumet (sitagliptyna / metformina HCl) 50 mg / 500 Tabletki złożone mg i 50 mg / 1000 mg są biorównoważne z jednoczesnym podawaniem odpowiednich dawek sitagliptyny (JANUVIA™2) i chlorowodorek metforminy w postaci pojedynczych tabletek.
Wchłanianie
Sitagliptyna
Bezwzględna dostępność biologiczna sitagliptyny wynosi około 87%. Jednoczesne podawanie wysokotłuszczowego posiłku z sitagliptyną nie miało wpływu na farmakokinetykę sitagliptyny.
Chlorowodorek metforminy
Bezwzględna dostępność biologiczna tabletki 500 mg chlorowodorku metforminy podawanej na czczo wynosi około 50–60%. Badania z zastosowaniem pojedynczych doustnych dawek tabletek chlorowodorku metforminy 500 mg do 1500 mg oraz 850 mg do 2550 mg wskazują, że istnieje brak proporcjonalności dawki do rosnących dawek, który wynika raczej ze zmniejszonego wchłaniania niż zmiany w eliminacji. Pokarm zmniejsza zakres i nieznacznie opóźnia wchłanianie metforminy, o czym świadczy około 40% niższe średnie maksymalne stężenie w osoczu (Cmax), o 25% niższe pole pod krzywą stężenia w osoczu w funkcji czasu (AUC) oraz 35-minutowe wydłużenie czasu do osiągnięcia maksymalnego stężenia w osoczu (Tmax) po podaniu pojedynczej tabletki 850 mg metforminy z jedzeniem, w porównaniu z tą samą mocą tabletki podaną na czczo. Znaczenie kliniczne tych spadków nie jest znane.
Dystrybucja
Sitagliptyna
Średnia objętość dystrybucji w stanie stacjonarnym po pojedynczej dożylnej dawce 100 mg sitagliptyny dla zdrowych osób wynosi około 198 litrów. Udział sitagliptyny w sposób odwracalny związany z białkami osocza jest niski (38%).
Chlorowodorek metforminy
Pozorna objętość dystrybucji (V / F) metforminy po pojedynczych doustnych dawkach tabletek chlorowodorku metforminy 850 mg wynosiła średnio 654 ± 358 l. Metformina w niewielkim stopniu wiąże się z białkami osocza, w przeciwieństwie do pochodnych sulfonylomocznika, które są w ponad 90% związane z białkami. Metformina dzieli się na erytrocyty, najprawdopodobniej w funkcji czasu. Przy zwykłych dawkach klinicznych i harmonogramach dawkowania tabletek chlorowodorku metforminy stężenie metforminy w stanie stacjonarnym jest osiągane w ciągu 24–48 godzin i na ogół wynosi
Metabolizm
Sitagliptyna
Około 79% sitagliptyny jest wydalane w postaci niezmienionej z moczem, a metabolizm jest niewielką drogą eliminacji.
Po [14C] sitagliptyna w dawce doustnej, około 16% radioaktywności zostało wydalone jako metabolity sitagliptyny. Wykryto sześć metabolitów na poziomach śladowych i nie oczekuje się, aby przyczyniały się do działania sitagliptyny na DPP-4 w osoczu. Badania in vitro wykazały, że głównym enzymem odpowiedzialnym za ograniczony metabolizm sitagliptyny był CYP3A4, z udziałem CYP2C8.
Chlorowodorek metforminy
Dożylne badania z pojedynczą dawką u zdrowych osób wykazały, że metformina jest wydalana w postaci niezmienionej mocz i nie ulega metabolizmowi w wątrobie (u ludzi nie zidentyfikowano metabolitów) ani żółci wydalanie.
Wydalanie
Sitagliptyna
Po podaniu doustnym [14C] dawka sitagliptyny dla zdrowych osób, około 100% podanej radioaktywności zostało wydalone z kałem (13%) lub moczem (87%) w ciągu tygodnia od podania. Pozorny terminal t1/2 po doustnej dawce 100 mg sitagliptyny wynosiło około 12,4 godziny, a klirens nerkowy wynosił około 350 ml / min.
Eliminacja sitagliptyny następuje głównie przez nerki i wiąże się z czynnym wydzielaniem kanalikowym. Sitagliptyna jest substratem dla ludzkiego transportera anionów organicznych-3 (hOAT-3), który może uczestniczyć w nerkowej eliminacji sitagliptyny. Znaczenie kliniczne hOAT-3 w transporcie sitagliptyny nie zostało ustalone. Sitagliptyna jest również substratem glikoproteiny p, która może być również zaangażowana w pośredniczenie w wydalaniu sitagliptyny przez nerki. Jednak cyklosporyna, inhibitor glikoproteiny p, nie zmniejszała klirensu nerkowego sitagliptyny.
Chlorowodorek metforminy
Klirens nerkowy jest około 3,5 razy większy niż klirens kreatyniny, co wskazuje, że wydzielanie kanalikowe jest główną drogą eliminacji metforminy. Po podaniu doustnym około 90% wchłoniętego leku jest wydalane przez nerki w ciągu pierwszych 24 godzin, a okres półtrwania w osoczu wynosi około 6,2 godziny. We krwi okres półtrwania w fazie eliminacji wynosi około 17,6 godziny, co sugeruje, że masa erytrocytów może stanowić przedział dystrybucji.
Specjalne populacje
Niewydolność nerek
Janumet
Janumet nie powinien być stosowany u pacjentów z niewydolnością nerek [patrz Przeciwwskazania; Ostrzeżenia i środki].
Sitagliptyna
U pacjentów z umiarkowaną niewydolnością nerek zaobserwowano około 2-krotny wzrost AUC sitagliptyny w osoczu i około 4-krotny wzrost obserwowano u pacjentów z ciężką niewydolnością nerek, w tym u pacjentów z ESRD poddawanych hemodializie, w porównaniu do normalnej zdrowej kontroli przedmioty.
Chlorowodorek metforminy
U pacjentów ze zmniejszoną czynnością nerek (na podstawie zmierzonego klirensu kreatyniny) okres półtrwania w osoczu i krwi metforminy wydłuża się, a klirens nerkowy zmniejsza się proporcjonalnie do zmniejszenia stężenia kreatyniny luz.
Niewydolność wątroby
Sitagliptyna
U pacjentów z umiarkowaną niewydolnością wątroby (punktacja Childa-Pugha od 7 do 9), średnie wartości AUC i Cmax sitagliptyny zwiększyło się odpowiednio o około 21% i 13% w porównaniu ze zdrowymi dobranymi kontrolami po podaniu pojedynczej dawki 100 mg sitagliptyny. Różnice te nie są uważane za istotne klinicznie.
Brak doświadczenia klinicznego u pacjentów z ciężką niewydolnością wątroby (wynik w skali Child-Pugh> 9).
Chlorowodorek metforminy
Nie przeprowadzono badań farmakokinetycznych metforminy u pacjentów z niewydolnością wątroby.
Płeć
Sitagliptyna
Płeć nie miała klinicznie istotnego wpływu na farmakokinetykę sitagliptyny na bazie kompozytu analiza danych farmakokinetycznych fazy I oraz populacyjnej analizy farmakokinetycznej fazy I i fazy II dane.
Chlorowodorek metforminy
Parametry farmakokinetyczne metforminy nie różniły się istotnie między zdrowymi osobami a pacjentami z cukrzycą typu 2, gdy analizowano je według płci. Podobnie w kontrolowanych badaniach klinicznych z udziałem pacjentów z cukrzycą typu 2 działanie przeciwhiperglikemiczne metforminy było porównywalne u mężczyzn i kobiet.
Geriatryczny
Sitagliptyna
Biorąc pod uwagę wpływ wieku na czynność nerek, sam wiek nie miał klinicznie znaczenia znaczący wpływ na farmakokinetykę sitagliptyny na podstawie farmakokinetyki populacyjnej analiza. Osoby w podeszłym wieku (65 do 80 lat) miały około 19% wyższe stężenia sitagliptyny w osoczu w porównaniu do osób młodszych.
Chlorowodorek metforminy
Ograniczone dane z kontrolowanych badań farmakokinetycznych metforminy u zdrowych osób w podeszłym wieku sugerują, że całkowity klirens osoczowy metforminy jest zmniejszony, okres półtrwania jest przedłużony, a Cmax jest zwiększona w porównaniu ze zdrowymi młodymi osobami. Z tych danych wynika, że zmiana farmakokinetyki metforminy wraz ze starzeniem się wynika przede wszystkim ze zmiany czynności nerek (patrz GLUCOPHAGE3 przepisywanie informacji: FARMAKOLOGIA KLINICZNA, Specjalne populacje, Geriatria).
Nie należy rozpoczynać leczenia produktem Janumet u pacjentów w wieku 80 lat, chyba że pomiar klirensu kreatyniny wykazuje, że czynność nerek nie jest zmniejszona [patrz Ostrzeżenia i środki].
Pediatryczny
Nie przeprowadzono badań z produktem Janumet u dzieci.
Wyścigi
Sitagliptyna
Rasa nie miała klinicznie znaczącego wpływu na farmakokinetykę sitagliptyny na podstawie analizy złożonej dostępnych danych farmakokinetycznych, w tym u osób rasy białej, latynoskiej, czarnej, azjatyckiej i innych ras grupy.
Chlorowodorek metforminy
Nie przeprowadzono badań parametrów farmakokinetycznych metforminy w zależności od rasy. W kontrolowanych badaniach klinicznych metforminy u pacjentów z cukrzycą typu 2 działanie przeciwhiperglikemiczne było porównywalne u białych (n = 249), czarnych (n = 51) i latynoskich (n = 24).
Wskaźnik masy ciała (BMI)
Sitagliptyna
Wskaźnik masy ciała nie miał klinicznie znaczącego wpływu na farmakokinetykę sitagliptyny na bazie kompozytu analiza danych farmakokinetycznych fazy I oraz populacyjnej analizy farmakokinetycznej fazy I i fazy II dane.
Interakcje z lekami
Sitagliptyna i chlorowodorek metforminy
Równoczesne podawanie wielu dawek sitagliptyny (50 mg) i metforminy (1000 mg) podawanych dwa razy dziennie nie zmienia znacząco farmakokinetyki sitagliptyny ani metforminy u pacjentów z typem 2 cukrzyca.
Nie przeprowadzono badań farmakokinetycznych interakcji leku Janumet; jednak takie badania przeprowadzono z poszczególnymi składnikami preparatu Janumet (sitagliptyna i chlorowodorek metforminy).
Sitagliptyna
Ocena interakcji leków w warunkach in vitro
Sitagliptyna nie jest inhibitorem izoenzymów CYP CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 lub 2B6 i nie jest induktorem CYP3A4. Sitagliptyna jest substratem glikoproteiny p, ale nie hamuje transportu digoksyny za pośrednictwem glikoproteiny. Na podstawie tych wyników uważa się, że sitagliptyna nie powoduje interakcji z innymi lekami wykorzystującymi te szlaki.
Sitagliptyna nie wiąże się w znacznym stopniu z białkami osocza. Dlatego skłonność sitagliptyny do uczestniczenia w znaczących klinicznie interakcjach między lekami za pośrednictwem wypierania wiązania z białkami osocza jest bardzo niska.
Ocena interakcji leków in vivo
Wpływ sitagliptyny na inne leki
W badaniach klinicznych, jak opisano poniżej, sitagliptyna nie wpływała znacząco na farmakokinetykę metforminy, gliburydu, symwastatyny, rozyglitazonu, warfaryny lub doustnie środki antykoncepcyjne, dające dowody in vivo niskiej skłonności do wywoływania interakcji leków z substratami CYP3A4, CYP2C8, CYP2C9 i organicznym kationowym transporterem (KTZ).
Digoksyna: Sitagliptyna miała minimalny wpływ na farmakokinetykę digoksyny. Po podaniu 0,25 mg digoksyny jednocześnie ze 100 mg sitagliptyny dziennie przez 10 dni, AUC digoksyny w osoczu wzrosło o 11%, a Cmax o 18%.
Sulfonylomoczniki: Farmakokinetyka pojedynczej dawki gliburydu, substratu CYP2C9, nie uległa znaczącej zmianie u pacjentów otrzymujących wielokrotne dawki sitagliptyny. Nie należy oczekiwać znaczących klinicznie interakcji z innymi pochodnymi sulfonylomocznika (np. Glipizyd, tolbutamid i glimepiryd), które podobnie jak gliburyd są eliminowane głównie przez CYP2C9 [patrz Ostrzeżenia i środki].
Symwastatyna: Farmakokinetyka pojedynczej dawki symwastatyny, substratu CYP3A4, nie uległa znaczącej zmianie u pacjentów otrzymujących wielokrotne dawki dobowe sitagliptyny. Dlatego sitagliptyna nie jest inhibitorem metabolizmu za pośrednictwem CYP3A4.
Tiazolidynodiony: Farmakokinetyka rozyglitazonu w pojedynczej dawce nie uległa znaczącym zmianom u pacjentów otrzymujących wielokrotne dzienne dawki sitagliptyny, co wskazuje, że sitagliptyna nie jest inhibitorem pośredniczonym przez CYP2C8 metabolizm.
Warfaryna: Wiele dziennych dawek sitagliptyny nie zmieniało znacząco farmakokinetyki, co oceniono na podstawie pomiaru Enancjomery warfaryny S (-) lub R (+) lub farmakodynamika (oceniana na podstawie pomiaru INR protrombiny) pojedynczej dawki warfaryna. Ponieważ S (-) warfaryna jest metabolizowana głównie przez CYP2C9, dane te potwierdzają również wniosek, że sitagliptyna nie jest inhibitorem CYP2C9.
Doustne środki antykoncepcyjne: Jednoczesne podawanie z sitagliptyną nie zmieniało znacząco farmakokinetyki w stanie stacjonarnym noretyndronu lub etynyloestradiolu.
Wpływ innych leków na sitagliptynę
Dane kliniczne opisane poniżej sugerują, że sitagliptyna nie jest podatna na klinicznie znaczące interakcje podczas jednoczesnego podawania leków.
Cyklosporyna: przeprowadzono badanie w celu oceny wpływu cyklosporyny, silnego inhibitora glikoproteiny p, na farmakokinetykę sitagliptyny. Jednoczesne podawanie pojedynczej dawki doustnej 100 mg sitagliptyny i pojedynczej dawki doustnej 600 mg cyklosporyny zwiększało AUC i Cmax sitagliptyny odpowiednio o około 29% i 68%. Te niewielkie zmiany w farmakokinetyce sitagliptyny nie zostały uznane za klinicznie znaczące. Klirens nerkowy sitagliptyny również nie został znacząco zmieniony. Dlatego nie należy oczekiwać znaczących interakcji z innymi inhibitorami glikoproteiny p.
Chlorowodorek metforminy
[Widzieć Interakcje z lekami]
Top
Toksykologia niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
Janumet
Nie przeprowadzono badań na zwierzętach z połączonymi produktami w Janumet w celu oceny rakotwórczości, mutagenezy lub upośledzenia płodności. Poniższe dane oparte są na wynikach badań z sitagliptyną i metforminą indywidualnie.
Sitagliptyna
Dwuletnie badanie rakotwórczości przeprowadzono na samcach i samicach szczurów, którym podano doustnie dawki sitagliptyny w dawkach 50, 150 i 500 mg / kg / dobę. Zwiększona częstość występowania gruczolaka / raka wątroby u mężczyzn i kobiet oraz raka wątroby u kobiet wynosiła 500 mg / kg. Dawka ta powoduje narażenie w przybliżeniu 60-krotnie większe niż narażenie człowieka przy maksymalnej zalecanej dziennej dawce dla dorosłego człowieka (MRHD) wynoszącej 100 mg / dzień na podstawie porównań AUC. Nowotworów wątroby nie obserwowano przy 150 mg / kg, około 20-krotnej ekspozycji człowieka w MRHD. Dwuletnie badanie rakotwórczości przeprowadzono na myszach płci męskiej i żeńskiej, którym podano doustnie dawki sitagliptyny w ilości 50, 125, 250 i 500 mg / kg / dobę. Nie stwierdzono wzrostu częstości występowania nowotworów w żadnym narządzie do 500 mg / kg, co stanowi około 70-krotną ekspozycję u ludzi w MRHD. Sitagliptyna nie była mutagenna ani klastogenna z aktywacją metaboliczną lub bez aktywacji w teście mutagenności bakteryjnej Amesa, jajnika chomika chińskiego (CHO) test aberracji chromosomowej, test cytogenetyczny in vitro w CHO, test elucji zasadowej hepatocytów DNA in vitro i mikrojądra in vivo analiza.
W badaniach płodności szczurów z doustnymi dawkami zgłębnika 125, 250 i 1000 mg / kg, samce traktowano przez 4 tygodnie przed kryciem, podczas krycia, aż do zaplanowanego zakończenia (łącznie około 8 tygodni), a samice leczono 2 tygodnie przed kryciem przez ciążę dzień 7. Nie zaobserwowano niekorzystnego wpływu na płodność przy dawce 125 mg / kg (około 12-krotna ekspozycja człowieka przy MRHD 100 mg / dzień na podstawie porównań AUC). Przy wyższych dawkach obserwowano związane z niedodawaniem zwiększone resorpcje u kobiet (około 25 i 100 razy większa ekspozycja u ludzi w MRHD na podstawie porównania AUC).
Chlorowodorek metforminy
Długoterminowe badania rakotwórczości przeprowadzono na szczurach (czas dawkowania 104 tygodnie) i myszach (czas dawkowania 91 tygodni) w dawkach do 900 mg / kg włącznie / dobę i 1500 mg / kg / dobę, odpowiednio. Dawki te są około czterokrotnością maksymalnej zalecanej dawki dobowej dla człowieka wynoszącej 2000 mg na podstawie porównań powierzchni ciała. Nie stwierdzono działania rakotwórczego metforminy u myszy płci męskiej i żeńskiej. Podobnie nie zaobserwowano działania rakotwórczego metforminy u samców szczurów. Wystąpiła jednak zwiększona częstość występowania łagodnych polipów zrębu macicy u samic szczurów leczonych 900 mg / kg / dobę.
Nie stwierdzono dowodów na mutagenne działanie metforminy w następujących testach in vitro: test Amesa (S. typhimurium), test mutacji genowych (mysie komórki chłoniaka) lub test aberracji chromosomalnych (ludzkie limfocyty). Wyniki w teście mikrojądrowym myszy in vivo również były ujemne. Metformina nie wpływała na płodność samców ani samic szczurów podawanych w dawkach nawet 600 mg / kg / dobę, co stanowi około trzykrotność maksymalnej zalecanej dziennej dawki dla człowieka w oparciu o powierzchnię ciała porównania.
Top
Studia kliniczne
Jednoczesne podawanie sitagliptyny i metforminy było badane u pacjentów z cukrzycą typu 2, które nie są odpowiednio kontrolowane za pomocą diety i ćwiczeń oraz w połączeniu z glimepirydem.
Nie przeprowadzono badań skuteczności klinicznej produktu Janumet; wykazano jednak biorównoważność preparatu Janumet z jednoczesnym podawaniem sitagliptyny i chlorowodorku metforminy w tabletkach.
Jednoczesne podawanie sitagliptyny i metforminy u pacjentów z cukrzycą typu 2 niedostatecznie kontrolowanymi w diecie i ćwiczeniach
W sumie 2491 pacjentów z cukrzycą typu 2 i niedostateczną kontrolą glikemii w diecie i ćwiczeniach uczestniczyło w 24-tygodniowym randomizowane, podwójnie zaślepione, kontrolowane placebo badanie czynnikowe mające na celu ocenę skuteczności sitagliptyny i metforminy wspólne administrowanie. Pacjenci przyjmujący leki przeciwhiperglikemiczne (N = 541) przeżyli dietę, ćwiczenia i okres wypłukiwania leku do 12 tygodni. Po okresie wypłukiwania pacjenci z niewystarczającą kontrolą glikemii (A1C 7,5% do 11%) zostali zrandomizowani po ukończeniu 2-tygodniowego okresu docierania placebo z pojedynczą ślepą próbą. Pacjenci nieprzyjmujący leków przeciwhiperglikemicznych w momencie włączenia do badania (N = 550) z nieodpowiednią kontrolą glikemii (A1C 7,5% do 11%) natychmiast weszło w 2-tygodniowy okres docierania placebo dla pojedynczej ślepej próby, a następnie tak było losowo. W przybliżeniu jednakowa liczba pacjentów została losowo przydzielona do grupy otrzymującej placebo, 100 mg sitagliptyny raz na dobę, 500 mg lub 1000 mg metforminy dwa razy dziennie lub 50 mg sitagliptyny dwa razy dziennie w połączeniu z 500 mg lub 1000 mg metforminy dwa razy dziennie codziennie. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badania, byli leczeni gliburydem (glibenklamidem).
Jednoczesne podawanie sitagliptyny i metforminy zapewniło znaczącą poprawę w zakresie HbA1c, FPG i 2-godzinnego PPG w porównaniu z placebo, samej metforminy i samej sitagliptyny (Tabela 3, ryc. 1). Średnie zmniejszenie wartości wyjściowej HbA1c było na ogół większe u pacjentów z wyższymi wyjściowymi wartościami HbA1c. W przypadku pacjentów niestosujących leków przeciwhiperglikemicznych w momencie włączenia do badania średnie zmniejszenie w stosunku do wartości początkowej w HbA1c wynosiło: sitagliptyna 100 mg raz na dobę, -1,1%; metformina 500 mg dwa razy dziennie, -1,1%; metformina 1000 mg bid, -1,2%; sitagliptyna 50 mg dwa razy dziennie z metforminą 500 mg dwa razy dziennie, -1,6%; sitagliptyna 50 mg bid z metforminą 1000 mg bid, -1,9%; a dla pacjentów otrzymujących placebo -0,2%. Efekty lipidowe były na ogół neutralne. Spadek masy ciała w grupach otrzymujących sitagliptynę w skojarzeniu z metforminą był podobny jak w grupach otrzymujących samą metforminę lub placebo.
Tabela 3: Parametry glikemiczne podczas wizyty końcowej (badanie 24-tygodniowe) dla sitagliptyny i metforminy, samych oraz w połączeniu z pacjentami z cukrzycą typu 2, niedostatecznie kontrolowaną pod względem diety i ćwiczeń *
Placebo |
Sitagliptyna 100 mg QD |
Metformina 500 mg bid |
Metformina 1000 mg bid |
Sitagliptyna 50 mg bid + Metformina 500 mg bid |
Sitagliptyna 50 mg bid + Metformina 1000 mg bid |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Wartość początkowa (średnia) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Zmiana od wartości początkowej (skorygowana średnia†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Różnica w stosunku do placebo (skorygowana średnia†) (95% CI) |
-0.8do (-1.1, -0.6) |
-1.0do (-1.2, -0.8) |
-1.3do (-1.5, -1.1) |
-1.6do (-1.8, -1.3) |
-2.1do (-2.3, -1.8) |
|
| Pacjenci (%) osiągający HbA1c <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Pacjenci otrzymujący leki ratownicze | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Wartość początkowa (średnia) | 196 | 201 | 205 | 197 | 204 | 197 |
| Zmiana od wartości początkowej (skorygowana średnia†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Różnica w stosunku do placebo (skorygowana średnia†) (95% CI) |
-23do (-33, -14) |
-33do (-43, -24) |
-35do (-45, -26) |
-53do (-62, -43) |
-70do (-79, -60) |
|
| 2-godzinny PPG (mg / dl) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Wartość początkowa (średnia) | 277 | 285 | 293 | 283 | 292 | 287 |
| Zmiana od wartości początkowej (skorygowana średnia†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Różnica w stosunku do placebo (skorygowana średnia†) (95% CI) |
-52do (-67, -37) |
-54do (-69, -39) |
-78do (-93, -63) |
-93do (-107, -78) |
-117do (-131, -102) |
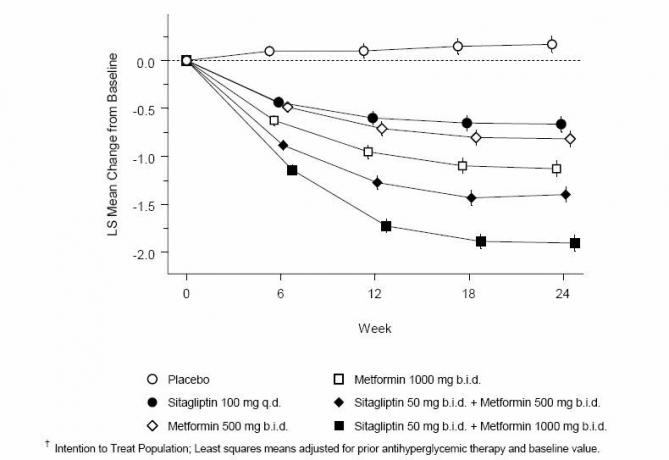
Rycina 1: Średnia zmiana w stosunku do wartości wyjściowej dla HbA1c (%) w ciągu 24 tygodni w przypadku samego sitagliptyny i metforminy oraz w połączeniu z pacjentami z cukrzycą typu 2 nieodpowiednio kontrolowaną za pomocą diety i ćwiczeń fizycznych
Ponadto w badaniu tym uczestniczyli pacjenci (N = 117) z cięższą hiperglikemią (HbA1c> 11% lub krew) glukoza> 280 mg / dl), którzy byli leczeni sitagliptyną dwa razy dziennie 50 mg i metforminą 1000 mg W tej grupie pacjentów średnia wyjściowa wartość HbA1c wynosiła 11,2%, średnia wartość FPG wynosiła 314 mg / dl, a średnia 2-godzinna PPG wynosiła 441 mg / dl. Po 24 tygodniach zaobserwowano średnie zmniejszenie w stosunku do wartości wyjściowej o -2,9% dla HbA1c, -127 mg / dl dla FPG i -208 mg / dL dla 2-godzinnego PPG.
Początkowa terapia skojarzona lub kontynuacja terapii skojarzonej powinna być zindywidualizowana i pozostawiona w gestii lekarza.
Terapia dodatkowa sitagliptyną u pacjentów z cukrzycą typu 2 niewystarczająco kontrolowanych w monoterapii metforminą
W sumie 701 pacjentów z cukrzycą typu 2 uczestniczyło w 24-tygodniowym, randomizowanym, podwójnie zaślepionym badaniu kontrolowanym placebo, mającym na celu ocenę skuteczności sitagliptyny w skojarzeniu z metforminą. Pacjenci, którzy otrzymywali już metforminę (N = 431) w dawce co najmniej 1500 mg na dobę, zostali zrandomizowani po ukończeniu 2-tygodniowego, trwającego pojedynczo ślepej próby placebo. Pacjenci przyjmujący metforminę i inny lek przeciwhiperglikemiczny (N = 229) oraz pacjenci nieprzyjmujący żadnych leków przeciwhiperglikemicznych (poza terapią przez co najmniej 8 tygodni, N = 41) zrandomizowano po okresie wstępnym wynoszącym około 10 tygodni na metforminę (w dawce co najmniej 1500 mg na dobę) w monoterapia. Pacjentów losowo przydzielono do grupy otrzymującej 100 mg sitagliptyny lub placebo, podawanych raz dziennie. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badań, byli leczeni pioglitazonem ratunkowym.
W połączeniu z metforminą sitagliptyna zapewniała znaczną poprawę w zakresie A1C, FPG i 2-godzinnego PPG w porównaniu z placebo z metforminą (Tabela 4). Terapię glikemią ratunkową zastosowano u 5% pacjentów leczonych sitagliptyną w dawce 100 mg i 14% pacjentów otrzymujących placebo. Podobny spadek masy ciała zaobserwowano w obu grupach leczenia.
Tabela 4: Parametry glikemiczne podczas ostatniej wizyty (badanie 24-tygodniowe) sitagliptyny w terapii skojarzonej z metforminą *
| Sitagliptyna 100 mg raz na dobę + Metformina |
Placebo + Metformina |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Wartość początkowa (średnia) | 8.0 | 8.0 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -0.7 | -0.0 |
| Różnica w stosunku do placebo + metforminy (skorygowana średnia†) (95% CI) |
-0.7do (-0.8, -0.5) |
|
| Pacjenci (%) osiągający HbA1c <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Wartość początkowa (średnia) | 170 | 174 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -17 | 9 |
| Różnica w stosunku do placebo + metforminy (skorygowana średnia†) (95% CI) |
-25do (-31, -20) |
|
| 2-godzinny PPG (mg / dl) | N = 387 | N = 182 |
| Wartość początkowa (średnia) | 275 | 272 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -62 | -11 |
| Różnica w stosunku do placebo + metforminy (skorygowana średnia†) (95% CI) |
-51do (-61, -41) |
Terapia dodatkowa sitagliptyną u pacjentów z cukrzycą typu 2 nieodpowiednio kontrolowaną w skojarzeniu z metforminą i glimepirydem
W sumie 441 pacjentów z cukrzycą typu 2 uczestniczyło w 24-tygodniowym, randomizowanym badaniu z podwójnie ślepą próbą, badanie kontrolowane placebo mające na celu ocenę skuteczności sitagliptyny w skojarzeniu z glimepirydem z lub bez metforminy. Pacjenci weszli w okres docierania samego glimepirydu (4 mg dziennie) w monoterapii lub glimepirydu w skojarzeniu z metforminą (1500 mg dziennie). Po dostosowaniu dawki i stabilnym okresie docierania do 16 tygodni i 2 tygodniowym docieraniu placebo pacjenci z nieodpowiednimi kontrola glikemii (A1C 7,5% do 10,5%) losowo przydzielono do dodatku 100 mg sitagliptyny lub placebo, podawanych jeden raz codziennie. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badań, byli leczeni pioglitazonem ratunkowym.
U pacjentów otrzymujących sitagliptynę z metforminą i glimepirydem stwierdzono istotną poprawę A1C i FPG w porównaniu do pacjentów otrzymujących placebo z metforminą i glimepirydem (Tabela 5), ze średnim zmniejszeniem w stosunku do wartości wyjściowej w stosunku do placebo w HbA1c o -0,9% i w FPG o -21 mg / dl. Terapię ratunkową zastosowano u 8% pacjentów leczonych sitagliptyną w dawce 100 mg i 29% pacjentów leczonych dodatkowym placebo. U pacjentów leczonych dodatkowym sitagliptyną średni wzrost masy ciała wyniósł 1,1 kg w porównaniu do dodatkowe placebo (+0,4 kg vs. -0,7 kg). Ponadto dodanie sitagliptyny spowodowało zwiększenie częstości hipoglikemii w porównaniu z dodatkowym placebo. [Widzieć Ostrzeżenia i środki; Działania niepożądane.]
Tabela 5: Parametry glikemiczne podczas ostatniej wizyty (badanie 24-tygodniowe) dla sitagliptyny w połączeniu z metforminą i glimepirydem *
| Sitagliptyna 100 mg + Metformina i glimepiryd |
Placebo + Metformina i glimepiryd |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Wartość początkowa (średnia) | 8.3 | 8.3 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -0.6 | 0.3 |
| Różnica w stosunku do placebo (skorygowana średnia†) (95% CI) | -0.9do (-1.1, -0.7) |
|
| Pacjenci (%) osiągający HbA1c <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Wartość początkowa (średnia) | 179 | 179 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -8 | 13 |
| Różnica w stosunku do placebo (skorygowana średnia†) (95% CI) | -21do (-32, -10) |
Sitagliptyna terapia dodatkowa vs. Terapia dodatkowa glipizydem u pacjentów z cukrzycą typu 2 nieodpowiednio kontrolowaną za pomocą metforminy
Skuteczność sitagliptyny oceniano w 52-tygodniowym, podwójnie ślepym, kontrolowanym glipizydem badaniu nieszerokości u pacjentów z cukrzycą typu 2. Pacjenci niestosujący leczenia lub przyjmujący inne leki przeciwhiperglikemiczne weszli w okres leczenia trwający do 12 tygodni w monoterapii metforminą (dawka 1500 mg na dobę), która obejmowała wypłukiwanie leków innych niż metformina, jeśli odpowiedni. Po okresie docierania osoby z niedostateczną kontrolą glikemii (A1C 6,5% do 10%) randomizowano 1: 1 do dodania 100 mg sitagliptyny raz na dobę lub glipizydu przez 52 tygodnie. Pacjentom otrzymującym glipizyd podawano początkową dawkę 5 mg / dobę, a następnie stopniowo zwiększano ją przez kolejne 18 tygodni do maksymalnej dawki 20 mg / dobę w razie potrzeby w celu optymalizacji kontroli glikemii. Następnie dawkę glipizydu należy utrzymywać na stałym poziomie, z wyjątkiem zmniejszania dawki w celu zapobiegania hipoglikemii. Średnia dawka glipizydu po okresie miareczkowania wynosiła 10 mg.
Po 52 tygodniach sitagliptyna i glipizyd wykazywały podobne średnie zmniejszenie w stosunku do wartości wyjściowej stężenia HbA1c w analizie zgodnej z leczeniem (Tabela 6). Wyniki te były zgodne z analizą według protokołu (ryc. 2). Wniosek na korzyść nie mniejszej jakości sitagliptyny od glipizydu może być ograniczony do pacjentów z początkiem HbA1c porównywalne do tych uwzględnionych w badaniu (ponad 70% pacjentów miało wyjściową HbA1c <8%, a ponad 90% miało HbA1c <9%).
Tabela 6: Parametry glikemiczne w 52-tygodniowym badaniu porównującym sitagliptynę z glipizydem jako terapię dodatkową u pacjentów niedostatecznie kontrolowanych za pomocą metforminy (populacja zgodna z leczeniem) *
| Sitagliptyna 100 mg + Metformina |
Glipizyd + Metformina |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Wartość początkowa (średnia) | 7.7 | 7.6 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Wartość początkowa (średnia) | 166 | 164 |
| Zmiana od wartości początkowej (skorygowana średnia†) | -8 | -8 |
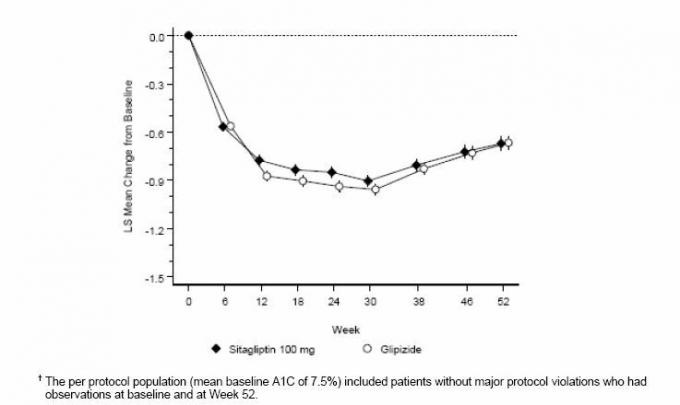
Rycina 2: Średnia zmiana w stosunku do wartości wyjściowej dla HbA1c (%) w ciągu 52 tygodni w badaniu porównującym sitagliptynę z Glipizyd jako terapia dodatkowa u pacjentów niedostatecznie kontrolowanych za pomocą metforminy (populacja według protokołu) â€
Częstość występowania hipoglikemii w grupie sitagliptyny (4,9%) była znacząco (p <0,001) niższa niż w grupie glipizydu (32,0%). Pacjenci leczeni sitagliptyną wykazywali znaczący średni spadek masy ciała w stosunku do wartości wyjściowej w porównaniu do znacznego przyrostu masy ciała u pacjentów otrzymujących glipizyd (-1,5 kg vs. +1,1 kg).
Top
Jak dostarczone
Nr 6747 - Tabletki Janumet, 50 mg / 500 mg, są jasnoróżowymi tabletkami powlekanymi w kształcie kapsułki z wytłoczonym napisem „575” po jednej stronie. Są dostarczane w następujący sposób:
NDC 0006-0575-61 butelki jednorazowe o pojemności 60 sztuk
NDC 0006-0575-62 butelki o pojemności 180 sztuk
NDC 0006-0575-52 blistrowe dawki jednostkowe po 50
NDC 0006-0575-82 butelki zbiorcze o pojemności 1000 sztuk.
Nr 6749 - Tabletki Janumet, 50 mg / 1000 mg, to czerwone tabletki powlekane w kształcie kapsułki z wytłoczonym napisem „577” po jednej stronie. Są dostarczane w następujący sposób:
NDC 0006-0577-61 butelki jednorazowe o pojemności 60 sztuk
NDC 0006-0577-62 butelki o pojemności 180 sztuk
NDC 0006-0577-52 blistrowe dawki jednostkowe po 50
NDC 0006-0577-82 butelki zbiorcze o pojemności 1000 sztuk.
Przechowywać w temperaturze 20–25 ° C (68–77 ° F), dozwolone wycieczki do 15–30 ° C (59–86 ° F).
Top
Informacje dotyczące poradnictwa dla pacjenta
Instrukcje
Pacjentów należy poinformować o potencjalnym ryzyku i korzyściach związanych ze stosowaniem leku Janumet oraz o alternatywnych sposobach leczenia. Powinny być również informowane o znaczeniu przestrzegania instrukcji dietetycznych, regularnej aktywności fizycznej, okresowej krwi monitorowanie poziomu glukozy i oznaczanie HbA1c, rozpoznawanie i zarządzanie hipoglikemią i hiperglikemią oraz ocena cukrzycy powikłania W okresach stresu, takich jak gorączka, uraz, infekcja lub zabieg chirurgiczny, wymagania dotyczące leków mogą ulec zmianie i należy zalecić pacjentom niezwłoczne zasięgnięcie porady lekarskiej.
Ryzyko kwasicy mleczanowej spowodowane składnikiem metforminy, jej objawami i stanami predysponującymi do jego rozwoju, jak zauważono w Ostrzeżenia i środkinależy wyjaśnić pacjentom. Pacjentom należy zalecić niezwłoczne zaprzestanie stosowania leku Janumet i niezwłoczne powiadomienie lekarza, jeśli wystąpi niewyjaśniona hiperwentylacja, bóle mięśni, złe samopoczucie, niezwykła senność, zawroty głowy, wolne lub nieregularne bicie serca, uczucie zimna (szczególnie w kończynach) lub inne niespecyficzne objawy pojawić się. Objawy żołądkowo-jelitowe są częste na początku leczenia metforminą i mogą wystąpić na początku leczenia produktem Janumet; jednak pacjenci powinni skonsultować się z lekarzem, jeśli wystąpią niewyjaśnione objawy. Chociaż objawy żołądkowo-jelitowe występujące po stabilizacji prawdopodobnie nie są związane z lekami, takie jak występowanie objawów należy ocenić, aby ustalić, czy może to być spowodowane kwasicą mleczanową lub inną poważną chorobą choroba.
Podczas przyjmowania leku Janumet należy odradzać pacjentom nadmierne spożywanie alkoholu, ostre lub przewlekłe.
Pacjentów należy poinformować o znaczeniu regularnych badań czynności nerek i parametrów hematologicznych podczas leczenia produktem Janumet.
Pacjentów należy poinformować, że zgłaszano reakcje alergiczne podczas stosowania sitagliptyny, jednego ze składników preparatu Janumet po wprowadzeniu do obrotu. Jeśli objawy reakcji alergicznych (w tym wysypka, pokrzywka i obrzęk twarzy, warg, języka i gardła, które mogą powodować trudności w oddychaniu lub przełykaniu), pacjenci muszą przerwać stosowanie leku Janumet i zasięgnąć porady lekarza natychmiast.
Lekarze powinni poinstruować swoich pacjentów, aby przed rozpoczęciem leczenia lekiem Janumet przeczytali ulotkę dla pacjenta i ponownie przeczytali po każdym odnowieniu recepty. Należy pouczyć pacjentów, aby poinformowali lekarza lub farmaceutę, jeśli wystąpią jakiekolwiek nietypowe objawy lub jeśli jakikolwiek znany objaw utrzymuje się lub nasila się.
Testy laboratoryjne
Odpowiedź na wszystkie terapie cukrzycowe należy monitorować za pomocą okresowych pomiarów poziomu glukozy we krwi i stężenia HbA1c w celu obniżenia tych poziomów do normalnego zakresu. A1C jest szczególnie przydatny do oceny długoterminowej kontroli glikemii.
Wstępne i okresowe monitorowanie parametrów hematologicznych (np. Hemoglobiny / hematokrytu i czerwonej krwi wskaźniki komórkowe) i czynność nerek (stężenie kreatyniny w surowicy) należy wykonywać przynajmniej raz w roku. Chociaż podczas leczenia metforminą rzadko obserwowano niedokrwistość megaloblastyczną, jeśli podejrzewa się, należy wykluczyć niedobór witaminy B12.
Dystrybuowane przez:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
9794108
Patent USA nr: 6,699,871
1 Zarejestrowany znak towarowy MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
2 Znak towarowy MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
3GLUCOPHAGE® jest zastrzeżonym znakiem towarowym Merck Sante S.A.S, spółki stowarzyszonej Merck KGaA z Darmstadt, Niemcy.
Licencjonowane przez Bristol-Myers Squibb Company.
PRAWA AUTORSKIE © 2007, 2008 MERCK & CO., Inc.
Wszelkie prawa zastrzeżone
Zatwierdzone przez FDA etykietowanie pacjentów
Informacja o pacjencie
Janumet® (JAN-you-met)
(sitagliptyna / metformina HCl)
Tabletki
Przeczytaj Informacje dla pacjenta, które są dołączone do Janumet1, zanim zaczniesz je przyjmować i za każdym razem, gdy otrzymasz uzupełnienie. Mogą być nowe informacje. Ta ulotka nie zastępuje rozmowy z lekarzem na temat twojego stanu zdrowia lub leczenia.
Jakie są najważniejsze informacje, które powinienem wiedzieć o Janumet?
Chlorowodorek metforminy, jeden ze składników leku Janumet, może powodować rzadkie, ale poważne działanie niepożądane zwane kwasicą mleczanową (nagromadzenie kwasu mlekowego we krwi), które może powodować śmierć. Kwasica mleczanowa jest nagłym przypadkiem medycznym i musi być leczona w szpitalu.
Należy przerwać stosowanie leku Janumet i natychmiast skontaktować się z lekarzem, jeśli wystąpi którykolwiek z następujących objawów kwasicy mleczanowej:
- Czujesz się bardzo słaby i zmęczony.
- Masz niezwykły (nie normalny) ból mięśni.
- Masz problemy z oddychaniem
- Masz niewyjaśnione problemy żołądkowe lub jelitowe z nudnościami i wymiotami lub biegunką.
- Jest ci zimno, szczególnie w rękach i nogach.
- Zawroty głowy lub oszołomienie.
- Masz wolne lub nieregularne bicie serca.
Masz większą szansę na kwasicę mleczanową, jeśli:
- masz problemy z nerkami
- masz problemy z wątrobą
- masz zastoinową niewydolność serca, która wymaga leczenia lekami.
- pić dużo alkoholu (bardzo często lub krótkotrwałe „upijanie się”).
- odwodnić się (stracić dużą ilość płynów ustrojowych). Może się to zdarzyć, jeśli masz gorączkę, wymioty lub biegunkę. Odwodnienie może również wystąpić, gdy dużo się pocisz podczas ćwiczeń lub ćwiczeń i nie pijesz wystarczającej ilości płynów.
- mieć określone testy rentgenowskie z barwnikami do wstrzykiwania lub środkami kontrastowymi.
- mieć operację.
- mieć atak serca, ciężką infekcję lub udar mózgu.
- ma 80 lat lub więcej i nie badano czynności nerek.
Co to jest Janumet?
Tabletki Janumet zawierają dwa leki na receptę, sitagliptynę (JANUVIA ™ 2) i metforminę. Janumet może być stosowany wraz z dietą i ćwiczeniami w celu obniżenia poziomu cukru we krwi u dorosłych pacjentów z cukrzycą typu 2. Lekarz ustali, czy Janumet jest dla Ciebie odpowiedni i określi najlepszy sposób rozpoczęcia i dalszego leczenia cukrzycy.
Janumet:
- pomaga poprawić poziom insuliny po posiłku.
- pomaga organizmowi lepiej reagować na naturalnie wytwarzaną insulinę.
- zmniejsza ilość cukru wytwarzanego przez organizm.
- jest mało prawdopodobne, aby powodował niski poziom cukru we krwi (hipoglikemię), gdy jest stosowany samodzielnie w leczeniu wysokiego poziomu cukru we krwi.
Janumet nie był badany u dzieci w wieku poniżej 18 lat.
Janumet nie był badany z insuliną, lekiem powodującym niski poziom cukru we krwi.
Kto nie powinien brać Janumet?
Nie bierz Janumet, jeśli:
- masz cukrzycę typu 1.
- masz pewne problemy z nerkami.
- występują choroby zwane kwasicą metaboliczną lub kwasicą ketonową cukrzycową (zwiększone stężenie ketonów we krwi lub moczu).
- u pacjenta wystąpiła reakcja alergiczna na Janumet lub sitagliptynę (JANUVIA), jeden ze składników leku Janumet.
- zamierzają otrzymać zastrzyk barwnika lub środka kontrastowego w celu prześwietlenia, Janumet będzie musiał zostać zatrzymany na krótki czas. Porozmawiaj ze swoim lekarzem o tym, kiedy przestać Janumet i kiedy zacząć od nowa. Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o Janumet?”
Co powinienem powiedzieć lekarzowi przed i podczas leczenia lekiem Janumet?
Janumet może nie być dla Ciebie odpowiedni. Poinformuj swojego lekarza o wszystkich stanach chorobowych, w tym jeśli:
- masz problemy z nerkami
- masz problemy z wątrobą
- u pacjenta wystąpiła reakcja alergiczna na Janumet lub sitagliptynę (JANUVIA), jeden ze składników leku Janumet.
- występują problemy z sercem, w tym zastoinowa niewydolność serca.
- są starsze niż 80 lat. Pacjenci w wieku powyżej 80 lat nie powinni przyjmować leku Janumet, chyba że sprawność nerek jest sprawdzona i jest to normalne.
- pij dużo alkoholu (przez cały czas lub krótkotrwałe „upijanie się”).
- jesteś w ciąży lub planujesz zajść w ciążę. Nie wiadomo, czy Janumet zaszkodzi nienarodzonemu dziecku. Jeśli jesteś w ciąży, porozmawiaj ze swoim lekarzem o najlepszym sposobie kontrolowania poziomu cukru we krwi podczas ciąży. Jeśli używasz Janumet podczas ciąży, porozmawiaj ze swoim lekarzem o tym, jak możesz być w rejestrze Janumet. Bezpłatny numer telefonu do rejestru ciąż to 1-800-986-8999.
- karmi piersią lub planuje karmić piersią. Nie wiadomo, czy Janumet przenika do mleka matki. Porozmawiaj z lekarzem na temat najlepszego sposobu karmienia dziecka, jeśli pacjent przyjmuje Janumet.
Poinformuj swojego lekarza o wszystkich przyjmowanych lekach, w tym lekach na receptę i bez recepty, witaminach i suplementach ziołowych. Janumet może wpływać na działanie innych leków, a niektóre leki mogą wpływać na działanie leku Janumet.
Poznaj przyjmowane leki. Zachowaj listę swoich leków i pokaż ją lekarzowi i farmaceucie po otrzymaniu nowego leku. Przed rozpoczęciem przyjmowania jakiegokolwiek nowego leku należy porozmawiać z lekarzem.
Jak powinienem przyjmować Janumet?
- Lekarz poinformuje, ile tabletek Janumet należy zażywać i jak często należy je przyjmować. Lek Janumet należy stosować zgodnie z zaleceniami lekarza.
- Lekarz może zwiększyć dawkę, aby kontrolować poziom cukru we krwi.
- Lekarz może przepisać Janumet wraz z pochodną sulfonylomocznika (inny lek obniżający poziom cukru we krwi). Zobacz „Jakie są możliwe działania niepożądane leku Janumet?” w celu uzyskania informacji o zwiększonym ryzyku niskiego poziomu cukru we krwi.
- Zażywaj Janumet z posiłkami, aby zmniejszyć ryzyko wystąpienia rozstroju żołądka.
- Kontynuuj przyjmowanie leku Janumet tak długo, jak to zalecił lekarz.
- W przypadku przyjęcia zbyt dużej dawki leku Janumet należy natychmiast skontaktować się z lekarzem lub centrum kontroli zatruć.
- W przypadku pominięcia dawki, należy przyjąć ją z jedzeniem, gdy tylko sobie o tym przypomni. Jeśli nie pamiętasz, aż nadejdzie czas na następną dawkę, pomiń pominiętą dawkę i wróć do regularnego harmonogramu. Nie należy przyjmować dwóch dawek Janumet jednocześnie.
- Może być konieczne przerwanie przyjmowania leku Janumet na krótki czas. Zadzwoń do lekarza po instrukcje, jeśli:
- są odwodnione (utraciły zbyt dużo płynów ustrojowych). Odwodnienie może wystąpić, jeśli jesteś chory z ciężkimi wymiotami, biegunką lub gorączką, lub jeśli pijesz znacznie mniej płynów niż zwykle.
- planować operację.
- zamierzają otrzymać zastrzyk barwnika lub środka kontrastowego do procedury rentgenowskiej.
Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o Janumet?” i „Kto nie powinien brać Janumet?”
- Kiedy twoje ciało jest poddawane niektórym rodzajom stresu, takim jak gorączka, uraz (np. Wypadek samochodowy), infekcja lub operacja, ilość potrzebnego leku na cukrzycę może się zmienić. Należy natychmiast powiedzieć lekarzowi, jeśli wystąpi którykolwiek z tych stanów i postępować zgodnie z instrukcjami lekarza.
- Monitoruj poziom cukru we krwi zgodnie z zaleceniami lekarza.
- Podczas przyjmowania leku Janumet przestrzegaj zalecanej diety i programu ćwiczeń.
- Porozmawiaj z lekarzem na temat zapobiegania, rozpoznawania i leczenia niskiego poziomu cukru we krwi (hipoglikemii), wysokiego poziomu cukru we krwi (hiperglikemii) i powikłań cukrzycy.
- Lekarz będzie monitorował Twoją cukrzycę za pomocą regularnych badań krwi, w tym poziomu cukru we krwi i poziomu hemoglobiny A1C.
- Lekarz wykona badania krwi w celu sprawdzenia czynności nerek przed i podczas leczenia lekiem Janumet.
Jakie są możliwe skutki uboczne Janumet?
Janumet może powodować poważne działania niepożądane. Zobacz „Jakie są najważniejsze informacje, które powinienem wiedzieć o Janumet?”
Częste działania niepożądane podczas przyjmowania leku Janumet obejmują:
- zatkany nos lub katar i ból gardła
- zakażenie górnych dróg oddechowych
- biegunka
- nudności i wymioty
- gaz, dyskomfort w żołądku, niestrawność
- słabość
- bół głowy
Przyjmowanie Janumet z posiłkami może pomóc zmniejszyć częste działania niepożądane metforminy w żołądku, które zwykle występują na początku leczenia. Jeśli masz nietypowe lub nieoczekiwane problemy żołądkowe, porozmawiaj ze swoim lekarzem. Problemy żołądkowe, które pojawiają się później podczas leczenia, mogą być oznaką poważniejszego problemu.
Niektóre leki przeciwcukrzycowe, takie jak sulfonylomoczniki i meglitinidy, mogą powodować niski poziom cukru we krwi (hipoglikemia). Podczas stosowania leku Janumet z tymi lekami może wystąpić zbyt niski poziom cukru we krwi. Lekarz może przepisać niższe dawki leku pochodnego sulfonylomocznika lub meglitinidu. Poinformuj swojego lekarza, jeśli masz problemy z niskim poziomem cukru we krwi.
Zgłaszano następujące dodatkowe działania niepożądane podczas ogólnego stosowania z produktem Janumet lub sitagliptyną:
- Poważne reakcje alergiczne mogą wystąpić podczas stosowania leku Janumet lub sitagliptyny, jednego z leków leku Janumet. Objawy poważnej reakcji alergicznej mogą obejmować wysypkę, pokrzywkę i obrzęk twarzy, warg, języka i gardła, trudności w oddychaniu lub połykaniu. W przypadku wystąpienia reakcji alergicznej należy przerwać stosowanie leku Janumet i natychmiast skontaktować się z lekarzem. Lekarz może przepisać leki stosowane w leczeniu reakcji alergicznej i inne leki stosowane w leczeniu cukrzycy.
- Podwyższone enzymy wątrobowe.
- Zapalenie trzustki
To nie wszystkie możliwe skutki uboczne Janumet. Aby uzyskać więcej informacji, zapytaj lekarza.
Należy poinformować lekarza, jeśli u pacjenta występują jakiekolwiek działania niepożądane, które niepokoją, są niezwykłe lub nie ustępują.
Jak przechowywać Janumet?
Janumet należy przechowywać w temperaturze pokojowej, 20–25 ° C (68–77 ° F).
Trzymaj Janumet i wszystkie leki w miejscu niedostępnym dla dzieci.
Ogólne informacje na temat korzystania z Janumet
Leki są czasami przepisywane na dolegliwości, które nie są wymienione w ulotkach dla pacjentów. Nie używaj Janumet w przypadku stanu, w którym nie został przepisany. Nie podawaj Janumet innym osobom, nawet jeśli mają te same objawy, co ty. Może im to zaszkodzić.
Niniejsza ulotka podsumowuje najważniejsze informacje o firmie Janumet. Jeśli chcesz uzyskać więcej informacji, porozmawiaj ze swoim lekarzem. Możesz poprosić lekarza lub farmaceutę o informacje na temat leku Janumet, które zostały napisane dla pracowników służby zdrowia. Aby uzyskać więcej informacji, zadzwoń pod numer 1-800-622-4477.
Jakie są składniki Janumet?
Składniki aktywne: sitagliptyna i chlorowodorek metforminy.
Składniki nieaktywne: celuloza mikrokrystaliczna, poliwinylopirolidon, laurylosiarczan sodu i stearylofumaran sodu. Otoczka tabletki zawiera następujące nieaktywne składniki: alkohol poliwinylowy, glikol polietylenowy, talk, dwutlenek tytanu, czerwony tlenek żelaza i czarny tlenek żelaza.
Co to jest cukrzyca typu 2?
Cukrzyca typu 2 jest chorobą, w której organizm nie wytwarza wystarczającej ilości insuliny, a wytwarzana przez nią insulina nie działa tak dobrze, jak powinna. Twoje ciało może również wytwarzać zbyt dużo cukru. Kiedy tak się dzieje, cukier (glukoza) gromadzi się we krwi. Może to prowadzić do poważnych problemów medycznych.
Głównym celem leczenia cukrzycy jest obniżenie poziomu cukru we krwi do normalnego poziomu. Obniżenie i kontrolowanie poziomu cukru we krwi może pomóc w zapobieganiu lub opóźnianiu powikłań cukrzycy, takich jak problemy z sercem, problemy z nerkami, ślepota i amputacja.
Wysoki poziom cukru we krwi można obniżyć poprzez dietę i ćwiczenia, a także, w razie potrzeby, niektóre leki.
Wydano w marcu 2009 r
Dystrybuowane przez:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
Ostatnia aktualizacja: 03/09
Janumet, Sitagliptyna i chlorowodorek metforminy, informacje dla pacjentów (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę


