Byetta na leczenie cukrzycy
Nazwa marki: Byetta
Nazwa ogólna: eksenatyd
Postać dawkowania: zastrzyk
Zawartość:
Opis
Farmakologia kliniczna
Studia kliniczne
Wskazania i zastosowanie
Przeciwwskazania
Środki ostrożności
Działania niepożądane
Przedawkowanie
Dawkowanie i sposób podawania
Przechowywanie
Jak dostarczone
Byetta (Exenatide) Informacje dla pacjenta (w prostym angielskim)
Opis
Byetta® (eksenatyd) jest syntetycznym peptydem, który ma działanie naśladujące inkretynę i został pierwotnie zidentyfikowany w jaszczurce Heloderma suspectum. Byetta zwiększa zależne od glukozy wydzielanie insuliny przez komórki beta trzustki, hamuje niewłaściwie podwyższone wydzielanie glukagonu i spowalnia opróżnianie żołądka. Eksenatyd różni się budową chemiczną i działaniem farmakologicznym od insuliny, pochodnych sulfonylomocznika (w tym Pochodne D-fenyloalaniny i meglitinidy), biguanidy, tiazolidynodiony i alfa-glukozydaza inhibitory.
Eksenatyd to amid kwasu peptydowego z 39-aminokwasami. Eksenatyd ma wzór empiryczny C.184H.282N.50O60S i masa cząsteczkowa 4186,6 daltonów. Sekwencję aminokwasów eksenatydu pokazano poniżej.
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Produkt Byetta jest dostarczany do wstrzykiwań podskórnych (SC) jako sterylny, zakonserwowany roztwór izotoniczny w szklanym wkładzie, który został zamontowany we wstrzykiwaczu (wstrzykiwaczu). Każdy mililitr (ml) zawiera 250 mikrogramów (mcg) syntetycznego eksenatydu, 2,2 mg metakrezolu jako przeciwbakteryjnego środka konserwującego, mannitol jako środek regulujący toniczność oraz lodowaty kwas octowy i trihydrat octanu sodu w wodzie do wstrzykiwań jako roztwór buforujący o pH 4,5. Dostępne są dwa fabrycznie napełnione wstrzykiwacze do podawania dawek jednostkowych 5 mcg lub 10 mcg. Każdy fabrycznie napełniony wstrzykiwacz dostarczy 60 dawek, aby zapewnić 30 dni podawania dwa razy dziennie (BID).
Top
Farmakologia kliniczna
Mechanizm akcji
Inkretyny, takie jak glukagonopodobny peptyd-1 (GLP-1), zwiększają zależne od glukozy wydzielanie insuliny i wykazują inne działania przeciwhiperglikemiczne po ich uwolnieniu do krążenia z jelit. Eksenatyd jest inkretynowym środkiem naśladującym, który naśladuje zwiększenie zależnego od glukozy wydzielania insuliny i kilku innych przeciwreperglikemicznych działań inkretyn.
Sekwencja aminokwasowa eksenatydu częściowo pokrywa się z sekwencją ludzkiego GLP-1. Wykazano, że eksenatyd wiąże się i aktywuje znany ludzki receptor GLP-1 in vitro. Prowadzi to do wzrostu zarówno zależnej od glukozy syntezy insuliny, jak i wydzielania insuliny in vivo z trzustkowych komórek beta, za pomocą mechanizmów obejmujących cykliczne AMP i / lub inne sygnały wewnątrzkomórkowe ścieżki. Eksenatyd promuje uwalnianie insuliny z komórek beta w obecności podwyższonego stężenia glukozy. Po podaniu in vivo eksenatyd naśladuje pewne przeciwhiperglikemiczne działania GLP-1.
Byetta poprawia kontrolę glikemii poprzez zmniejszenie stężenia glukozy na czczo i po posiłku u pacjentów z cukrzycą typu 2 poprzez działania opisane poniżej.
Zależne od glukozy wydzielanie insuliny: Byetta ma ostry wpływ na odpowiedź komórek beta trzustki na glukozę i prowadzi do uwalniania insuliny tylko przy podwyższonym stężeniu glukozy. To wydzielanie insuliny zmniejsza się wraz ze spadkiem stężenia glukozy we krwi i zbliżaniem się do euglikemii.
Odpowiedź insulinowa pierwszego etapu: u zdrowych osób silne wydzielanie insuliny występuje w ciągu pierwszych 10 minut po dożylnym (IV) podaniu glukozy. To wydzielanie, znane jako „reakcja insulinowa w pierwszej fazie”, jest charakterystycznie nieobecne u pacjentów z cukrzycą typu 2. Utrata odpowiedzi insulinowej w pierwszej fazie jest wczesną wadą komórek beta w cukrzycy typu 2. Podawanie produktu leczniczego Byetta w stężeniach terapeutycznych w osoczu przywróciło odpowiedź pierwszego etapu na bolus glukozy dożylnie u pacjentów z cukrzycą typu 2 (ryc. 1). Zarówno wydzielanie insuliny w pierwszej fazie, jak i wydzielanie insuliny w drugiej fazie były znacznie zwiększone u pacjentów z cukrzycą typu 2 leczonych produktem Byetta w porównaniu z solą fizjologiczną (p

Rycina 1: Średnia (+ SEM) szybkość wydzielania insuliny podczas infuzji produktu leczniczego Byetta lub soli fizjologicznej u pacjentów z cukrzycą typu 2 i podczas infuzji soli fizjologicznej u zdrowych osób
Wydzielanie glukagonu: u pacjentów z cukrzycą typu 2 lek Byetta łagodzi wydzielanie glukagonu i obniża stężenie glukagonu w surowicy w okresach hiperglikemii. Niższe stężenia glukagonu prowadzą do zmniejszenia produkcji glukozy w wątrobie i zmniejszenia zapotrzebowania na insulinę. Jednak Byetta nie zaburza prawidłowej odpowiedzi glukagonu na hipoglikemię.
Opróżnianie żołądka: Byetta spowalnia opróżnianie żołądka, zmniejszając w ten sposób szybkość, z jaką glukoza pochodząca z posiłku pojawia się w krążeniu.
Spożycie pokarmu: Wykazano, że zarówno u zwierząt, jak i ludzi podawanie eksenatydu zmniejsza spożycie pokarmu.
Farmakokinetyka
Wchłanianie
Po podaniu SC pacjentom z cukrzycą typu 2 eksenatyd osiąga medianę maksymalnego stężenia w osoczu po 2,1 godziny. Średnie maksymalne stężenie eksenatydu (Cmax) wynosiła 211 pg / ml, a całkowity średni obszar pod krzywą (AUC0-inf) wynosił 1036 pg-h / ml po podaniu SC dawki 10 mcg produktu Byetta. Ekspozycja na eksenatyd (AUC) wzrosła proporcjonalnie w zakresie dawek terapeutycznych od 5 μg do 10 μg. Wartości Cmax wzrosły mniej niż proporcjonalnie w tym samym zakresie. Podobną ekspozycję osiąga się po podaniu SC produktu Byetta w brzuch, udo lub ramię.
Dystrybucja
Średnia pozorna objętość dystrybucji eksenatydu po podaniu SC pojedynczej dawki produktu Byetta wynosi 28,3 L.
Metabolizm i eliminacja
Badania niekliniczne wykazały, że eksenatyd jest eliminowany głównie przez filtrację kłębuszkową, a następnie degradację proteolityczną. Średni pozorny klirens eksenatydu u ludzi wynosi 9,1 l / h, a średni końcowy okres półtrwania wynosi 2,4 h. Te właściwości farmakokinetyczne eksenatydu są niezależne od dawki. U większości osób stężenie eksenatydu można zmierzyć przez około 10 godzin po podaniu dawki.
Specjalne populacje
Niewydolność nerek
U pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek (klirens kreatyniny 30 do 80 ml / min) klirens eksenatydu był tylko nieznacznie zmniejszony; dlatego nie jest konieczne dostosowanie dawki produktu Byetta u pacjentów z łagodnymi do umiarkowanych zaburzeniami czynności nerek. Jednak u pacjentów ze schyłkową niewydolnością nerek poddawanych dializie średni klirens eksenatydu jest zmniejszony do 0,9 l / h w porównaniu do 9,1 l / h u zdrowych osób (patrz ŚRODKI OSTROŻNOŚCI, Ogólne).
Niewydolność wątroby
Nie przeprowadzono badań farmakokinetycznych u pacjentów z rozpoznaniem ostrej lub przewlekłej niewydolności wątroby. Ponieważ eksenatyd jest usuwany głównie przez nerki, nie należy oczekiwać, że zaburzenia czynności wątroby będą wpływać na stężenie eksenatydu we krwi (patrz Farmakokinetyka, Metabolizm i eliminacja).
Geriatryczny
Analiza farmakokinetyczna populacji pacjentów (w zakresie od 22 do 73 lat) sugeruje, że wiek nie wpływa na właściwości farmakokinetyczne eksenatydu.
Pediatryczny
Eksenatydu nie badano u dzieci.
Płeć
Analiza farmakokinetyczna populacji mężczyzn i kobiet sugeruje, że płeć nie wpływa na dystrybucję i eliminację eksenatydu.
Wyścigi
Analiza farmakokinetyczna populacji pacjentów, w tym rasy białej, latynoskiej i czarnej, sugeruje, że rasa nie ma znaczącego wpływu na farmakokinetykę eksenatydu.
Otyłość
Analiza farmakokinetyczna populacji pacjentów otyłych (BMI - 30 kg / m2) i nie otyłych pacjentów sugeruje, że otyłość nie ma istotnego wpływu na farmakokinetykę eksenatydu.
Interakcje z lekami
Digoksyna
Jednoczesne podawanie wielokrotnych dawek Byetta (10 mcg BID) obniżyło Cmax doustnej digoksyny (0,25 mg QD) o 17% i opóźniło Tmax o około 2,5 godziny; jednak całkowita ekspozycja farmakokinetyczna w stanie stacjonarnym (AUC) nie uległa zmianie.
Lovastatin
AUC i Cmax lowastatyny zmniejszyło się odpowiednio o około 40% i 28%, a Tmax było opóźnione o około 4 godziny, gdy Byetta (10 mcg BID) podawano jednocześnie z pojedynczą dawką lowastatyny (40 mg) w porównaniu z podawaną lowastatyną sam. W 30-tygodniowych kontrolowanych badaniach klinicznych produktu Byetta stosowanie produktu Byetta u pacjentów już otrzymujących HMG Inhibitory reduktazy CoA nie były związane ze spójnymi zmianami profili lipidowych w porównaniu do poziom podstawowy.
Lizynopryl
U pacjentów z łagodnym do umiarkowanego nadciśnieniem stabilizowanym podczas lizynoprylu (5 do 20 mg / dobę), Byetta (10 µg BID) nie zmieniała Cmax ani AUC lizynoprylu w stanie stacjonarnym. Lizynopryl w stanie stacjonarnym T.max zostało opóźnione o 2 godziny. Nie było zmian w 24-godzinnym średnim skurczowym i rozkurczowym ciśnieniu krwi.
Acetaminofen
Gdy podano 1000 mg eliksiru acetaminofenowego z 10 mcg Byetta (0 godzin) i 1 godzinę, 2 godziny i 4 godziny po iniekcji Byetta, AUC acetaminofenu zmniejszyło się odpowiednio o 21%, 23%, 24% i 14%; domax zmniejszyła się odpowiednio o 37%, 56%, 54% i 41%; T.max zwiększono z 0,6 godziny w okresie kontrolnym odpowiednio do 0,9 godziny, 4,2 godziny, 3,3 godziny i 1,6 godziny. Acetaminofen AUC, Cmax i Tmax nie uległy istotnej zmianie, gdy acetaminofen podano 1 godzinę przed wstrzyknięciem Byetta.
Warfaryna
Jednoczesne podawanie zdrowych ochotników wielokrotnych dawek produktu leczniczego Byetta (5 μg BID w dniach 1-2 i 10 μg BID w dniach 3-9), opóźnione Tmax warfaryny (25 mg) o około 2 godziny. Nie zaobserwowano klinicznie istotnego wpływu na Cmax lub AUC enancjomerów S i R warfaryny. Byetta nie zmieniła właściwości farmakodynamicznych (ocenianych na podstawie odpowiedzi INR) warfaryny.
Farmakodynamika
Glukoza poposiłkowa
U pacjentów z cukrzycą typu 2 produkt Byetta zmniejsza poposiłkowe stężenie glukozy w osoczu (ryc. 2).
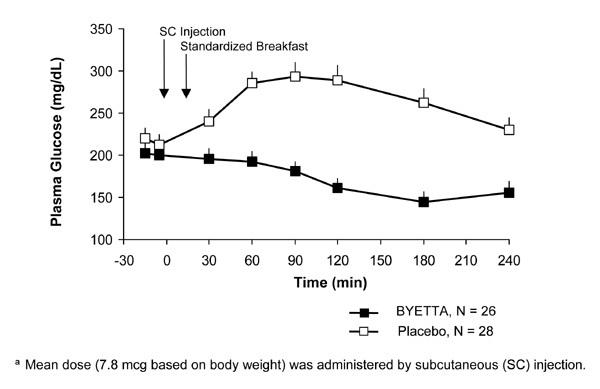
Rysunek 2: Średnie (+ SEM) poposiłkowe stężenia glukozy w osoczu w 1. dniu leczenia Byettaza Leczenie pacjentów z cukrzycą typu 2 leczonych metforminą, pochodną sulfonylomocznika lub obydwoma (N = 54)
Stężenie glukozy na czczo
W badaniu krzyżowym z pojedynczą dawką u pacjentów z cukrzycą typu 2 i hiperglikemią na czczo natychmiastowe uwalnianie insuliny nastąpiło po wstrzyknięciu produktu Byetta. Stężenie glukozy w osoczu było znacznie zmniejszone w przypadku produktu Byetta w porównaniu z placebo (ryc. 3).
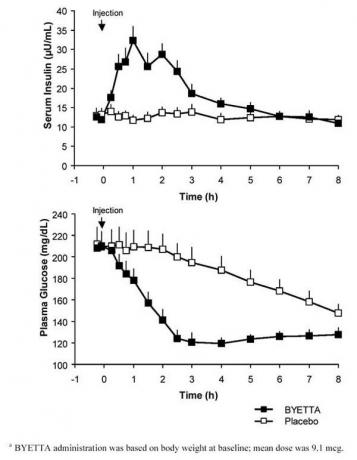
Rycina 3: Średnie (+ SEM) stężenie insuliny i stężenia glukozy w osoczu po jednorazowym wstrzyknięciu produktu leczniczego Byettaza lub placebo u pacjentów na czczo z cukrzycą typu 2 (N = 12)
Top
Studia kliniczne
Stosować z metforminą i / lub pochodną sulfonylomocznika
Przeprowadzono trzy 30-tygodniowe, podwójnie zaślepione, kontrolowane placebo badania w celu oceny bezpieczeństwa i skuteczności produktu Byetta u pacjentów z typem 2 cukrzyca, której kontrola glikemii była nieodpowiednia w przypadku samej metforminy, samej pochodnej sulfonylomocznika lub metforminy w połączeniu z sulfonylomocznik.
W tych trzech badaniach randomizowano ogółem 1446 pacjentów: 991 (68,5%) było rasy białej, 224 (15,5%) było latynosem, a 174 (12,0%) było rasy czarnej. Średnie wartości HbA1c na początku dla badań wahały się od 8,2% do 8,7%. Po 4-tygodniowym okresie wstępnym placebo pacjenci zostali losowo przydzieleni do otrzymywania Byetta 5 mcg BID, Byetta 10 mcg BID lub placebo BID przed porannymi i wieczornymi posiłkami, oprócz ich istniejących doustnych leków przeciwcukrzycowych agent. Wszyscy pacjenci przydzieleni do produktu Byetta rozpoczęli okres rozpoczynania leczenia 5 mcg BID przez 4 tygodnie. Po 4 tygodniach u tych pacjentów nadal podawano produkt Byetta 5 mcg BID lub zwiększono dawkę do 10 mcg BID. Pacjenci przydzieleni do placebo otrzymywali placebo BID przez cały czas trwania badania.
Pierwszorzędowym punktem końcowym w każdym badaniu była średnia zmiana w stosunku do wartości wyjściowej HbA1c po 30 tygodniach. Wyniki trzydziestotygodniowego badania podsumowano w tabeli 1.
Tabela 1: Wyniki trzydziestotygodniowych kontrolowanych placebo badań produktu Byetta u pacjentów z nieodpowiednią kontrolą glukozy pomimo zastosowania metforminy, sulfonylomocznika lub obu
| Placebo STAWKA |
Byetta 5 mcg BID |
Byetta 10 mcg* STAWKA |
|
|---|---|---|---|
| |||
| W połączeniu z metforminą | |||
| Populacja zgodna z leczeniem (N) | 113 | 110 | 113 |
| HbA1c (%), Oznaczać | |||
| Linia bazowa | 8.2 | 8.3 | 8.2 |
| Zmień w 30. tygodniu | +0.1 | −0.4†| −0.8do |
| Odsetek osiągający HbA1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Masa ciała (kg), średnia | |||
| Linia bazowa | 99.9 | 100.0 | 100.9 |
| Zmień w 30. tygodniu | −0.3 | −1.6†| −2.8do |
| W połączeniu z sulfonylomocznikiem | |||
| Populacja zgodna z leczeniem (N) | 123 | 125 | 129 |
| HbA1c (%), Oznaczać | |||
| Linia bazowa | 8.7 | 8.5 | 8.6 |
| Zmień w 30. tygodniu | +0.1 | −0.5†| −0.9do |
| Odsetek osiągający HbA1c≤7% § | 8.8% | 32.6%†| 41.3%do |
| Masa ciała (kg), średnia | |||
| Linia bazowa | 99.1 | 94.9 | 95.2 |
| Zmień w 30. tygodniu | −0.6 | −0.9 | −1.6†|
| W połączeniu z metforminą i sulfonylomocznikiem | |||
| Populacja zgodna z leczeniem (N) | 247 | 245 | 241 |
| HbA1c (%), Oznaczać | |||
| Linia bazowa | 8.5 | 8.5 | 8.5 |
| Zmień w 30. tygodniu | +0.2 | −0.6do | −0.8do |
| Odsetek osiągający HbA1c≤7% § | 9.2% | 27.4%do | 33.5%do |
| Masa ciała (kg), średnia | |||
| Linia bazowa | 99.1 | 96.9 | 98.4 |
| Zmień w 30. tygodniu | −0.9 | −1.6†| −1.6†|
HbA1c
Dodanie Byetta do schematu metforminy, pochodnej sulfonylomocznika lub obu, spowodowało statystycznie znaczące obniżenie wartości wyjściowej HbA1c w 30. tygodniu w porównaniu z pacjentami otrzymującymi placebo dodanymi do tych środków w trzech kontrolowanych badaniach (Tabela 1). Ponadto zaobserwowano statystycznie istotny efekt dawki między grupami 5-mcg i 10-mcg Byetta w odniesieniu do zmiany w stosunku do wartości wyjściowej HbA1c w tygodniu 30 w trzech badaniach.
Glukoza na czczo i po posiłku
Długotrwałe stosowanie leku Byetta w połączeniu z metforminą, pochodną sulfonylomocznika lub obydwoma, zmniejszało zarówno głodzenie, jak i poposiłkowe stężenie glukozy w osoczu w statystycznie istotny, zależny od dawki sposób przez tydzień 30. Istotne statystycznie zmniejszenie w stosunku do wartości wyjściowych zarówno średniego stężenia glukozy na czczo, jak i po posiłku zaobserwowano w 30. tygodniu w obu grupach Byetta w porównaniu z placebo w danych połączonych z trzema kontrolowanymi próby. Zmiana stężenia glukozy na czczo w 30. tygodniu w porównaniu do wartości wyjściowej wyniosła „8 mg / dl dla Byetta 5 mcg BID i„ 10 mg / dl dla Byetta 10 mcg BID, w porównaniu z +12 mg / dL dla placebo. Porównano zmianę stężenia glukozy po 2 godzinach po posiłku po podaniu produktu Byetta w 30. tygodniu dla wartości wyjściowej wynosiła 63 mg / dl dla 5 mcg BID i 71 mg / dl dla 10 mcg BID, w porównaniu z +11 mg / dl dla placebo.
Odsetek pacjentów osiągających HbA1c≤7%
Byetta w połączeniu z metforminą, pochodną sulfonylomocznika lub obydwoma, dawała większe, istotne statystycznie odsetek pacjentów osiągających HbA1c ¤ %7% w 30. tygodniu w porównaniu z pacjentami otrzymującymi placebo w skojarzeniu z ci agenci (Tabela 1).
Masy ciała
W trzech kontrolowanych badaniach zmniejszenie masy ciała w punkcie początkowym w Tygodniu 30 było związane z produktem leczniczym Byetta 10 mcg BID w porównaniu z placebo BID u pacjentów z cukrzycą typu 2 (Tabela 1).
Wyniki kliniczne roczne
W grupie 163 pacjentów z 30-tygodniowych badań kontrolowanych placebo, którzy ukończyli łącznie 52 tygodnie leczenia produktem Byetta 10 mcg BID, zmiany HbA1c od wartości wyjściowej wynosiły „1,0% i” 1,1% odpowiednio po 30 i 52 tygodniach leczenia, z towarzyszącymi zmianami w stosunku do wartości wyjściowych stężenia glukozy w osoczu na poziomie 14,0 mg / dl i 25,3 mg / dl oraz zmianami masy ciała o 2,6 kg i 3,6 kg. Ta kohorta miała wartości wyjściowe podobne do wartości w całej populacji kontrolowanego badania.
Stosować z tiazolidynodionem
W randomizowanym, podwójnie ślepym, kontrolowanym placebo badaniu trwającym 16 tygodni, Byetta (n = 121) lub placebo (n = 112) zostało dodane do istniejącego Leczenie tiazolidynodionem (pioglitazon lub rozyglitazon), z metforminą lub bez, u pacjentów z cukrzycą typu 2 z niewystarczającymi kontrola glikemii. Randomizacja do Byetta lub placebo została stratyfikowana na podstawie tego, czy pacjenci otrzymywali metforminę. Pacjenci przydzieleni do placebo otrzymywali placebo BID przez cały czas trwania badania. Byetta lub placebo wstrzykiwano podskórnie przed porannymi i wieczornymi posiłkami. Siedemdziesiąt dziewięć procent pacjentów brało tiazolidynodion i metforminę, a 21% brało sam tiazolidynodion. Większość pacjentów (84%) była rasy białej, 8% było pochodzenia latynoskiego, a 3% było rasy czarnej. Średnie wyjściowe wartości HbA1c były podobne dla Byetta i placebo (7,9%). Leczenie produktem Byetta rozpoczęto od dawki 5 mcg BID przez 4 tygodnie, a następnie zwiększono do 10 mcg BID przez 12 kolejnych tygodni.
Wyniki szesnastotygodniowego badania podsumowano w tabeli 2. W porównaniu z placebo preparat Byetta spowodował statystycznie istotne zmniejszenie HbA1c w stosunku do wartości wyjściowej w tygodniu 16. Efekty leczenia dla HbA1c były podobne w dwóch podgrupach określonych przez leżącą u podstaw warstwę leczenia (sam tiazolidynodiony w porównaniu do tiazolidynodionów plus metformina). Zmiana stężenia glukozy w surowicy na czczo od wartości wyjściowej do 16. tygodnia była statystycznie istotna w porównaniu z placebo (- 21 mg / dl dla Byetta 10 mcg BID w porównaniu z +4 mg / dl dla placebo).
Tabela 2: Wyniki 16-tygodniowego kontrolowanego placebo badania produktu Byetta u pacjentów z nieodpowiednią kontrolą glukozy pomimo zastosowania tiazolidynodionu (TZD) lub tiazolidynodionu plus metforminy
| Placebo STAWKA |
Byetta 10 mcg* STAWKA |
|
|---|---|---|
| ||
| W połączeniu z TZD lub TZD plus MET | ||
| Populacja zgodna z leczeniem (N) | 112 | 121 |
| HbA1c (%), Oznaczać | ||
| Linia bazowa | 7.9 | 7.9 |
| Zmień w tygodniu 16 | +0.1 | −0.8†|
| Odsetek osiągający HbA1c≤7%do | 16.2% | 62.3%†|
| Masa ciała (kg), średnia | ||
| Linia bazowa | 96.9 | 97.5 |
| Zmień w tygodniu 16 | −0.2 | −1.5†|
Top
Wskazania i zastosowanie
Byetta jest wskazana jako leczenie wspomagające w celu poprawy kontroli glikemii u pacjentów z cukrzycą typu 2, którzy przyjmują metforminę, pochodną sulfonylomocznika, tiazolidynodion, kombinacja metforminy i sulfonylomocznika lub kombinacja metforminy i tiazolidynodionu, ale nie osiągnęły wystarczającej glikemii kontrola.
Top
Przeciwwskazania
Produkt Byetta jest przeciwwskazany u pacjentów ze znaną nadwrażliwością na eksenatyd lub którykolwiek ze składników produktu.
Top
Środki ostrożności
Generał
Byetta nie zastępuje insuliny u pacjentów wymagających insuliny. Byetta nie powinna być stosowana u pacjentów z cukrzycą typu 1 lub w leczeniu cukrzycowej kwasicy ketonowej.
Po leczeniu produktem Byetta pacjenci mogą wytworzyć przeciwciała przeciw eksenatydowi, zgodnie z potencjalnie immunogennymi właściwościami białek i peptydów. Pacjentów otrzymujących Byetta należy obserwować pod kątem oznak i objawów reakcji nadwrażliwości.
U niewielkiego odsetka pacjentów tworzenie się przeciwciał przeciw eksenatydowi przy wysokich mianach może skutkować niepowodzeniem w uzyskaniu odpowiedniej poprawy kontroli glikemii. W przypadku pogorszenia kontroli glikemii lub nieosiągnięcia ukierunkowanej kontroli glikemii należy rozważyć alternatywne leczenie przeciwcukrzycowe.
Nie badano jednoczesnego stosowania preparatu Byetta z insuliną, pochodnymi D-fenyloalaniny, meglitinidami lub inhibitorami alfa-glukozydazy.
Nie zaleca się stosowania produktu Byetta u pacjentów ze schyłkową niewydolnością nerek lub ciężkimi zaburzeniami czynności nerek (klirens kreatyniny Farmakokinetyka, populacje specjalne). U pacjentów ze schyłkową niewydolnością nerek poddawanych dializie pojedyncze dawki produktu Byetta 5 mcg nie były dobrze tolerowane z powodu działań niepożądanych ze strony przewodu pokarmowego.
Występowały rzadkie, spontanicznie zgłaszane zdarzenia zaburzenia czynności nerek, w tym zwiększenie stężenia w surowicy kreatynina, zaburzenia czynności nerek, pogorszenie przewlekłej niewydolności nerek i ostra niewydolność nerek, czasem wymagające hemodializa. Niektóre z tych zdarzeń wystąpiły u pacjentów otrzymujących jeden lub więcej środków farmakologicznych, o których wiadomo, że wpływają na nerki stan funkcji / nawodnienia i / lub u pacjentów z nudnościami, wymiotami i / lub biegunką, z lub bez odwodnienie. Jednoczesne środki obejmowały inhibitory konwertazy angiotensyny, niesteroidowe leki przeciwzapalne i leki moczopędne. Odwracalność zmienionej czynności nerek obserwowano podczas leczenia podtrzymującego i odstawienia leków potencjalnie sprawczych, w tym eksenatydu. W badaniach przedklinicznych lub klinicznych eksenatyd nie wykazał bezpośredniego działania nefrotoksycznego.
Produkt Byetta nie był badany u pacjentów z ciężką chorobą przewodu pokarmowego, w tym gastroparezą. Jego stosowanie jest często związane z działaniami niepożądanymi ze strony przewodu pokarmowego, w tym nudnościami, wymiotami i biegunką. Dlatego nie zaleca się stosowania produktu Byetta u pacjentów z ciężką chorobą przewodu pokarmowego. Należy zbadać rozwój silnego bólu brzucha u pacjenta leczonego produktem Byetta, ponieważ może to być znak ostrzegawczy poważnego stanu.
Hipoglikemia
W 30-tygodniowych kontrolowanych badaniach klinicznych z Byettą epizod hipoglikemii odnotowano jako zdarzenie niepożądane, jeśli pacjent zgłosił objawy związane z hipoglikemią z towarzyszącym dawkowaniem glukozy we krwi DAWKOWANIE I PODAWANIE).
Tabela 3: Występowanie (%) hipoglikemii * podczas jednoczesnego leczenia przeciwcukrzycowego
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Placebo STAWKA |
5 mcg STAWKA |
10 mcg STAWKA |
Placebo STAWKA |
5 mcg STAWKA |
10 mcg STAWKA |
Placebo STAWKA |
5 mcg STAWKA |
10 mcg STAWKA |
|
| Z metforminą | Z sulfonylomocznikiem | Z MET / SFU | |||||||
| Byetta i placebo podawano przed porannymi i wieczornymi posiłkami. | |||||||||
| Skróty: BID, dwa razy dziennie; MET / SFU, metformina i pochodna sulfonylomocznika. | |||||||||
| |||||||||
| N. | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| Hipoglikemia | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Po zastosowaniu jako dodatek do tiazolidynodionu, z metforminą lub bez, częstość występowania objawowej łagodnej do umiarkowanej hipoglikemii po zastosowaniu produktu Byetta wynosiła 11% w porównaniu z 7% w przypadku placebo.
Byetta nie zmieniła odpowiedzi hormonów przeciwregulacyjnych na indukowaną insuliną hipoglikemię w randomizowanym, kontrolowanym badaniu z podwójnie ślepą próbą u zdrowych osób.
Informacje dla pacjentów
Pacjentów należy poinformować o potencjalnym ryzyku związanym z produktem Byetta. Pacjentów należy również w pełni poinformować o praktykach samozarządzania, w tym o znaczeniu właściwego przechowywania leku Byetta, zastrzyku technika, czas podawania leku Byetta, a także innych doustnych leków, przestrzeganie planu posiłków, regularna aktywność fizyczna, okresowe monitorowanie poziomu glukozy we krwi i badanie HbA1c, rozpoznawanie i leczenie hipoglikemii i hiperglikemii oraz ocena cukrzycy powikłania
Pacjentom należy zalecić poinformowanie lekarza, jeśli są w ciąży lub zamierzają zajść w ciążę.
Każdą dawkę leku Byetta należy podawać we wstrzyknięciu podskórnym w udo, brzuch lub ramię w dowolnym momencie w obrębie 60 minut przed porannym i wieczornym posiłkiem (lub przed dwoma głównymi posiłkami w ciągu dnia, około 6 godzin lub więcej niezależnie). Produktu Byetta nie należy podawać po posiłku. W przypadku pominięcia dawki schemat leczenia należy wznowić zgodnie z kolejną zaplanowaną dawką.
Ryzyko hipoglikemii zwiększa się, gdy Byetta stosuje się w skojarzeniu ze środkiem wywołującym hipoglikemię, takim jak pochodna sulfonylomocznika. Należy wyjaśnić pacjentowi objawy, leczenie i stany, które predysponują do rozwoju hipoglikemii. Chociaż zwykłe instrukcje pacjenta dotyczące postępowania w hipoglikemii nie muszą być zmieniane, instrukcje te powinny być zmienione poddane przeglądowi i wzmocnione podczas rozpoczynania leczenia produktem Byetta, szczególnie w przypadku jednoczesnego podawania z pochodną sulfonylomocznika (widzieć ŚRODKI OSTROŻNOŚCI, Hipoglikemia).
Pacjentów należy poinformować, że leczenie produktem Byetta może spowodować zmniejszenie apetytu i jedzenia spożycie i / lub masę ciała oraz że nie ma potrzeby modyfikowania schematu dawkowania z tego powodu efekty. Leczenie produktem Byetta może również wywoływać nudności, szczególnie po rozpoczęciu leczenia (patrz DZIAŁANIA NIEPOŻĄDANE).
Przed rozpoczęciem leczenia produktem Byetta pacjent powinien przeczytać ulotkę „Informacje dla pacjenta” oraz instrukcję obsługi pióra i przejrzeć je za każdym razem, gdy recepta jest uzupełniana. Pacjent powinien zostać poinstruowany o prawidłowym użytkowaniu i przechowywaniu wstrzykiwacza, podkreślając, jak i kiedy założyć nowy wstrzykiwacz, oraz zauważając, że przy pierwszym użyciu konieczny jest tylko jeden krok konfiguracji. Pacjentowi należy zalecić, aby nie dzielił wstrzykiwacza i igieł.
Należy poinformować pacjentów, że igły do wstrzykiwacza nie są dołączone do wstrzykiwacza i należy je zakupić osobno. Pacjentów należy poinformować o długości i grubości igły.
Interakcje z lekami
Wpływ leku Byetta na spowolnienie opróżniania żołądka może zmniejszyć zakres i szybkość wchłaniania leków podawanych doustnie. Byetta należy stosować ostrożnie u pacjentów otrzymujących leki doustne wymagające szybkiego wchłaniania z przewodu pokarmowego. W przypadku leków doustnych zależnych od progowych stężeń skuteczności, takich jak antykoncepcji i antybiotyków, należy zalecić pacjentom przyjmowanie tych leków co najmniej 1 godzinę wcześniej Zastrzyk Byetta. Jeśli takie leki mają być podawane z jedzeniem, należy zalecić pacjentom przyjmowanie ich z posiłkiem lub przekąską, gdy nie podaje się leku Byetta. Wpływ leku Byetta na wchłanianie i skuteczność doustnych środków antykoncepcyjnych nie został scharakteryzowany.
Warfaryna
W kontrolowanym klinicznym badaniu farmakologicznym u zdrowych ochotników zaobserwowano opóźnienie Tmax warfaryny o około 2 godziny, gdy warfarynę podano 30 minut po Byetta. Nie zaobserwowano klinicznie istotnego wpływu na Cmax lub AUC. Jednak od czasu wprowadzenia na rynek zgłaszano spontanicznie przypadki wzrostu INR (Międzynarodowy współczynnik znormalizowany) z jednoczesnym stosowaniem warfaryny i Byetty, czasami związanych z krwawienie.
Rakotwórczość, mutageneza, upośledzenie płodności
104-tygodniowe badanie rakotwórczości przeprowadzono na samcach i samicach szczurów w dawkach 18, 70 lub 250 μg / kg / dobę podawanych w bolusie podskórnym. Łagodne gruczolaki komórek C tarczycy obserwowano u samic szczurów przy wszystkich dawkach eksenatydu. Częstość występowania u samic szczurów wynosiła 8% i 5% w dwóch grupach kontrolnych oraz 14%, 11% i 23% w grupach o niskiej, średniej i wysokiej dawce z ekspozycją ogólnoustrojową odpowiednio 5, 22 i 130 razy, narażenie człowieka wynikające z maksymalnej zalecanej dawki 20 mcg / dzień, w oparciu o powierzchnię osocza pod krzywą (AUC).
W 104-tygodniowym badaniu rakotwórczości na myszach w dawkach 18, 70 lub 250 μg / kg / dobę podawanych w bolusie podskórnym SC, nie zaobserwowano dowodów na obecność guzów w dawkach do 250 mcg / kg / dzień ekspozycja ogólnoustrojowa do 95 razy większa niż ekspozycja u ludzi wynikająca z maksymalnej zalecanej dawki 20 mcg / dzień, w oparciu o AUC.
Eksenatyd nie wykazywał działania mutagennego ani klastogennego, z aktywacją metaboliczną lub bez, w teście mutagenności bakteryjnej Amesa lub teście aberracji chromosomowej w komórkach jajnika chomika chińskiego. Eksenatyd był ujemny w teście mikrojądrowym myszy in vivo.
W badaniach płodności u myszy z dawkami SC wynoszącymi 6, 68 lub 760 mcg / kg / dobę, mężczyźni byli leczeni przez 4 tygodnie przed do krycia i podczas krycia, a samice leczono 2 tygodnie przed kryciem i podczas krycia aż do dnia ciąży 7. Nie zaobserwowano niekorzystnego wpływu na płodność przy dawce 760 μg / kg / dobę, ekspozycja ogólnoustrojowa 390 razy większa niż ekspozycja u ludzi wynikająca z maksymalnej zalecanej dawki 20 μg / dobę, w oparciu o AUC.
Ciąża
Kategoria ciąży C
Wykazano, że eksenatyd powoduje zmniejszenie wzrostu płodu i noworodka oraz działania na szkielet u myszy w wieku narażenia ogólnoustrojowe 3 razy większe niż narażenie człowieka wynikające z maksymalnej zalecanej dawki 20 mikrogramów / dobę, na podstawie AUC. Wykazano, że eksenatyd powoduje działanie szkieletowe u królików przy ekspozycji ogólnoustrojowej 12 razy większej niż ekspozycja u ludzi wynikającej z maksymalnej zalecanej dawki 20 μg / dobę, w oparciu o AUC. Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Byetta powinna być stosowana w czasie ciąży tylko wtedy, gdy potencjalna korzyść uzasadnia potencjalne ryzyko dla płodu.
U samic myszy, którym podano SC 6, 68 lub 760 μg / kg mc./dobę, rozpoczynając 2 tygodnie przed kryciem i w trakcie kojarzenia aż do 7 dnia ciąży, nie stwierdzono niekorzystnego wpływu na płód efekty przy dawkach do 760 mcg / kg / dzień, ogólnoustrojowe narażenia do 390 razy większe niż narażenie człowieka wynikające z maksymalnej zalecanej dawki 20 mcg / dzień, w oparciu o AUC.
U ciężarnych myszy otrzymujących dawki SC 6, 68, 460 lub 760 μg / kg / dobę od 6 do 15 dnia ciąży (organogeneza), rozszczep podniebienia (niektóre z dziurami) i nieregularny szkielet kostnienie żeber i kości czaszki obserwowano przy 6 mcg / kg / dobę, ekspozycja ogólnoustrojowa 3 razy większa niż ekspozycja u ludzi wynikająca z maksymalnej zalecanej dawki 20 mcg / kg / dobę, na podstawie AUC.
U ciężarnych królików otrzymujących dawki SC 0,2, 2, 22, 156 lub 260 μg / kg / dobę od 6 do 18 dnia ciąży (organogeneza), nieregularny szkielet obserwowano skostnienie przy 2 μg / kg / dobę, ekspozycja ogólnoustrojowa 12 razy większa niż ekspozycja u ludzi wynikająca z maksymalnej zalecanej dawki 20 μg / dobę, na podstawie AUC.
U ciężarnych myszy, którym podano dawki SC wynoszące 6, 68 lub 760 μg / kg / dobę od 6 dnia ciąży do 20 dnia laktacji (odstawienia od piersi), zaobserwowano zwiększoną liczbę zgonów noworodków w dniach 2-4 po porodzie u matek, którym podano 6 μg / kg / dobę, ekspozycja ogólnoustrojowa 3 razy większa niż ekspozycja u ludzi wynikająca z maksymalnej zalecanej dawki 20 μg / dobę, w oparciu o AUC.
Matki karmiące
Nie wiadomo, czy eksenatyd przenika do mleka kobiecego. Wiele leków przenika do mleka ludzkiego i ze względu na możliwość wystąpienia klinicznie istotnych działań niepożądanych u niemowląt karmionych eksenatydem, decyzja należy podjąć decyzję, czy przerwać produkcję mleka do spożycia, czy przerwać stosowanie leku, biorąc pod uwagę znaczenie leku dla karmienia piersią kobieta. Badania na myszach w okresie laktacji wykazały, że eksenatyd jest obecny w mleku w niskich stężeniach (mniejszych lub równych 2,5% stężenia w osoczu matki po podaniu podskórnym). Należy zachować ostrożność, gdy Byetta jest podawana kobiecie karmiącej.
Zastosowanie pediatryczne
Nie ustalono bezpieczeństwa i skuteczności produktu Byetta u dzieci.
Zastosowanie geriatryczne
Produkt Byetta badano u 282 pacjentów w wieku 65 lat lub starszych oraz u 16 pacjentów w wieku 75 lat lub starszych. Nie zaobserwowano różnic w bezpieczeństwie ani skuteczności między tymi pacjentami a młodszymi pacjentami.
Top
Działania niepożądane
Stosować z metforminą i / lub pochodną sulfonylomocznika
W trzech 30-tygodniowych kontrolowanych badaniach dodatku Byetta z metforminą i / lub pochodną sulfonylomocznika zdarzenia niepożądane występowały z częstością 5% (z wyłączeniem hipoglikemii; widzieć Tabela 3), które występowały częściej u pacjentów leczonych produktem Byetta w porównaniu z pacjentami otrzymującymi placebo, podsumowano w tabeli 4.
Tabela 4: Częste zdarzenia niepożądane związane z leczeniem (częstość występowania 5% i większa częstość leczenia produktem Byetta) z wyłączeniem hipoglikemii *
| Placebo BID N = 483 % |
Wszystkie oferty BYETY N = 963 % |
|
|---|---|---|
| ||
| Nudności | 18 | 44 |
| Wymioty | 4 | 13 |
| Biegunka | 6 | 13 |
| Uczucie roztrzęsienia | 4 | 9 |
| Zawroty głowy | 6 | 9 |
| Bół głowy | 6 | 9 |
| Niestrawność | 3 | 6 |
Działania niepożądane związane z produktem Byetta miały na ogół nasilenie łagodne do umiarkowanego. Najczęściej zgłaszane zdarzenie niepożądane, łagodne do umiarkowanych nudności, występowało w sposób zależny od dawki. Przy dalszym leczeniu częstotliwość i nasilenie zmniejszały się z czasem u większości pacjentów, którzy początkowo doświadczyli nudności. Zdarzenia niepożądane zgłaszane u 1,0 do <5,0% pacjentów otrzymujących Byetta i zgłaszane częściej niż w przypadku placebo obejmowały osłabienie (najczęściej zgłaszane jako osłabienie), zmniejszenie apetytu, chorobę refluksową przełyku i nadmierna potliwość. Pacjenci w badaniach przedłużonych po 52 tygodniach doświadczyli podobnych rodzajów zdarzeń niepożądanych obserwowanych w 30-tygodniowych kontrolowanych badaniach.
Częstość wycofania z powodu zdarzeń niepożądanych wynosiła 7% u pacjentów leczonych produktem Byetta i 3% u pacjentów otrzymujących placebo. Najczęstszymi zdarzeniami niepożądanymi prowadzącymi do wycofania u pacjentów leczonych produktem Byetta były nudności (3% pacjentów) i wymioty (1%). U pacjentów leczonych placebo <1% wycofało się z powodu nudności, a 0% z powodu wymiotów.
Stosować z tiazolidynodionem
W 16-tygodniowym badaniu kontrolowanym placebo dodatku Byetta do tiazolidynodionu, z metforminą lub bez, częstość występowania i rodzaj inne obserwowane zdarzenia niepożądane były podobne do obserwowanych w 30-tygodniowych kontrolowanych badaniach klinicznych z metforminą i (lub) sulfonylomocznik. Nie odnotowano poważnych zdarzeń niepożądanych w grupie placebo. W ramieniu Byetta zgłoszono dwa poważne zdarzenia niepożądane, mianowicie ból w klatce piersiowej (prowadzący do wycofania) i przewlekłe nadwrażliwe zapalenie płuc.
Częstość wycofania z powodu zdarzeń niepożądanych wynosiła 16% (19/121) u pacjentów leczonych produktem Byetta i 2% (2/112) dla pacjentów otrzymujących placebo. Najczęstszymi zdarzeniami niepożądanymi prowadzącymi do odstawienia u pacjentów leczonych produktem Byetta były nudności (9%) i wymioty (5%). W przypadku pacjentów leczonych placebo <1% wycofało się z powodu nudności. Dreszcze (n = 4) i reakcje w miejscu wstrzyknięcia (n = 2) występowały tylko u pacjentów leczonych produktem Byetta. Dwóch pacjentów, którzy zgłosili reakcję w miejscu wstrzyknięcia, miało wysokie miana przeciwciał przeciw eksenatydowi.
Spontaniczne dane
Od czasu wprowadzenia produktu Byetta na rynek zgłaszano następujące dodatkowe działania niepożądane. Ponieważ zdarzenia te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie zawsze można wiarygodnie oszacować ich częstość lub ustalić związek przyczynowy z ekspozycją na lek.
Ogólne: reakcje w miejscu wstrzyknięcia; zaburzenia smaku; senność, wartość INR wzrosła wraz z jednoczesnym stosowaniem warfaryny (niektóre doniesienia związane z krwawieniem).
Alergia / nadwrażliwość: uogólniony świąd i / lub pokrzywka, wysypka plamkowa lub grudkowa, obrzęk naczynioruchowy; rzadkie doniesienia o reakcji anafilaktycznej.
Przewód pokarmowy: nudności, wymioty i / lub biegunka powodujące odwodnienie; wzdęcie brzucha, ból brzucha, erupcja, zaparcia, wzdęcia, ostre zapalenie trzustki.
Zaburzenia nerek i dróg moczowych: zaburzenia czynności nerek, w tym ostra niewydolność nerek, pogorszenie przewlekłej niewydolności nerek, zaburzenia czynności nerek, zwiększenie stężenia kreatyniny w surowicy (patrz ŚRODKI OSTROŻNOŚCI).
Immunogenność
Zgodnie z potencjalnie immunogennymi właściwościami farmaceutyków białkowych i peptydowych u pacjentów mogą rozwinąć się przeciwciała przeciw eksenatydowi po leczeniu produktem Byetta. U większości pacjentów, u których rozwijają się przeciwciała, miana przeciwciał zmniejszają się z czasem.
W 30-tygodniowych kontrolowanych badaniach dodatku Byetta do metforminy i / lub pochodnej sulfonylomocznika, 38% pacjentów miało niskie miano przeciwciał przeciw eksenatydowi po 30 tygodniach. W tej grupie poziom kontroli glikemii (HbA1c) był ogólnie porównywalny z poziomem obserwowanym u osób bez mian przeciwciał. Dodatkowe 6% pacjentów miało wyższe miano przeciwciał po 30 tygodniach. U około połowy z tych 6% (3% wszystkich pacjentów otrzymujących Byetta w 30-tygodniowych kontrolowanych badaniach) odpowiedź glikemiczna na Byetta była osłabiona; reszta miała odpowiedź glikemiczną porównywalną z odpowiedzią pacjentów bez przeciwciał.
W 16-tygodniowym badaniu dodatku Byetta do tiazolidynodionów, z metforminą lub bez, 9% pacjentów miało wyższe miano przeciwciał w 16 tygodniu. W porównaniu z pacjentami, u których nie wytworzyły się przeciwciała przeciwko Byetta, odpowiedź glikemiczna u pacjentów z przeciwciałami o wyższym mianie była osłabiona.
Należy monitorować odpowiedź glikemiczną pacjenta na Byetta. W przypadku pogorszenia kontroli glikemii lub nieosiągnięcia ukierunkowanej kontroli glikemii należy rozważyć alternatywne leczenie przeciwcukrzycowe.
Top
Przedawkowanie
W badaniu klinicznym produktu Byetta trzech pacjentów z cukrzycą typu 2 doświadczyło pojedynczego przedawkowania 100 mcg SC (10-krotność maksymalnej zalecanej dawki). Skutki przedawkowania obejmowały ciężkie nudności, silne wymioty i gwałtownie spadające stężenie glukozy we krwi. Jeden z trzech pacjentów doświadczył ciężkiej hipoglikemii wymagającej pozajelitowego podania glukozy. Trzej pacjenci wyzdrowiali bez komplikacji. W przypadku przedawkowania należy rozpocząć odpowiednie leczenie podtrzymujące zgodnie z objawami klinicznymi pacjenta.
Top
Dawkowanie i sposób podawania
Leczenie produktem Byetta należy rozpocząć od dawki 5 μg na dawkę podawanej dwa razy dziennie w dowolnym momencie w ciągu 60 minut okres przed porannym i wieczornym posiłkiem (lub przed dwoma głównymi posiłkami w ciągu dnia, około 6 godzin lub więcej niezależnie). Produktu Byetta nie należy podawać po posiłku. W oparciu o odpowiedź kliniczną dawkę leku Byetta można zwiększyć do 10 mcg dwa razy dziennie po 1 miesiącu terapii. Każdą dawkę należy podawać we wstrzyknięciu podskórnym w udo, brzuch lub ramię.
Byetta jest zalecana do stosowania u pacjentów z cukrzycą typu 2, którzy już otrzymują metforminę, pochodną sulfonylomocznika, tiazolidynodion, kombinacja metforminy i sulfonylomocznika lub kombinacja metforminy i tiazolidynodionu, i mają suboptymalne kontrola glikemii. Po dodaniu Byetta do terapii metforminą lub tiazolidynodionem można kontynuować aktualną dawkę metforminy lub tiazolidynodionu ponieważ jest mało prawdopodobne, aby dawka metforminy lub tiazolidynodionu wymagała dostosowania z powodu hipoglikemii podczas stosowania z produktem Byetta. Po dodaniu leku Byetta do terapii pochodnymi sulfonylomocznika można rozważyć zmniejszenie dawki pochodnej sulfonylomocznika w celu zmniejszenia ryzyka hipoglikemii (patrz ŚRODKI OSTROŻNOŚCI, Hipoglikemia).
Byetta jest przezroczystą i bezbarwną cieczą i nie należy jej stosować, jeśli pojawiają się cząsteczki lub roztwór jest mętny lub zabarwiony. Byetta nie powinna być używana po upływie terminu ważności. Brak danych dotyczących bezpieczeństwa lub skuteczności dożylnego lub domięśniowego wstrzyknięcia produktu Byetta.
Top
Przechowywanie
Przed pierwszym użyciem produkt Byetta należy przechowywać w lodówce w temperaturze od 2 ° C do 8 ° C. Po pierwszym użyciu produkt Byetta można przechowywać w temperaturze nieprzekraczającej 25 ° C. Nie zamrażać. Nie należy stosować leku Byetta, jeśli został zamrożony. Byetta powinna być chroniona przed światłem. Wstrzykiwacz należy wyrzucić 30 dni po pierwszym użyciu, nawet jeśli we wstrzykiwaczu pozostanie jakiś lek.
Top
Jak jest dostarczany
Produkt Byetta jest dostarczany jako sterylny roztwór do wstrzykiwań podskórnych zawierający 250 μg / ml eksenatydu. Dostępne są następujące pakiety:
5 mcg na dawkę, 60 dawek, fabrycznie napełniony wstrzykiwacz 1,2 ml NDC 66780-210-07
10 mcg na dawkę, 60 dawek, fabrycznie napełniony wstrzykiwacz 2,4 ml NDC 66780-210-08
TYLKO Rx
Wyprodukowano dla Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Sprzedawany przez Amylin Pharmaceuticals, Inc. oraz Eli Lilly and Company
1-800-868-1190
http://www.Byetta.com
Byetta jest zastrzeżonym znakiem towarowym Amylin Pharmaceuticals, Inc.
© 2007 Amylin Pharmaceuticals, Inc. Wszelkie prawa zastrzeżone.
ostatnia aktualizacja 09/2007
Byetta (Exenatide) Informacje dla pacjenta (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chciałbyś uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę



