Exubera do leczenia cukrzycy
Nazwa marki: Exubera
Nazwa ogólna: insulina ludzka
Postać dawkowania: proszek do inhalacji
Zawartość:
Opis
Farmakologia kliniczna
Studia kliniczne
Wskazania i zastosowanie
Przeciwwskazania
Ostrzeżenia
Środki ostrożności
Interakcje z lekami
Działania niepożądane
Przedawkowanie
Dawkowanie i sposób podawania
Jak dostarczone
Exubera, insulina ludzka [pochodzenie rDNA] Informacje dla pacjenta (w prostym angielskim)
Opis
Exubera® składa się z blistrów zawierających ludzką insulinę w proszku do inhalacji, które podaje się za pomocą Exubera® Inhalator. Blistry Exubera zawierają ludzką insulinę wytwarzaną technologią rekombinacji DNA z wykorzystaniem niepatogennego szczepu laboratoryjnego Escherichia coli (K12). Chemicznie ludzka insulina ma wzór empiryczny C.257H.383N.65O77S.6 i masa cząsteczkowa 5808. Ludzka insulina ma następującą pierwotną sekwencję aminokwasową:
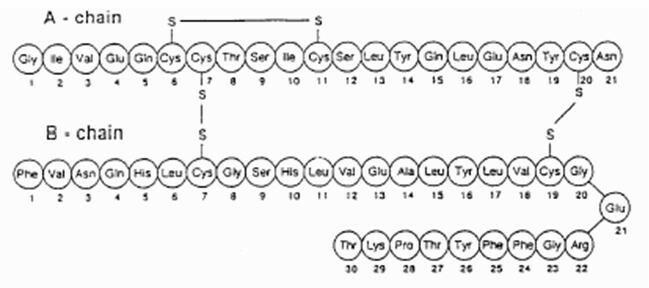
Exubera (insulina ludzka [pochodzenie rDNA]) Proszek do inhalacji jest białym lub prawie białym proszkiem w blistrze o dawce jednostkowej (masa wypełnienia, patrz Tabela 1). Każdy blister z dawką jednostkową preparatu Exubera zawiera dawkę 1 mg lub 3 mg insuliny (patrz Tabela 1) jednorodny preparat w proszku zawierający cytrynian sodu (dwuwodny), mannitol, glicynę i sód wodorotlenek. Po włożeniu blistra do inhalatora Exubera pacjent pompuje uchwyt inhalatora, a następnie naciska przycisk, powodując przebicie blistra. Proszek do inhalacji insuliny jest następnie dyspergowany w komorze, umożliwiając pacjentowi wdychanie aerozolu w proszku.
W standardowych warunkach testu in vitro Exubera dostarcza określoną dawkę insuliny z ustnika inhalatora (patrz Tabela 1). Część całkowitej masy cząstek jest emitowana w postaci drobnych cząstek zdolnych do dotarcia do głębokiego płuca. Do 45% zawartości blistra 1 mg i do 25% zawartości blistra 3 mg można zatrzymać w blistrze.
Tabela 1: Nomenklatura dawki i informacje
| Wypełnij mszę (mg proszku) |
Nominalna dawka (mg insuliny) |
Emitowana dawka*,†(mg insuliny) |
Dawka drobnych cząstekdo,†(mg insuliny) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Rzeczywista ilość insuliny dostarczanej do płuc zależy od indywidualnych czynników pacjenta, takich jak profil przepływu wdechowego. In vitro na emitowane wskaźniki aerozolu nie ma wpływu przy prędkości przepływu powyżej 10 l / min.
Top
Farmakologia kliniczna
Mechanizm akcji
Podstawową aktywnością insuliny jest regulacja metabolizmu glukozy. Insulina obniża stężenie glukozy we krwi, stymulując obwodowy wychwyt glukozy przez mięśnie szkieletowe i tłuszcz oraz hamując wątrobowe wytwarzanie glukozy. Insulina hamuje lipolizę w adipocytach, hamuje proteolizę i poprawia syntezę białek.
Farmakokinetyka
Wchłanianie
Exubera dostarcza insulinę przez inhalację doustną. Insulina jest wchłaniana tak szybko, jak podskórnie szybko działające analogi insuliny i szybciej niż podskórnie podawana zwykła ludzka insulina zdrowym osobom i pacjentom z cukrzycą typu 1 lub typu 2 (patrz Ryc. 1).
Rycina 1: Średnie zmiany stężeń wolnej insuliny w surowicy (µU / ml) u pacjentów z cukrzycą typu 2 obserwowanych po Podawanie pojedynczych dawek wziewnej insuliny Exubera (6 mg) i podskórnej regularnej insuliny ludzkiej (18U)
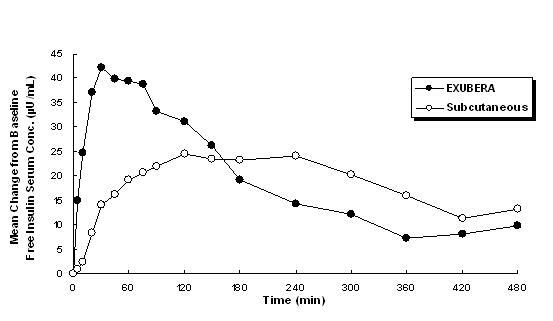
W badaniach klinicznych z udziałem pacjentów z cukrzycą typu 1 i typu 2 po inhalacji produktu Exubera insulina w surowicy osiągała maksymalne stężenie szybciej niż po podskórnym wstrzyknięciu zwykłej ludzkiej insuliny, 49 minut (zakres od 30 do 90 minut) w porównaniu do 105 minut (zakres od 60 do 240 minut), odpowiednio.
W badaniach klinicznych wchłanianie podskórnej regularnej insuliny ludzkiej zmniejszało się wraz ze wzrostem wskaźnika masy ciała pacjenta (BMI). Jednak wchłanianie insuliny po inhalacji Exubera było niezależne od BMI.
W badaniu z udziałem zdrowych osób ogólnoustrojowa ekspozycja na insulinę (AUC i Cmax) po podaniu Exubera zwiększał się wraz z dawką w zakresie od 1 do 6 mg, gdy podawano go w kombinacji 1 i 3 mg pęcherze
W badaniu, w którym postać dawkowania trzech blistrów 1 mg porównywano z jednym blistrem 3 mg, Cmax i AUC po podaniu trzy blistry 1 mg były odpowiednio około 30% i 40% większe niż po podaniu jednego blistra 3 mg (patrz DAWKOWANIE I SPOSÓB PODAWANIA).
Dystrybucja i eliminacja
Ponieważ rekombinowana ludzka insulina jest identyczna z insuliną endogenną, oczekuje się, że ogólnoustrojowa dystrybucja i eliminacja będą takie same. Nie zostało to jednak potwierdzone w przypadku Exubery.
Farmakodynamika
Exubera, podobnie jak podskórnie podawane szybko działające analogi insuliny, ma szybszy początek działania obniżającego stężenie glukozy niż zwykła ludzka insulina podawana podskórnie. U zdrowych ochotników czas działania leku Exubera zmniejszającego stężenie glukozy był porównywalny do podskórnego podawano zwykłą ludzką insulinę i dłużej niż podskórnie szybko działające analogi insuliny (patrz Rysunek 2).
Rysunek 2. Średnia szybkość infuzji glukozy (GIR) znormalizowana do GIRmax dla każdego pacjenta w porównaniu do czasu u zdrowych ochotników
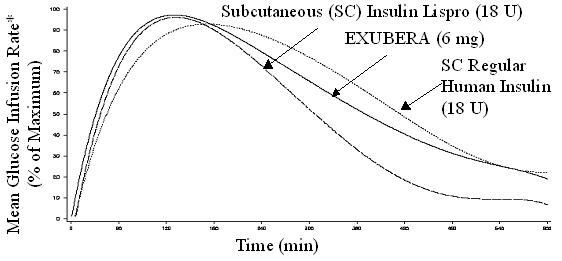
* Określony jako ilość podanej glukozy w celu utrzymania stałego stężenia glukozy w osoczu, znormalizowana do wartości maksymalnych (procent wartości maksymalnych); wskazujący na aktywność insuliny.
Po inhalacji leku Exubera początek działania obniżającego stężenie glukozy u zdrowych ochotników następuje w ciągu 10-20 minut. Maksymalny wpływ na obniżenie poziomu glukozy wywiera około 2 godziny po inhalacji. Czas działania obniżającego stężenie glukozy wynosi około 6 godzin.
U pacjentów z cukrzycą typu 1 lub typu 2 preparat Exubera wykazuje większe działanie obniżające stężenie glukozy w ciągu pierwszych dwóch godzin po podaniu w porównaniu z zwykłą ludzką insuliną podawaną podskórnie.
Zmienność wewnątrzosobnicza działania leku Exubera na obniżenie poziomu glukozy jest na ogół porównywalna z podskórnie podawaną regularną insuliną ludzką u pacjentów z cukrzycą typu 1 i 2.
Specjalne populacje
Pacjenci pediatryczni
U dzieci (6–11 lat) i młodzieży (12–17 lat) z cukrzycą typu 1 czas do osiągnięcia maksymalnego stężenia insuliny w preparacie Exubera wynosił osiągane szybciej niż w przypadku podskórnej regularnej insuliny ludzkiej, co jest zgodne z obserwacjami u dorosłych pacjentów z typem 1 cukrzyca.
Pacjenci w podeszłym wieku
Nie ma widocznych różnic we właściwościach farmakokinetycznych produktu Exubera w porównaniu pacjentów w wieku powyżej 65 lat i młodszych dorosłych pacjentów.
Płeć
U pacjentów z cukrzycą i bez cukrzycy nie zaobserwowano widocznych różnic we właściwościach farmakokinetycznych produktu Exubera między kobietami i mężczyznami.
Wyścigi
Przeprowadzono badanie u 25 zdrowych osób rasy białej i japońskiej bez cukrzycy w celu porównania właściwości farmakokinetyczne i farmakodynamiczne produktu Exubera w porównaniu z podskórnym wstrzyknięciem zwykłego człowieka insulina. Właściwości farmakokinetyczne i farmakodynamiczne produktu Exubera były porównywalne w obu populacjach.
Otyłość
Wchłanianie produktu Exubera jest niezależne od BMI pacjenta.
Zaburzenia czynności nerek
Wpływ zaburzeń czynności nerek na farmakokinetykę Exubera nie był badany. U pacjentów z zaburzeniami czynności nerek może być konieczne dokładne monitorowanie stężenia glukozy i dostosowanie dawki insuliny (patrz ŚRODKI OSTROŻNOŚCI, Zaburzenia czynności nerek).
Zaburzenia czynności wątroby
Wpływ zaburzeń czynności wątroby na farmakokinetykę produktu Exubera nie był badany. U pacjentów z zaburzeniami czynności wątroby konieczne może być dokładne monitorowanie stężenia glukozy i dostosowanie dawki insuliny (patrz ŚRODKI OSTROŻNOŚCI).
Ciąża
Wchłanianie produktu Exubera u pacjentek w ciąży z cukrzycą typu 2 w ciąży i przed ciążą było zgodne z wchłanianiem u pacjentów w ciąży z cukrzycą typu 2 (patrz ŚRODKI OSTROŻNOŚCI).
Palenie
U palaczy oczekuje się, że ogólnoustrojowa ekspozycja na insulinę dla Exubery będzie 2 do 5 razy większa niż u osób niepalących. Exubera jest przeciwwskazana u pacjentów, którzy palą lub przestali palić mniej niż 6 miesięcy przed rozpoczęciem leczenia produktem Exubera. Jeśli pacjent rozpocznie lub wznowi palenie, należy natychmiast przerwać stosowanie leku Exubera ze względu na zwiększone ryzyko hipoglikemii i zastosować alternatywne leczenie (patrz PRZECIWWSKAZANIA).
W badaniach klinicznych produktu Exubera u 123 pacjentów (z których 69 było palaczami), palacze doświadczyli szybszego początku działania obniżającego stężenie glukozy, większy maksymalny efekt i większy całkowity efekt obniżania glukozy (szczególnie w ciągu pierwszych 2-3 godzin po podaniu) w porównaniu do osoby niepalące.
Pasywny dym papierosowy
W przeciwieństwie do wzrostu ekspozycji na insulinę po aktywnym paleniu, gdy Exubera podano 30 zdrowym ochotnikom, którzy nie palili, po 2 godziny narażenia na bierny dym papierosowy w kontrolowanych warunkach eksperymentalnych, AUC i Cmax insuliny zostały zmniejszone o około 20% i 30%, odpowiednio. Farmakokinetyka produktu Exubera nie była badana u osób niepalących, które są przewlekle narażone na bierny dym papierosowy.
Pacjenci z podstawowymi chorobami płuc
Stosowanie produktu Exubera u pacjentów z chorobą płuc, taką jak astma lub POChP, nie jest zalecane, ponieważ nie określono bezpieczeństwa i skuteczności produktu Exubera w tej populacji (patrz OSTRZEŻENIA). Stosowanie produktu Exubera jest przeciwwskazane u pacjentów z niestabilną lub źle kontrolowaną chorobą płuc, ze względu na szeroki zakres zmiany czynności płuc, które mogą wpływać na wchłanianie produktu Exubera i zwiększać ryzyko hipoglikemii lub hiperglikemia (patrz PRZECIWWSKAZANIA).
W badaniu farmakokinetycznym u 24 pacjentów bez cukrzycy z łagodną astmą wchłanianie insuliny po podaniu Exubera, przy braku leczenia lekiem rozszerzającym oskrzela, była o około 20% niższa niż wchłanianie obserwowane u osób bez astma. Jednak w badaniu z udziałem 24 pacjentów bez cukrzycy z przewlekłą obturacyjną chorobą płuc (POChP) ekspozycja po podaniu produktu Exubera była około dwa razy wyższa niż u zdrowych osób bez POChP (patrz ŚRODKI OSTROŻNOŚCI).
Podawanie albuterolu 30 minut przed podaniem preparatu Exubera osobom bez cukrzycy z łagodną astmą (n = 36) i umiarkowaną astma (n = 31) spowodowała średni wzrost wartości AUC i Cmax insuliny między 25 a 50% w porównaniu do tego, kiedy Exubera był podawany sam (patrz ŚRODKI OSTROŻNOŚCI).
Top
Studia kliniczne
Bezpieczeństwo i skuteczność produktu Exubera badano u około 2500 dorosłych pacjentów z cukrzycą typu 1 i typu 2. Podstawowym parametrem skuteczności w większości badań była kontrola glikemii, mierzona na podstawie zmniejszenia poziomu hemoglobiny A1c (HbA1c) od wartości wyjściowej.
Cukrzyca typu 1
24-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie A) przeprowadzono u pacjentów z cukrzycą typu 1 w celu oceny bezpieczeństwa i skuteczności Exubera podawana przed posiłkiem trzy razy dziennie (TID) z pojedynczym nocnym wstrzyknięciem Humulin® U Ultralente® (zawiesina cynku z wydłużoną insuliną ludzką) (n = 136). Leczeniem porównawczym była podskórna regularna insulina ludzka podawana dwa razy dziennie (BID) (przed śniadaniem i przed kolacją) z zastrzykiem BID ludzkiej insuliny NPH (zawiesina izofanu ludzkiej insuliny) (n = 132). W tym badaniu średni wiek wynosił 38,2 lat (zakres: 20–64), a 52% badanych stanowili mężczyźni.
Drugie 24-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie B) przeprowadzono u pacjentów z cukrzycą typu 1 w celu oceny bezpieczeństwo i skuteczność produktu Exubera (n = 103) w porównaniu z podskórną regularną insuliną ludzką (n = 103), gdy podawano TID przed posiłki. W obu ramionach leczenia insulinę ludzką NPH podawano BID (rano i przed snem) jako insulinę podstawową. W tym badaniu średni wiek wynosił 38,4 lat (zakres: 19–65 lat), a 54% badanych stanowili mężczyźni.
W każdym badaniu zmniejszenie HbA1c i częstości hipoglikemii były porównywalne dla dwóch grup leczenia. U pacjentów leczonych produktem Exubera stwierdzono większe zmniejszenie stężenia glukozy w osoczu na czczo niż u pacjentów z grupy porównawczej. Odsetek pacjentów, którzy osiągnęli poziom HbA1c <8% (na akcję terapeutyczną American Diabetes Association) Poziom w momencie prowadzenia badania) i poziom HbA1c <7% był porównywalny między dwiema grupami leczenia. Wyniki badań A i B pokazano w tabeli 2.
Tabela 2: Wyniki dwóch 24-tygodniowych badań z aktywną kontrolą i otwartymi badaniami u pacjentów z cukrzycą typu 1 (badania A i B)
| Studium A | Studium B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Wielkość próbki | 136 | 132 | 103 | 103 |
| UL = Humulin® U Ultralente®; SC R = zwykła ludzka insulina podskórna | ||||
| ||||
| HbA1c (%) | ||||
| Średnia wyjściowa | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera minus SC R* | 0.14 | -0.11 | ||
| 95% CI dla różnicy w leczeniu | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Glukoza w osoczu na czczo (mg / dL) | ||||
| Średnia wyjściowa | 191 | 198 | 178 | 191 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -32 | -6 | -23 | 13 |
| Exubera minus SC R | -27 | -35 | ||
| 95% CI dla różnicy w leczeniu | (-47, -6) | (-58, -13) | ||
| 2-godzinne poposiłkowe stężenie glukozy (mg / dl) | ||||
| Średnia wyjściowa | 283 | 305 | 273 | 293 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -21 | 14 | -1 | -3 |
| Exubera minus SC R | -35 | 2 | ||
| 95% CI dla różnicy w leczeniu | (-61, -8) | (-29, 32) | ||
| Pacjenci z HbA na końcu badania1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Pacjenci z HbA na końcu badania1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Masy ciała | ||||
| Średnia początkowa (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. średnia zmiana od wartości początkowej (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera minus SC R | -0.72 | -0.24 | ||
| 95% CI dla różnicy w leczeniu | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Koniec badania dzienna dawka insuliny | ||||
| Insulina krótko działająca | 13,4 mgdo | 18,3 IU | 10,9 mgdo | 25,7 IU |
| Insulina długo działająca | 26,4 IU | 37,1 IU | 31,5 j.m. | 31,9 IU |
Cukrzyca typu 2
Monoterapia u pacjentów, którzy nie są optymalnie kontrolowani za pomocą diety i ćwiczeń fizycznych
Przeprowadzono 12-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie C) u pacjentów z cukrzycą typu 2 nie optymalnie kontrolowane dietą i ćwiczeniami, oceniając bezpieczeństwo i skuteczność przed posiłkiem TID Exubera (n = 75) w porównaniu do środek uwrażliwiający na insulinę. W tym badaniu średni wiek wynosił 53,7 lat (zakres: 28–80), 55% badanych stanowili mężczyźni, a średni wskaźnik masy ciała wyniósł 32,3 kg / m2.
Po 12 tygodniach HbA1c poziomy u pacjentów leczonych produktem Exubera zmniejszyły się o 2,2% (SD = 1,0) w stosunku do wartości wyjściowej wynoszącej 9,5% (SD = 1,1). Odsetek pacjentów leczonych produktem Exubera, którzy osiągnęli HbA na końcu badania1c poziom <8% wzrósł do 82,7%. Odsetek pacjentów leczonych produktem Exubera, którzy osiągnęli HbA na końcu badania1c poziom
Monoterapia i terapia dodatkowa u pacjentów wcześniej leczonych doustnie
U pacjentów z typem przeprowadzono 12-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie D) 2 cukrzyca, która obecnie jest leczona, ale była słabo kontrolowana za pomocą dwóch leków doustnych (OA). Wyjściowe OA obejmowały lek wydzielający insulinę oraz metforminę lub tiazolidynodion. Pacjentów przydzielono losowo do jednego z trzech ramion: kontynuacja samej terapii OA (n = 96), zmiana na przed posiłkiem TID Exubera monoterapia (n = 102) lub dodanie przed posiłkiem TID Exubera do kontynuacji leczenia OA (n = 100). W tym badaniu średni wiek wynosił 57,4 lat (zakres: 33–80), 66% badanych stanowili mężczyźni, a średni wskaźnik masy ciała wynosił 30 kg / m2.
Exubera w monoterapii i Exubera w połączeniu z terapią OA przewyższały samą terapię OA pod względem zmniejszania HbA1c poziomy od linii podstawowej. Odsetki hipoglikemii w dwóch grupach leczonych preparatem Exubera były nieco wyższe niż w grupie leczonej wyłącznie OA. W porównaniu z samą terapią OA odsetek pacjentów osiągających HbA1c poziom <8% (według poziomu działania leczenia Amerykańskiego Stowarzyszenia Diabetologicznego w czasie prowadzenia badania) i HbA1c poziom <7% był wyższy u pacjentów leczonych preparatem Exubera w monoterapii i produktem Exubera w połączeniu z terapią OA. Pacjenci w obu grupach leczonych produktem Exubera mieli większe zmniejszenie stężenia glukozy w osoczu na czczo niż pacjenci leczeni samą terapią OA. Wyniki badania D przedstawiono w tabeli 3.
Tabela 3: Wyniki 12-tygodniowej, aktywnej kontroli, próby otwartej z udziałem pacjentów z cukrzycą typu 2, którzy nie są optymalnie kontrolowani za pomocą podwójnej doustnej terapii (badanie D)
| Studium D | Monoterapia Exubera | OAs* | Exubera + OAs |
|---|---|---|---|
| Wielkość próbki | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Średnia wyjściowa | 9.3 | 9.3 | 9.2 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -1.4 | -0.2 | -1.9 |
| Grupa Exubera minus OAs†| -1.18†,do, § | -1.67†, ¶, § | |
| 95% CI dla różnicy w leczeniu | (-1.41, -0.95) | (-1.90, -1.44) | |
| Glukoza w osoczu na czczo (mg / dL) | |||
| Średnia wyjściowa | 203 | 203 | 195 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -23 | 1 | -53 |
| Grupa Exubera minus OAs | -24do | -53 ¶ | |
| 95% CI dla różnicy w leczeniu | (-36, -11) | (-66, -41) | |
| Pacjenci z HbA na końcu badania1c < 8%# | 55.9% | 18.8% | 86.0% |
| Pacjenci z HbA na końcu badania1c < 7% | 16.7% | 1.0% | 32.0% |
| Masy ciała | |||
| Średnia początkowa (kg) | 89.5 | 88.0 | 88.6 |
| Adj. średnia zmiana od wartości początkowej (kg) | 2.8 | 0.0 | 2.7 |
| Grupa Exubera minus OAs | 2.80do | 2.75 ¶ | |
| 95% CI dla różnicy w leczeniu | (1.94, 3.65) | (1.89, 3.61) |
Przeprowadzono 24-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie E) u pacjentów z cukrzycą typu 2, obecnie leczonych pochodną sulfonylomocznika. To badanie zostało zaprojektowane w celu oceny bezpieczeństwa i skuteczności dodania przed posiłkiem Exubera do kontynuacji terapia pochodną sulfonylomocznika (n = 214) w porównaniu z dodaniem metforminy przed posiłkiem do kontynuowanej terapii pochodną sulfonylomocznika (n = 196). Osobników stratyfikowano według ich HbA1c w tygodniu -1. Zdefiniowano dwie warstwy: niską warstwę HbA1c (HbA1c ¥ â 8% do ‰ .59,5%) i wysokie HbA1c warstwa (HbA1c > 9,5 do â ‰ ¤ 12%).
Exubera w połączeniu z pochodną sulfonylomocznika przewyższała metforminę i pochodną sulfonylomocznika pod względem obniżania wartości HbA1c w stosunku do wartości wyjściowej w grupie o wysokiej warstwie. Exubera w połączeniu z pochodną sulfonylomocznika była porównywalna z metforminą w połączeniu z pochodną sulfonylomocznika pod względem obniżania wartości HbA1c w stosunku do wartości wyjściowej w grupie o niskiej warstwie. Wskaźnik hipoglikemii był wyższy po dodaniu Exubera do pochodnej sulfonylomocznika niż po dodaniu metforminy do pochodnej sulfonylomocznika. Odsetek pacjentów osiągających docelowe wartości HbA1c wynoszące 8% i 7% był porównywalny między grupami terapeutycznymi w obu warstwach, podobnie jak zmniejszenie stężenia glukozy w osoczu na czczo (patrz Tabela 4).
Kolejne 24-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie F) przeprowadzono u pacjentów z cukrzycą typu 2, aktualnie leczonych metforminą. To badanie zostało zaprojektowane w celu oceny bezpieczeństwa i skuteczności dodania przed posiłkiem Exubera do kontynuacji leczenie metforminą (n = 234) w porównaniu z dodaniem glibenklamidu przed posiłkiem do kontynuacji leczenia metforminą (n = 222). Badani w tym badaniu zostali także stratyfikowani do jednej z dwóch warstw określonych w badaniu E.
Exubera w połączeniu z metforminą była lepsza niż glibenklamid i metformina w zmniejszaniu HbA1c wartości od wartości wyjściowej i osiągnięcia docelowego HbA1c wartości w grupie o wysokiej warstwie. Exubera w połączeniu z metforminą była porównywalna do glibenklamidu w połączeniu z metforminą w zmniejszaniu HbA1c wartości od wartości wyjściowej i osiągnięcia docelowego HbA1c wartości w grupie o niskiej warstwie. Wskaźnik hipoglikemii był nieco wyższy po dodaniu produktu Exubera do metforminy niż po dodaniu glibenklamidu do metforminy. Zmniejszenie stężenia glukozy w osoczu na czczo było porównywalne między grupami leczenia (patrz Tabela 4).
Tabela 4: Wyniki dwóch 24-tygodniowych badań z aktywną kontrolą, otwartych badań u pacjentów z cukrzycą typu 2 wcześniej leczonych doustnie (terapia E i F)
| Studium E | Studium F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Spotkał*+ SU* | Exubera + SU* | Spotkał*+ SU* | Exubera + Met* | Gli* + Spełnione* | Exubera + Met* | Gli* + Spełnione* | |
| Wysoka warstwa†| Niska warstwa†| Wysoka warstwa†| Niska warstwa†| |||||
| Wielkość próbki | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Średnia wyjściowa | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera minus OAdo | -0.38do, § | -0.07 | -0.37do, ¶ | 0.04 | ||||
| 95% CI dla różnicy w leczeniu | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Glukoza w osoczu na czczo (mg / dL) | ||||||||
| Średnia wyjściowa | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Średnia zmiana w stosunku do wartości początkowej | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera minus OA | 1 | 4 | -2 | 4 | ||||
| 95% CI dla różnicy w leczeniu | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Pacjenci z HbA na końcu badania1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Pacjenci z HbA na końcu badania1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Masy ciała | ||||||||
| Średnia początkowa (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. średnia zmiana od wartości początkowej (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera minus OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% CI dla różnicy w leczeniu | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Stosowanie u pacjentów wcześniej leczonych insuliną podskórną
24-tygodniowe, randomizowane, otwarte badanie z aktywną kontrolą (badanie G) przeprowadzono u pacjentów leczonych insuliną z typem 2 cukrzyca w celu oceny bezpieczeństwa i skuteczności produktu Exubera podawanego przed posiłkiem TID z pojedynczym nocnym zastrzykiem Humulin® U Ultralente® (n = 146) w porównaniu z podskórną regularną insuliną ludzką podawaną BID (przed śniadaniem i przed kolacją) z zastrzykiem BID ludzkiej insuliny NPH (n = 149). W tym badaniu średni wiek wynosił 57,5 lat (zakres: 23–80), 66% badanych stanowili mężczyźni, a średni wskaźnik masy ciała wynosił 30,3 kg / m2.
Redukcje w stosunku do wartości wyjściowej HbA1c, procent pacjentów osiągających HbA1c poziom <8% (według poziomu działania leczenia Amerykańskiego Stowarzyszenia Diabetologicznego w czasie prowadzenia badania) i HbA1c poziom <7%, a także wskaźniki hipoglikemii były podobne między grupami leczenia. U pacjentów leczonych produktem Exubera stwierdzono większe zmniejszenie stężenia glukozy w osoczu na czczo niż u pacjentów z grupy porównawczej. Wyniki badania G przedstawiono w tabeli 5.
Tabela 5: Wyniki 24-tygodniowego badania z aktywną kontrolą, otwartego badania u pacjentów z cukrzycą typu 2 wcześniej leczonych podskórną insuliną (badanie G)
| Studium G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Wielkość próbki | 146 | 149 |
| UL = Humulin® U Ultralente®; SC R = zwykła ludzka insulina podskórna | ||
| ||
| HbA1c (%) | ||
| Średnia wyjściowa | 8.1 | 8.2 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -0.7 | -0.6 |
| Exubera minus SC R* | -0.07 | |
| 95% CI dla różnicy w leczeniu | (-0.31, 0.17) | |
| Glukoza w osoczu na czczo (mg / dL) | ||
| Średnia wyjściowa | 152 | 159 |
| Adj. średnia zmiana w stosunku do wartości początkowej | -22 | -6 |
| Exubera minus SC R | -16.36 | |
| 95% CI dla różnicy w leczeniu | (-27.09, -5.36) | |
| Pacjenci z HbA na końcu badania1c < 8%†| 76.0% | 69.1% |
| Pacjenci z HbA na końcu badania1c < 7% | 45.2% | 32.2% |
| Masy ciała | ||
| Średnia początkowa (kg) | 90.6 | 89.0 |
| Adj. średnia zmiana od wartości początkowej (kg) | 0.1 | 1.3 |
| Exubera minus SC R | -1.28 | |
| 95% CI dla różnicy w leczeniu | (-1.96, -0.60) | |
| Koniec badania dzienna dawka insuliny | ||
| Insulina krótko działająca | 16,6 mgdo | 25,5 IU |
| Insulina długo działająca | 37,9 IU | 52,3 IU |
Top
Wskazania i zastosowanie
Exubera jest wskazana w leczeniu dorosłych pacjentów z cukrzycą w celu kontroli hiperglikemii. Exubera ma początek działania podobny do szybko działających analogów insuliny i ma czas działania obniżającego poziom glukozy porównywalny z podskórnie podawaną zwykłą insuliną ludzką. U pacjentów z cukrzycą typu 1 preparat Exubera należy stosować w schematach obejmujących insulinę dłużej działającą. U pacjentów z cukrzycą typu 2 Exubera może być stosowana w monoterapii lub w skojarzeniu ze środkami doustnymi lub insulinami o dłuższym działaniu.
Top
Przeciwwskazania
Exubera jest przeciwwskazana u pacjentów nadwrażliwych na Exubera lub jedną z jej substancji pomocniczych.
Exubera jest przeciwwskazana u pacjentów, którzy palą lub przestali palić mniej niż 6 miesięcy przed rozpoczęciem leczenia produktem Exubera. Jeśli pacjent rozpocznie lub wznowi palenie, należy natychmiast przerwać stosowanie leku Exubera ze względu na zwiększone ryzyko hipoglikemii i zastosować alternatywne leczenie (patrz FARMAKOLOGIA KLINICZNA, populacje specjalne, palenie tytoniu). Bezpieczeństwo i skuteczność produktu Exubera u pacjentów palących nie zostały ustalone.
Exubera jest przeciwwskazana u pacjentów z niestabilną lub słabo kontrolowaną chorobą płuc, ze względu na duże zróżnicowanie w czynności płuc, które mogą wpływać na wchłanianie Exubera i zwiększać ryzyko hipoglikemii lub hiperglikemia.
Top
Ostrzeżenia
Exubera różni się od zwykłej ludzkiej insuliny szybkim początkiem działania. W przypadku stosowania jako insuliny posiłkowej dawkę leku Exubera należy podać w ciągu 10 minut przed posiłkiem.
Hipoglikemia jest najczęściej zgłaszanym działaniem niepożądanym insulinoterapii, w tym Exubera. Czas hipoglikemii może być różny dla różnych postaci insuliny.
Pacjenci z cukrzycą typu 1 wymagają również insuliny o dłuższym działaniu, aby utrzymać odpowiednią kontrolę glukozy.
Każda zmiana insuliny powinna być dokonywana ostrożnie i wyłącznie pod nadzorem lekarza. Zmiany siły insuliny, producenta, typu (np. Zwykłe, NPH, analogi) lub gatunku (zwierzę, człowiek) mogą powodować potrzebę zmiany dawki. Konieczne może być dostosowanie jednoczesnego doustnego leczenia przeciwcukrzycowego.
Zaleca się monitorowanie stężenia glukozy u wszystkich pacjentów z cukrzycą.
Ze względu na wpływ preparatu Exubera na czynność płuc, przed rozpoczęciem leczenia produktem Exubera należy ocenić czynność płuc (patrz ŚRODKI OSTROŻNOŚCI: Funkcja płuc).
Stosowanie produktu Exubera u pacjentów z chorobą płuc, taką jak astma lub POChP, nie jest zalecane, ponieważ nie określono bezpieczeństwa i skuteczności produktu Exubera w tej populacji (patrz ŚRODKI OSTROŻNOŚCI: Leżąca u podstaw choroba płuc).
W badaniach klinicznych preparatu Exubera stwierdzono 6 nowo zdiagnozowanych przypadków pierwotnych nowotworów płuc u pacjentów leczonych produktem Exubera oraz 1 nowo zdiagnozowany przypadek wśród pacjentów leczonych lekiem porównawczym. Zgłoszono również 1 raport o wprowadzeniu do obrotu pierwotnego nowotworu płuc u pacjenta leczonego produktem Exubera. W kontrolowanych badaniach klinicznych produktu Exubera częstość występowania nowego pierwotnego raka płuca na 100 pacjento-lat ekspozycji na badany lek wynosiła 0,13 (5 przypadków powyżej 3900 pacjento-lat) dla pacjentów leczonych produktem Exubera i 0,02 (1 przypadek na 4100 pacjento-lat) dla pacjentów leczonych lekiem porównawczym. Było zbyt mało przypadków, aby ustalić, czy pojawienie się tych zdarzeń jest związane z produktem Exubera. Wszyscy pacjenci, u których zdiagnozowano raka płuc, mieli w przeszłości palenie papierosów.
Top
Środki ostrożności
Generał
Podobnie jak w przypadku wszystkich preparatów insuliny, przebieg działania leku Exubera może być różny u różnych osób lub w różnych momentach u tej samej osoby. Dostosowanie dawki jakiejkolwiek insuliny może być konieczne, jeśli pacjenci zmienią aktywność fizyczną lub zwykły plan posiłków. Zapotrzebowanie na insulinę może ulec zmianie w warunkach towarzyszących, takich jak choroba, zaburzenia emocjonalne lub stres.
Hipoglikemia
Podobnie jak w przypadku wszystkich preparatów insuliny, reakcje hipoglikemiczne mogą być związane z podaniem leku Exubera. Gwałtowne zmiany stężenia glukozy w surowicy mogą wywoływać objawy podobne do hipoglikemii u osób z cukrzycą, niezależnie od wartości glukozy. Wczesne ostrzeżenie objawy hipoglikemii mogą być różne lub mniej wyraźne w pewnych warunkach, takich jak długi czas trwania cukrzycy, choroby nerwu cukrzycowego, stosowanie leków takich jak beta-adrenolityki lub wzmożona kontrola cukrzycy (widzieć ŚRODKI OSTROŻNOŚCI: Interakcje z lekami). Takie sytuacje mogą powodować ciężką hipoglikemię (i być może utratę przytomności) przed uświadomieniem pacjentom hipoglikemii.
Zaburzenia czynności nerek
Nie przeprowadzono badań u pacjentów z zaburzeniami czynności nerek. Podobnie jak w przypadku innych preparatów insuliny, wymagania dotyczące dawki produktu Exubera mogą być zmniejszone u pacjentów z zaburzeniami czynności nerek (patrz FARMAKOLOGIA KLINICZNA, Specjalne populacje).
Zaburzenia czynności wątroby
Nie przeprowadzono badań u pacjentów z zaburzeniami czynności wątroby. Podobnie jak w przypadku innych preparatów insuliny, wymagania dotyczące dawki produktu Exubera mogą być zmniejszone u pacjentów z zaburzeniami czynności wątroby (patrz FARMAKOLOGIA KLINICZNA, Specjalne populacje).
Alergia
Alergia układowa
W badaniach klinicznych ogólna częstość występowania reakcji alergicznych u pacjentów leczonych produktem Exubera była podobna do tej u pacjentów stosujących schematy podskórne z regularną insuliną ludzką.
Podobnie jak w przypadku innych preparatów insulinowych może wystąpić rzadka, ale potencjalnie poważna, uogólniona alergia na insulinę, co może powodować wysypka (w tym świąd) na całym ciele, duszność, świszczący oddech, obniżenie ciśnienia krwi, szybki puls lub wyzysk. Ciężkie przypadki uogólnionej alergii, w tym reakcje anafilaktyczne, mogą zagrażać życiu. Jeśli takie reakcje wystąpią w przypadku Exubera, należy przerwać Exubera i rozważyć alternatywne metody leczenia.
Produkcja przeciwciał
Przeciwciała przeciwko insulinie mogą rozwinąć się podczas leczenia wszystkimi preparatami insuliny, w tym Exubera. W badaniach klinicznych preparatu Exubera, w których lekiem porównawczym była insulina podskórna, wzrost poziomu przeciwciał przeciw insulinie (co odzwierciedlają testy aktywność wiązania insuliny) była istotnie większa u pacjentów otrzymujących Exubera niż u pacjentów, którzy otrzymywali insulinę podskórną tylko. W okresie badań klinicznych produktu Exubera nie zidentyfikowano żadnych klinicznych konsekwencji tych przeciwciał; jednak długoterminowe znaczenie kliniczne tego wzrostu wytwarzania przeciwciał nie jest znane.
Oddechowy
Funkcja płuc
W badaniach klinicznych trwających do dwóch lat pacjenci leczeni produktem Exubera wykazywali większy spadek czynności płuc, konkretnie objętość wymuszonej wydechu w ciągu jednej sekundy (FEV1) i zdolność dyfuzyjną tlenku węgla (DLCO), niż w przypadku traktowania komparatorem pacjenci Odnotowano średnią różnicę w grupie terapeutycznej w funkcji płuc na korzyść grupy porównawczej pierwsze kilka tygodni leczenia produktem Exubera i nie zmieniło się w ciągu dwuletniego okresu leczenia (Widzieć DZIAŁANIA NIEPOŻĄDANE: Funkcja płuc).
Podczas kontrolowanych badań klinicznych u poszczególnych pacjentów zaobserwowano znaczny spadek czynności płuc w obu grupach leczenia. Spadek w stosunku do wartości wyjściowej FEV1 o 20% podczas ostatniej obserwacji wystąpił u 1,5% pacjentów leczonych produktem Exubera i 1,3% pacjentów leczonych lekiem porównawczym. Spadek w stosunku do wartości wyjściowej DLWSPÓŁ 20% z ostatniej obserwacji wystąpiło u 5,1% pacjentów leczonych produktem Exubera i 3,6% pacjentów leczonych lekiem porównawczym.
Ze względu na wpływ preparatu Exubera na czynność płuc, przed rozpoczęciem leczenia produktem Exubera należy zbadać spirometrię (FEV1). Ocena DLWSPÓŁ powinno być wzięte pod uwagę. Skuteczność i bezpieczeństwo produktu Exubera u pacjentów z początkowym FEV1 lub DLWSPÓŁ Nie ustalono <70% prognoz i nie zaleca się stosowania produktu Exubera w tej populacji.
Ocena czynności płuc (np. Spirometria) jest zalecana po pierwszych 6 miesiącach leczenia, a następnie co roku, nawet przy braku objawów płucnych. U pacjentów ze spadkiem FEV1 o 20% w stosunku do wartości wyjściowej należy powtórzyć testy czynnościowe płuc. Jeśli zostanie potwierdzony spadek o 20% w stosunku do wartości początkowej FEV1, należy przerwać stosowanie produktu Exubera. Obecność objawów płucnych i mniejszy spadek czynności płuc może wymagać częstszego monitorowania czynności płuc i rozważenia przerwania leczenia produktem Exubera.
Zasadnicza choroba płuc
Stosowanie produktu Exubera u pacjentów z chorobą płuc, taką jak astma lub POChP, nie jest zalecane, ponieważ nie określono skuteczności i bezpieczeństwa produktu Exubera w tej populacji.
Skurcz oskrzeli
Rzadko zgłaszano skurcz oskrzeli u pacjentów przyjmujących Exubera. Pacjenci, u których wystąpi taka reakcja, powinni przerwać stosowanie leku Exubera i niezwłocznie zgłosić się do lekarza. Ponowne podanie produktu Exubera wymaga starannej oceny ryzyka i powinno odbywać się wyłącznie pod ścisłym nadzorem medycznym przy pomocy odpowiednich placówek klinicznych.
Współistniejące choroby układu oddechowego
Exubera była podawana pacjentom z współistniejącymi chorobami układu oddechowego (np. Zapaleniem oskrzeli, infekcjami górnych dróg oddechowych, nieżytem nosa) podczas badań klinicznych. U pacjentów, u których występują te schorzenia, 3-4% czasowo przerwało leczenie produktem Exubera. Nie stwierdzono zwiększonego ryzyka hipoglikemii ani pogorszenia kontroli glikemii u pacjentów leczonych produktem Exubera w porównaniu do pacjentów leczonych insuliną podskórną. Podczas współistniejących chorób układu oddechowego może być konieczne ścisłe monitorowanie stężenia glukozy we krwi i dostosowanie dawki.
Informacje dla pacjentów
Pacjentów należy pouczyć o procedurach samozarządzania, w tym o monitorowaniu stężenia glukozy; właściwa technika inhalacji Exubera; oraz zarządzanie hipoglikemią i hiperglikemią. Pacjentów należy poinstruować, jak radzić sobie w szczególnych sytuacjach, takich jak warunki współistniejące (choroba, stres lub emocje) zaburzenia), nieodpowiednia lub pominięta dawka insuliny, nieumyślne podanie zwiększonej dawki insuliny, nieodpowiednie spożycie pokarmu lub pominięte posiłki.
Pacjentów należy poinformować, że w badaniach klinicznych leczenie produktem Exubera wiązało się z niewielkim, nie postępującym średnim spadkiem czynności płuc w porównaniu z leczeniem lekiem porównawczym. Ze względu na wpływ preparatu Exubera na czynność płuc zaleca się przeprowadzenie testów czynnościowych płuc przed rozpoczęciem leczenia produktem Exubera. Po rozpoczęciu leczenia zalecane są okresowe testy czynnościowe płuc (patrz ŚRODKI OSTROŻNOŚCI Układ oddechowy, płucny).
Pacjenci powinni poinformować lekarza, jeśli w przeszłości występowali u nich choroby płuc, ponieważ nie zaleca się stosowania leku Exubera pacjenci z chorobą płuc (np. astmą lub POChP) i jest przeciwwskazany u pacjentów ze słabo kontrolowanym płucem choroba.
Kobiety z cukrzycą powinny zostać poinformowane o konieczności poinformowania lekarza, jeśli są w ciąży lub planują ciążę.
Top
Interakcje z lekami
Wiele substancji wpływa na metabolizm glukozy i może wymagać dostosowania dawki insuliny oraz szczególnie ścisłego monitorowania.
Poniżej podano przykłady substancji, które mogą zmniejszać działanie insuliny na obniżenie poziomu glukozy we krwi, co może powodować hiperglikemię: kortykosteroidy, danazol, diazoksyd, leki moczopędne, środki sympatykomimetyczne (np. epinefryna, albuterol, terbutalina), glukagon, izoniazyd, pochodne fenotiazyny, somatropina, hormony tarczycy, estrogeny, progestageny (np. doustne środki antykoncepcyjne), inhibitory proteazy i atypowe leki przeciwpsychotyczne (np. olanzapina i klozapina).
Poniżej podano przykłady substancji, które mogą nasilać działanie insuliny na obniżenie poziomu glukozy we krwi i podatność na hipoglikemię: doustnie produkty przeciwcukrzycowe, inhibitory ACE, dizopiramid, fibraty, fluoksetyna, inhibitory MAO, pentoksyfilina, propoksyfen, salicylany i sulfonamid antybiotyki
Beta-adrenolityki, klonidyna, sole litu i alkohol mogą zwiększać lub zmniejszać działanie insuliny na obniżenie poziomu glukozy we krwi. Pentamidyna może powodować hipoglikemię, po której czasami może wystąpić hiperglikemia.
Ponadto pod wpływem sympatykolitycznych produktów leczniczych, takich jak beta-adrenolityki, klonidyna, guanetydyna i rezerpina, objawy hipoglikemii mogą być zmniejszone lub nieobecne.
Leki rozszerzające oskrzela i inne produkty wdychane mogą zmieniać wchłanianie wdychanej insuliny ludzkiej (patrz FARMAKOLOGIA KLINICZNA, Specjalne populacje). Zaleca się spójne podawanie dawek leków rozszerzających oskrzela w stosunku do podawania produktu Exubera, ścisłe monitorowanie stężeń glukozy we krwi i odpowiednie dostosowywanie dawki.
Rakotwórczość, mutageneza, upośledzenie płodności
Nie przeprowadzono dwuletnich badań rakotwórczości na zwierzętach. Insulina nie wykazywała działania mutagennego w teście odwrotnej mutacji bakteryjnej Amesa w obecności i przy braku aktywacji metabolicznej.
U szczurów Sprague-Dawley przeprowadzono 6-miesięczne badanie toksyczności po podaniu wielokrotnym z użyciem proszku do inhalacji insuliny w dawkach do 5,8 mg / kg / dobę (w porównaniu z klinicznym dawka początkowa 0,15 mg / kg / dzień, wysoka dawka dla szczurów była 39 razy lub 8,3 razy większa niż dawka kliniczna, na podstawie porównania mg / kg lub mg / m2 powierzchni ciała). U małp Cynomolgus przeprowadzono 6-miesięczne badanie toksyczności po podaniu wielokrotnym z inhalowaną insuliną w dawkach do 0,64 mg / kg / dobę. W porównaniu z kliniczną dawką początkową wynoszącą 0,15 mg / kg / dzień, wysoka dawka dla małpy była 4,3 razy lub 1,4 razy większa niż dawka kliniczna, w oparciu o porównanie mg / kg lub mg / m2 powierzchni ciała. Były to maksymalne tolerowane dawki oparte na hipoglikemii.
W porównaniu ze zwierzętami kontrolnymi, nie zaobserwowano żadnych działań niepożądanych związanych z leczeniem u żadnego gatunku na czynność płuc, ogólną lub mikroskopową morfologię dróg oddechowych lub węzłów chłonnych oskrzeli. Podobnie nie stwierdzono wpływu na wskaźniki proliferacji komórek w obszarze pęcherzykowym lub oskrzelowym płuca u żadnego gatunku.
Ponieważ rekombinowana ludzka insulina jest identyczna z hormonem endogennym, badań rozrodczości / płodności nie przeprowadzono na zwierzętach.
Ciąża
Efekty teratogenne
Kategoria ciąży C
Nie przeprowadzono badań dotyczących rozmnażania zwierząt z produktem Exubera. Nie wiadomo również, czy Exubera może powodować uszkodzenie płodu, gdy jest podawana kobiecie w ciąży, czy Exubera może wpływać na zdolności rozrodcze. Exubera powinna być podawana kobiecie w ciąży tylko wtedy, gdy jest to bezwzględnie konieczne.
Matki karmiące
Wiele leków, w tym ludzka insulina, przenika do mleka ludzkiego. Z tego powodu należy zachować ostrożność, gdy Exubera jest podawana kobiecie karmiącej. Pacjenci z cukrzycą karmiący piersią mogą wymagać dostosowania dawki leku Exubera, planu posiłków lub obu tych zmian.
Zastosowanie pediatryczne
Nie określono długoterminowego bezpieczeństwa i skuteczności produktu Exubera u dzieci i młodzieży (patrz FARMAKOLOGIA KLINICZNA, Specjalne populacje).
Zastosowanie geriatryczne
W kontrolowanych badaniach klinicznych fazy 2/3 (n = 1975) preparat Exubera podano 266 pacjentom w wieku 65 lat i 30 pacjentom w wieku 75 lat. Większość tych pacjentów miała cukrzycę typu 2. Zmiana HbA1C a wskaźnik hipoglikemii nie różnił się w zależności od wieku.
Top
Działania niepożądane
Bezpieczeństwo produktu Exubera w monoterapii lub w skojarzeniu z podskórną insuliną lub środkami doustnymi jest oceniano u około 2500 dorosłych pacjentów z cukrzycą typu 1 lub 2, którzy byli narażeni Exubera Około 2000 pacjentów było narażonych na działanie preparatu Exubera przez ponad 6 miesięcy, a ponad 800 pacjentów było narażonych przez ponad 2 lata.
Zdarzenia niepożądane niezwiązane z układem oddechowym
Zdarzenia niepożądane niezwiązane z układem oddechowym zgłoszone u 1% spośród 1977 pacjentów leczonych produktem Exubera w kontrolowanych badaniach klinicznych fazy 2/3, niezależnie od związku przyczynowego, obejmują (ale nie wyłącznie):
Metaboliczne i odżywcze: hipoglikemia (patrz OSTRZEŻENIA i ŚRODKI OSTROŻNOŚCI)
Ciało jako całość: ból w klatce piersiowej
Pokarmowy: suchość w ustach
Specjalne zmysły: zapalenie ucha środkowego (cukrzyca dziecięca typu 1)
Hipoglikemia
Częstość i częstość występowania hipoglikemii były porównywalne między produktem Exubera a zwykłą ludzką insuliną podskórną u pacjentów z cukrzycą typu 1 i 2. U pacjentów typu 2, którzy nie byli odpowiednio kontrolowani za pomocą leczenia pojedynczym doustnym środkiem, dodanie Exubera wiązała się z wyższym odsetkiem hipoglikemii niż dodanie drugiego doustnego leku agent.
Ból w klatce piersiowej
Szereg różnych objawów w klatce piersiowej zgłoszono jako działania niepożądane i zostały one pogrupowane pod nieokreślonym terminem ból w klatce piersiowej. Zdarzenia te wystąpiły u 4,7% pacjentów leczonych produktem Exubera i 3,2% pacjentów w grupach porównawczych. Większość (> 90%) tych zdarzeń zgłoszono jako łagodne lub umiarkowane. Dwóch pacjentów w grupie Exubera i jeden w grupie porównawczej przerwał leczenie z powodu bólu w klatce piersiowej. Częstość występowania zdarzeń niepożądanych o dowolnej przyczynie związanych z chorobą wieńcową, takich jak dławica piersiowa lub zawał mięśnia sercowego, była porównywalna w Exubera (0,7% dusznica bolesna; 0,7% zawał mięśnia sercowego) i komparator (1,3% dławica piersiowa; 0,7% zawału mięśnia sercowego) w grupach leczenia.
Suche usta
Suchość w ustach zgłoszono u 2,4% pacjentów leczonych produktem Exubera i 0,8% pacjentów w grupach porównawczych. Niemal wszystkie (> 98%) zgłaszane suchość w ustach była łagodna lub umiarkowana. Żaden pacjent nie przerwał leczenia z powodu suchości w jamie ustnej.
Zdarzenia dotyczące ucha w cukrzycy u dzieci
U dzieci z cukrzycą typu 1 w grupach Exubera częściej występowały zdarzenia niepożądane związane z uchem niż u dzieci z cukrzycą typu 1 w grupach leczonych otrzymujących wyłącznie podskórną insulinę. Te zdarzenia obejmowały zapalenie ucha środkowego (Exubera 6,5%; SC 3,4%), ból ucha (Exubera 3,9%; SC 1,4%) i zaburzenia ucha (Exubera 1,3%; SC 0%).
Zdarzenia niepożądane ze strony układu oddechowego
Tabela 6 pokazuje częstość występowania niepożądanych zdarzeń oddechowych dla każdej zgłoszonej grupy leczenia w 1% dowolnej grupy terapeutycznej w kontrolowanych badaniach klinicznych fazy 2 i 3, niezależnie od związku przyczynowego.
Tabela 6: Zdarzenia niepożądane ze strony układu oddechowego zgłoszone w 1% dowolnej grupy leczenia w kontrolowanych badaniach klinicznych fazy 2 i 3, niezależnie od związku przyczynowego
| Procent pacjentów zgłaszających zdarzenia | |||||
|---|---|---|---|---|---|
| Niekorzystne wydarzenie | Cukrzyca typu 1 | Cukrzyca typu 2 | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OAs N = 644 |
|
| SC = podskórny komparator insuliny; OA = komparatory doustne | |||||
| Infekcja dróg oddechowych | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Zwiększony kaszel | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Zapalenie gardła | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Katar | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Zapalenie zatok | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Zaburzenia oddechowe | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Duszność | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Plwocina Zwiększona | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Zapalenie oskrzeli | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Astma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Krwawienie z nosa | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Zapalenie krtani | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Zapalenie płuc | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Zmiana głosu | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Kaszel
W 3 badaniach klinicznych pacjenci, którzy wypełnili kwestionariusz na kaszel, zgłosili, że kaszel zwykle występuje w obrębie sekund do minut po inhalacji Exubera, miał głównie łagodny przebieg i rzadko był produktywny Natura. Częstość występowania tego kaszlu zmniejszała się wraz z ciągłym stosowaniem leku Exubera. W kontrolowanych badaniach klinicznych 1,2% pacjentów przerwało leczenie produktem Exubera z powodu kaszlu.
Duszność
Prawie wszystkie (> 97%) duszności zgłoszono jako łagodne lub umiarkowane. Niewielka liczba pacjentów leczonych produktem Exubera (0,4%) przerwała leczenie z powodu duszności w porównaniu do 0,1% pacjentów leczonych lekiem porównawczym.
Inne zdarzenia niepożądane ze strony układu oddechowego - zapalenie gardła, zwiększenie plwociny i krwawienie z nosa
Większość tych zdarzeń zgłoszono jako łagodne lub umiarkowane. Niewielka liczba pacjentów leczonych produktem Exubera przerwała leczenie z powodu zapalenia gardła (0,2%) i zwiększenia plwociny (0,1%); żaden pacjent nie przerwał leczenia z powodu krwawienia z nosa.
Funkcja płuc
Wpływ preparatu Exubera na układ oddechowy oceniono u ponad 3800 pacjentów w kontrolowanych badaniach klinicznych 2 i 3 fazy (w których 1977 pacjentów było leczonych produktem Exubera). W randomizowanych, otwartych badaniach klinicznych trwających do dwóch lat pacjenci leczeni produktem Exubera wykazał większy spadek czynności płuc, w szczególności wymuszoną objętość wydechową w jednym drugi (FEV1) i zdolność do dyfuzji tlenku węgla (DLWSPÓŁ), niż u pacjentów leczonych komparatorem. Średnie różnice w grupach terapeutycznych w FEV1 i DLWSPÓŁ, odnotowano w ciągu pierwszych kilku tygodni leczenia produktem Exubera i nie rozwijał się w ciągu dwuletniego okresu leczenia. W jednym zakończonym kontrolowanym badaniu klinicznym z udziałem pacjentów z cukrzycą typu 2 po dwóch latach leczenia produktem Exubera pacjenci wykazali ustąpienie różnicy w grupie terapeutycznej FEV1 sześć tygodni po zakończeniu terapii. Rozdzielczość wpływu preparatu Exubera na czynność płuc u pacjentów z cukrzycą typu 1 nie była badana po długotrwałym leczeniu.
Ryciny od 3 do 6 pokazują średnią FEV1 i DLWSPÓŁ zmiana w stosunku do wartości wyjściowej w stosunku do czasu z dwóch trwających randomizowanych, otwartych badań dwuletnich z udziałem 580 pacjentów z cukrzycą typu 1 i 620 pacjentów z cukrzycą typu 2.
Rycina 3: Zmiana wartości wyjściowej FEV1 (L) u pacjentów z cukrzycą typu 1 (średnia +/- odchylenie standardowe)
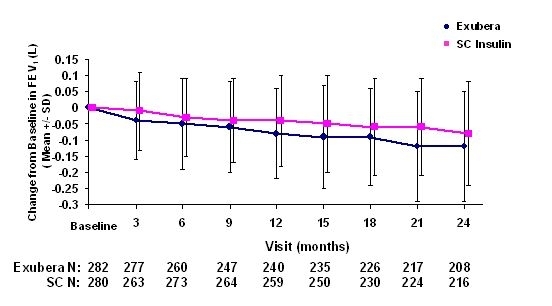
Rycina 4: Zmiana wartości wyjściowej FEV1 (L) u pacjentów z cukrzycą typu 2 (średnia +/- odchylenie standardowe)
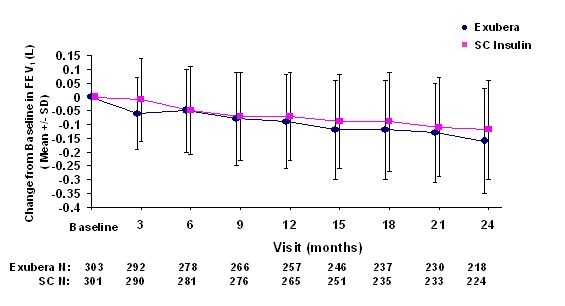
Po 2 latach leczenia produktem Exubera u pacjentów z cukrzycą typu 1 i typu 2 różnica między grupami leczenia średnia zmiana w stosunku do wartości wyjściowej FEV1 wyniosła około 40 ml, co sprzyja komparator.
Rycina 5: Zmiana wartości wyjściowej DLco (ml / min / mmHg) u pacjentów z cukrzycą typu 1 (średnia +/- odchylenie standardowe)
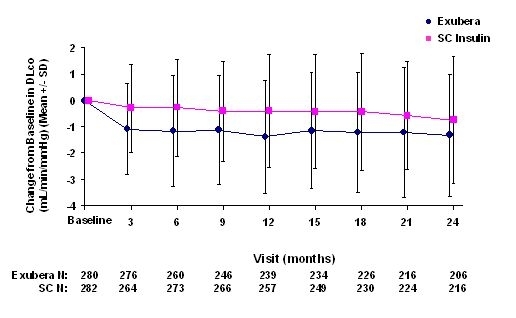
Rycina 6: Zmiana wartości wyjściowej DLco (ml / min / mmHg) u pacjentów z cukrzycą typu 2 (średnia +/- odchylenie standardowe)

Po 2 latach leczenia produktem Exubera różnica między grupami leczenia dla średniej zmiany w stosunku do wyjściowej DLWSPÓŁ wynosił około 0,5 ml / min / mmHg (cukrzyca typu 1), faworyzując komparator, i około 0,1 ml / min / mmHg (cukrzyca typu 2), faworyzując preparat Exubera.
Podczas dwuletnich badań klinicznych u poszczególnych pacjentów zaobserwowano znaczny spadek czynności płuc w obu grupach leczenia. Spadek w stosunku do wartości początkowej FEV1 20% z ostatniej obserwacji wystąpiło u 1,5% pacjentów leczonych produktem Exubera i 1,3% pacjentów leczonych lekiem porównawczym. Spadek w stosunku do wartości wyjściowej DLWSPÓŁ 20% z ostatniej obserwacji wystąpiło u 5,1% pacjentów leczonych produktem Exubera i 3,6% pacjentów leczonych lekiem porównawczym.
Top
Przedawkowanie
Hipoglikemia może wystąpić w wyniku nadmiaru insuliny w stosunku do spożycia pokarmu, wydatku energetycznego lub obu tych czynników.
Łagodne do umiarkowanych epizody hipoglikemii zwykle można leczyć doustną glukozą. Konieczne może być dostosowanie dawki leku, schematów posiłków lub ćwiczeń fizycznych.
Ciężkie epizody hipoglikemii ze śpiączką, drgawkami lub zaburzeniami neurologicznymi można leczyć domięśniowo / podskórnie glukagonem lub stężoną glukozą dożylną. Konieczne może być ciągłe przyjmowanie węglowodanów i obserwacja, ponieważ hipoglikemia może nawrócić po widocznym wyleczeniu klinicznym.
Top
Dawkowanie i sposób podawania
Exubera, podobnie jak szybko działające analogi insuliny, ma szybszy początek działania obniżającego stężenie glukozy w porównaniu do zwykłej ludzkiej insuliny wstrzykiwanej podskórnie. Czas działania preparatu Exubera na obniżenie poziomu glukozy jest porównywalny z podskórną iniekcją zwykłej ludzkiej insuliny i dłuższy niż insulina szybko działająca. Dawki preparatu Exubera należy podawać bezpośrednio przed posiłkami (nie więcej niż 10 minut przed każdym posiłkiem).
U pacjentów z cukrzycą typu 1 preparat Exubera należy stosować w schematach obejmujących insulinę dłużej działającą. U pacjentów z cukrzycą typu 2 Exubera może być stosowana w monoterapii lub w skojarzeniu ze środkami doustnymi lub insuliną o dłuższym czasie działania.
Ze względu na wpływ preparatu Exubera na czynność płuc, przed rozpoczęciem leczenia produktem Exubera należy ocenić czynność płuc. U pacjentów leczonych produktem Exubera zaleca się okresowe monitorowanie czynności płuc ŚRODKI OSTROŻNOŚCI, Funkcja płuc).
Exubera jest przeznaczony do podawania przez inhalację i można go podawać wyłącznie za pomocą Exubera® Inhalator. Zobacz Przewodnik po lekach Exubera opis Exubery® Inhalator i instrukcje użycia inhalatora.
Obliczanie początkowej dawki exubera przed posiłkiem
Początkowa dawka leku Exubera powinna być zindywidualizowana i ustalona na podstawie porady lekarza zgodnie z potrzebami pacjenta. Zalecane początkowe dawki przed posiłkiem oparte są na badaniach klinicznych, w których poproszono pacjentów o zjedzenie trzech posiłków dziennie. Początkowe dawki przed posiłkiem można obliczyć według następującego wzoru: [Masa ciała (kg) X 0,05 mg / kg = dawka przed posiłkiem (mg)] zaokrąglona w dół do najbliższej pełnej liczby miligramów (np. 3,7 mg zaokrąglona w dół do 3 mg).
Przybliżone wytyczne dotyczące początkowych dawek Exubera przed posiłkiem, w oparciu o masę ciała pacjenta, podano w tabeli 7:
Tabela 7: Przybliżone wytyczne dotyczące początkowej dawki produktu Exubera przed posiłkiem (na podstawie masy ciała pacjenta)
| Waga pacjenta (w kg) |
Waga pacjenta (w funtach) |
Dawka początkowa na posiłek | Liczba blistrów 1 mg na dawkę | Liczba blistrów 3 mg na dawkę |
|---|---|---|---|---|
| 30 do 39,9 kg | 66 - 87 funtów | 1 mg na posiłek | 1 | - |
| 40 do 59,9 kg | 88 - 132 funtów | 2 mg na posiłek | 2 | - |
| Od 60 do 79,9 kg | 133 - 176 funtów | 3 mg na posiłek | - | 1 |
| 80 do 99,9 kg | 177–220 funtów | 4 mg na posiłek | 1 | 1 |
| 100 do 119,9 kg | 221–264 funtów | 5 mg na posiłek | 2 | 1 |
| 120 do 139,9 kg | 265 - 308 funtów | 6 mg na posiłek | - | 2 |
Blister 1 mg insuliny wziewnej Exubera odpowiada w przybliżeniu 3 jm zwykłej ludzkiej insuliny wstrzykiwanej podskórnie. Blister 3 mg insuliny wziewnej Exubera odpowiada w przybliżeniu 8 jm zwykłej ludzkiej insuliny wstrzykiwanej podskórnie. Tabela 8 przedstawia przybliżoną dawkę IU zwykłej podskórnej insuliny ludzkiej dla dawek insuliny wziewnej Exubera od 1 mg do 6 mg.
Tabela 8: Przybliżona równoważna dawka jm zwykłej ludzkiej podskórnej insuliny dla dawek wziewnych insuliny Exubera w zakresie od 1 mg do 6 mg
| Dawka (mg) | Przybliżona normalna dawka insuliny SC w jm | Liczba 1 mg Exubera Blistry na dawkę | Liczba blisterów Exubera 3 mg na dawkę |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Pacjenci powinni łączyć blistry 1 mg i 3 mg, aby pobrać najmniejszą liczbę blistrów na dawkę (np. Dawkę 4 mg należy podać jako jeden blister 1 mg i jeden blister 3 mg). Kolejne wdychanie trzech blistrów o dawce 1 mg powoduje znacznie większą ekspozycję na insulinę niż inhalacja jednego blistra o dawce 3 mg. Dlatego trzy dawki 1 mg nie powinny być zastępowane jedną dawką 3 mg (patrz FARMAKOLOGIA KLINICZNA, Farmakokinetyka). Gdy pacjent jest ustabilizowany według schematu dawkowania obejmującego blistry 3 mg i blistry 3 mg stają się tymczasowo niedostępne, pacjent może tymczasowo zastąpić dwa blistry 1 mg jednym 3 mg pęcherz. Należy ściśle monitorować poziom glukozy we krwi.
Podobnie jak w przypadku wszystkich insulin, dodatkowe czynniki, które należy wziąć pod uwagę przy określaniu dawki początkowej leku Exubera, obejmują: nie są ograniczone do bieżącej kontroli glikemii pacjenta, wcześniejszej odpowiedzi na insulinę, czasu trwania cukrzycy oraz diety i ćwiczeń fizycznych zwyczaje.
Uwagi dotyczące dostosowywania dawki
Po rozpoczęciu leczenia produktem Exubera, podobnie jak w przypadku innych leków obniżających stężenie glukozy, może być konieczne dostosowanie dawki na podstawie potrzeba pacjenta (np. stężenie glukozy we krwi, wielkość posiłku i skład składników odżywczych, pora dnia oraz aktualne lub przewidywane ćwiczenie). Każdego pacjenta należy dostosować do jego optymalnej dawki na podstawie wyników monitorowania stężenia glukozy we krwi.
Tak jak w przypadku wszystkich insulin, przebieg czasowy działania leku Exubera może być różny u różnych osób lub w różnych momentach u tej samej osoby.
Exubera może być stosowana podczas współistniejących chorób układu oddechowego (np. Zapalenie oskrzeli, zakażenie górnych dróg oddechowych, nieżyt nosa). Konieczne może być ścisłe monitorowanie stężeń glukozy we krwi i dostosowanie dawki indywidualnie. Wdychane produkty lecznicze (np. Leki rozszerzające oskrzela) należy podać przed podaniem leku Exubera.
Top
Jak dostarczone
Exubera (insulina ludzka [pochodzenie rDNA]) Proszek do inhalacji jest dostępny w blistrach 1 mg i 3 mg w dawce jednostkowej. Blistry są dozowane na perforowane karty sześciu blistrów z dawką jednostkową (PVC / aluminium). Dwie mocne strony różnią się kolorowym drukiem i znakami dotykowymi, które można odróżnić dotykiem. Blistry 1 mg i odpowiednie perforowane karty są wydrukowane zielonym tuszem, a karty są oznaczone jednym podniesionym paskiem. Blistry 3 mg i odpowiednie perforowane karty są wydrukowane niebieskim tuszem, a karty są oznaczone trzema wypukłymi paskami.
Pięć kart blistrowych zapakowanych jest w przezroczystą plastikową (PET) termoformowaną tackę. Każda taca PET zawiera również środek pochłaniający wilgoć i jest przykryta przezroczystą plastikową pokrywką (PET). Tacka z pięcioma kartami blistrowymi (blistry 30 dawek jednostkowych) jest szczelnie zamknięta w foliowym laminowanym woreczku ze środkiem pochłaniającym wilgoć.
Exubera (insulina ludzka [pochodzenie rDNA]) Wdychanie Blistry z proszkiem, Exubera® Inhalator i zamiennik Exubera® Jednostki uwalniające są wymagane do rozpoczęcia terapii produktem Exubera i są zawarte w zestawie Exubera. W pełni zmontowana Exubera® Inhalator składa się z podstawy inhalatora, komory i Exubery® Jednostka zwalniająca. W pełni zmontowany inhalator jest pakowany z wymienną komorą i jest dostępny w zestawie Exubera oraz jako osobna jednostka. Komora jest również dostępna jako pojedynczy element.
Exubera® Jednostki zwalniające są pakowane osobno w szczelnie zamkniętą tackę termoformowaną. Jedna Exubera® Jednostka uwalniająca jest zawarta w każdym w pełni zmontowanym inhalatorze. Dwie dodatkowe jednostki uwalniające znajdują się w zestawie Exubera i w każdym pakiecie kombinacji. Jednostki wydające Exubera są również dostępne osobno.
Opis tych konfiguracji znajduje się w tabelach 9 i 10.
Tabela 9
| Exubera (insulina ludzka [pochodzenie rDNA]) Proszek do inhalacji jest dostępny w następujący sposób: | ||
|---|---|---|
| Opis | Zawartość | NDC |
| ZESTAW EXUBERA | 1 inhalator Exubera 1 komora wymiany 1 mg à 180 blistrów 3 mg - 90 blistrów 2 Exubera® Jednostki zwalniające |
0069-0050-85 |
| Exubera Combination Pack 12 | 1 mg à 90 blistrów 3 mg - 90 blistrów 2 Exubera® Jednostki zwalniające |
0069-0050-19 |
| Exubera Combination Pack 15 | 1 mg à 180 blistrów 3 mg - 90 blistrów 2 Exubera® Jednostki zwalniające |
0069-0050-53 |
| Opakowanie dla pacjenta Exubera 1 mg | 90 × 1 mg 2 Exubera® Jednostki zwalniające |
0069-0707-37 |
| Opakowanie dla pacjenta Exubera 3 mg | 90 × 3 mg 2 Exubera® Jednostki zwalniające |
0069-0724-37 |
Tabela 10
| Exubera® Inhalator i komponenty są dostępne w następujący sposób: | ||
|---|---|---|
| Opis | Zawartość | NDC |
| Exubera® Inhalator i komora | 1 Exubera® Inhalator 1 komora wymiany |
0069-0054-19 |
| Exubera® Jednostki zwalniające | 2 Exubera® Jednostki zwalniające | 0069-0097-41 |
| Exubera® Izba | 1 komora wymiany | 0069-0061-19 |
Przechowywanie w blistrze
Nieużywany (nieotwarty): Przechowywać w kontrolowanej temperaturze pokojowej, 25 ° C (77 ° F); wycieczki dozwolone do 15-30 ° C (59-86 ° F) [patrz temperatura pokojowa kontrolowana przez USP]. Nie zamrażać. Nie przechowywać w lodówce.
W użyciu: Po otwarciu opakowania foliowego blistry z dawkami jednostkowymi należy chronić przed wilgocią, przechowywać w temperaturze 25 ° C (77 ° F); wycieczki dozwolone do 15-30 ° C (59-86 ° F) [patrz temperatura pokojowa kontrolowana przez USP]. Nie zamrażać. Nie przechowywać w lodówce. Blistry z dawką jednostkową należy zużyć w ciągu 3 miesięcy po otwarciu opakowania foliowego. Umieść blistry na owinięciu, aby chronić przed wilgocią. Należy zachować szczególną ostrożność, aby uniknąć wilgotnego środowiska, np. parna łazienka po prysznicu.
Wyrzucić blister, jeśli jest zamrożony.
Przechowywanie inhalatora
Przechowywać w kontrolowanej temperaturze pokojowej, 25 ° C (77 ° F); wycieczki dozwolone do 15-30 ° C (59-86 ° F) [patrz temperatura pokojowa kontrolowana przez USP]. Nie zamrażać. Nie przechowywać w lodówce.
The Exubera® Inhalator można stosować przez okres do 1 roku od daty pierwszego użycia.
Zastąpienie Exubery® Jednostka zwalniająca
The Exubera® Jednostka uwalniająca w Exuberze® Inhalator należy wymieniać co 2 tygodnie.
Trzymać poza zasięgiem dzieci
Tylko Rx

LAB-0331-12.0
ostatnia wersja 04/2008
Exubera, insulina ludzka [pochodzenie rDNA] Informacje dla pacjenta (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chciałbyś uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę


