Actos na cukrzycę typu 2
Nazwa marki: Actos
Nazwa ogólna: chlorowodorek pioglitazonu
Zawartość:
Opis
Farmakologia
Wskazania i zastosowanie
Przeciwwskazania
Ostrzeżenia
Środki ostrożności
Działania niepożądane
Przedawkować
Dawkowanie i sposób podawania
Jak dostarczone
Actos, pioglitazone hcl, informacje dla pacjentów (w prostym angielskim)
OSTRZEŻENIE: KONGESTYWNA AWARIA SERCA
- Tiazolidynodiony, w tym Actos, powodują lub nasilają zastoinową niewydolność serca u niektórych pacjentów (patrz OSTRZEŻENIA). Po rozpoczęciu przyjmowania leku Actos i po zwiększeniu dawki należy uważnie obserwować pacjentów pod kątem objawów niewydolności serca (w tym nadmiernego, szybkiego przyrostu masy ciała, duszności i / lub obrzęku). Jeśli pojawią się te objawy, niewydolność serca należy leczyć zgodnie z obowiązującymi standardami opieki. Ponadto należy rozważyć przerwanie lub zmniejszenie dawki Actos.
- Actos nie jest zalecany u pacjentów z objawową niewydolnością serca. Inicjowanie Actos u pacjentów z niewydolnością serca klasy III lub IV według NYHA jest przeciwwskazane (patrz PRZECIWWSKAZANIA i OSTRZEŻENIA).
Opis
Actos (chlorowodorek pioglitazonu) jest doustnym lekiem przeciwcukrzycowym, który działa przede wszystkim poprzez zmniejszenie oporności na insulinę. Actos stosuje się w leczeniu cukrzycy typu 2 (znanej również jako cukrzyca insulinoniezależna [NIDDM] lub cukrzyca dorosłych). Badania farmakologiczne wskazują, że Actos poprawia wrażliwość na insulinę w mięśniach i tkance tłuszczowej oraz hamuje glukoneogenezę wątrobową. Actos poprawia kontrolę glikemii przy jednoczesnym obniżeniu poziomu krążącej insuliny.
Pioglitazon [(±) -5 - [[4- [2- (5-etylo-2-pirydynylo) etoksy] fenylo] metylo] -2,4-] tiazolidynodionu należy do inna klasa chemiczna i ma inne działanie farmakologiczne niż sulfonylomoczniki, metformina lub Î ± -glukozydaza inhibitory Cząsteczka zawiera jeden asymetryczny węgiel, a związek jest syntetyzowany i stosowany jako mieszanina racemiczna. Dwa enancjomery pioglitazonu interkonwertują in vivo. Nie stwierdzono różnic w aktywności farmakologicznej między dwoma enancjomerami. Wzór strukturalny jest taki jak pokazano:
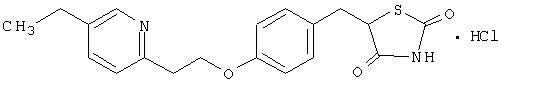
Chlorowodorek pioglitazonu jest bezwonnym, białym krystalicznym proszkiem o wzorze cząsteczkowym C.19H.20N.2O3S-HCl i masa cząsteczkowa 392,90 daltonów. Jest rozpuszczalny w N, N-dimetyloformamidzie, słabo rozpuszczalny w bezwodnym etanolu, bardzo słabo rozpuszczalny w acetonie i acetonitrylu, praktycznie nierozpuszczalny w wodzie i nierozpuszczalny w eterze.
Actos jest dostępny jako tabletka do podawania doustnego zawierająca 15 mg, 30 mg lub 45 mg pioglitazonu (jako baza) w postaci następujące substancje pomocnicze: laktoza jednowodna NF, hydroksypropyloceluloza NF, karboksymetyloceluloza wapniowa NF i stearynian magnezu NF.
Top
Farmakologia kliniczna
Mechanizm akcji
Actos jest tiazolidynodionowym lekiem przeciwcukrzycowym, którego mechanizm działania zależy od obecności insuliny. Actos zmniejsza insulinooporność na obrzeżach iw wątrobie, co powoduje zwiększenie zależnego od insuliny usuwania glukozy i zmniejszenie produkcji glukozy w wątrobie. W przeciwieństwie do pochodnych sulfonylomocznika pioglitazon nie jest lekiem wydzielającym insulinę. Pioglitazon jest silnym agonistą receptora gamma aktywowanego przez proliferatory peroksysomów (PPARγ). Receptory PPAR znajdują się w tkankach ważnych dla działania insuliny, takich jak tkanka tłuszczowa, mięśnie szkieletowe i wątroba. Aktywacja receptorów jądrowych PPARγ moduluje transkrypcję szeregu genów wrażliwych na insulinę zaangażowanych w kontrolę metabolizmu glukozy i lipidów.
W zwierzęcych modelach cukrzycy pioglitazon zmniejsza hiperglikemię, hiperinsulinemię i hipertriglicerydemię charakterystyczne dla stanów insulinoopornych, takich jak cukrzyca typu 2. Zmiany metaboliczne wytwarzane przez pioglitazon skutkują zwiększoną reaktywnością tkanek zależnych od insuliny i są obserwowane w wielu zwierzęcych modelach insulinooporności.
Ponieważ pioglitazon wzmacnia działanie krążącej insuliny (zmniejszając oporność na insulinę), nie obniża poziomu glukozy we krwi w modelach zwierzęcych, w których nie występuje endogenna insulina.
Farmakokinetyka i metabolizm leków
Stężenia całkowitego pioglitazonu (pioglitazonu i aktywnych metabolitów) w surowicy pozostają podwyższone 24 godziny po podaniu raz na dobę. Stężenia pioglitazonu i całkowitego pioglitazonu w stanie stacjonarnym są osiągane w ciągu 7 dni. W stanie stacjonarnym dwa farmakologicznie aktywne metabolity pioglitazonu, metabolity III (M-III) i IV (M-IV), osiągają stężenia w surowicy równe lub większe niż pioglitazon. Zarówno u zdrowych ochotników, jak iu pacjentów z cukrzycą typu 2 pioglitazon stanowi około 30% do 50% maksymalne całkowite stężenie pioglitazonu w surowicy i 20% do 25% całkowitego obszaru pod krzywą stężenie w surowicy w czasie (AUC).
Maksymalne stężenie w surowicy (Cmax), AUC i minimalne stężenia w surowicy (Cmin) zarówno dla pioglitazonu, jak i całkowitego pioglitazonu zwiększają się proporcjonalnie przy dawkach 15 mg i 30 mg na dobę. Jest nieco mniej niż proporcjonalny wzrost dla pioglitazonu i całkowitego pioglitazonu w dawce 60 mg na dobę.
Wchłanianie: Po podaniu doustnym na czczo pioglitazon można najpierw oznaczyć w surowicy w ciągu 30 minut, a maksymalne stężenie obserwuje się w ciągu 2 godzin. Pokarm nieznacznie opóźnia czas do osiągnięcia maksymalnego stężenia w surowicy do 3 do 4 godzin, ale nie zmienia stopnia wchłaniania.
Dystrybucja: Średnia pozorna objętość dystrybucji (Vd / F) pioglitazonu po podaniu pojedynczej dawki wynosi 0,63 ± 0,41 (średnia ± SD) L / kg masy ciała.
Pioglitazon w znacznym stopniu wiąże się z białkami (> 99%) w ludzkiej surowicy, głównie z albuminami surowicy. Pioglitazon wiąże się również z innymi białkami surowicy, ale z mniejszym powinowactwem. Metabolity M-III i M-IV są również silnie związane (> 98%) z albuminami surowicy.
Metabolizm: Pioglitazon jest intensywnie metabolizowany przez hydroksylację i utlenianie; metabolity te częściowo przekształcają się również w koniugaty glukuronidowe lub siarczanowe. Metabolity M-II i M-IV (hydroksylowe pochodne pioglitazonu) i M-III (keto pochodna pioglitazonu) są farmakologicznie aktywne w zwierzęcych modelach cukrzycy typu 2. Oprócz pioglitazonu, M-III i M-IV są głównymi gatunkami związanymi z lekami występującymi w ludzkiej surowicy po wielokrotnym dawkowaniu. W stanie stacjonarnym, zarówno u zdrowych ochotników, jak iu pacjentów z cukrzycą typu 2, pioglitazon stanowi około 30% do 50% całkowitych maksymalnych stężeń w surowicy i 20% do 25% całkowite AUC.
Dane in vitro pokazują, że wiele izoform CYP bierze udział w metabolizmie pioglitazonu. Zaangażowane izoformy cytochromu P450 to CYP2C8 i, w mniejszym stopniu, CYP3A4 z dodatkowym udziałem różnych innych izoform, w tym głównie pozawątrobowego CYP1A1. Przeprowadzono badania in vivo pioglitazonu w połączeniu z inhibitorami P450 i substratami (patrz Interakcje z lekami). Stosunki moczu 6--hydroksykortyzol / kortyzol mierzone u pacjentów leczonych Actos wykazały, że pioglitazon nie jest silnym induktorem enzymu CYP3A4.
Wydalanie i wydalanie: Po podaniu doustnym około 15% do 30% dawki pioglitazonu jest wydalane z moczem. Eliminacja pioglitazonu przez nerki jest znikoma, a lek jest wydalany głównie w postaci metabolitów i ich koniugatów. Zakłada się, że większość dawki doustnej jest wydalana z żółcią w postaci niezmienionej lub w postaci metabolitów i wydalana z kałem.
Średni okres półtrwania pioglitazonu i całkowitego pioglitazonu w surowicy wynosi odpowiednio od 3 do 7 godzin i 16 do 24 godzin. Pozorny klirens pioglitazonu, CL / F, obliczono na 5 do 7 l / h.
Specjalne populacje
Niewydolność nerek: Okres półtrwania w fazie eliminacji pioglitazonu, M-III i M-IV pozostaje niezmieniony u pacjentów z umiarkowanym (klirens kreatyniny 30 do 60 ml / min) do ciężkiego (klirens kreatyniny <30 ml / min) zaburzenia czynności nerek w porównaniu z prawidłowym przedmioty. Nie zaleca się dostosowania dawki u pacjentów z zaburzeniami czynności nerek (patrz DAWKOWANIE I SPOSÓB PODAWANIA).
Niewydolność wątroby: W porównaniu z normalnymi kontrolami osoby z zaburzeniami czynności wątroby (stopień B / C w skali Child-Pugh) mają około 45% zmniejszenie średniego maksymalnego stężenia pioglitazonu i całkowitego pioglitazonu, ale bez zmiany średniego AUC wartości.
Nie należy rozpoczynać leczenia preparatem Actos, jeśli u pacjenta występują objawy kliniczne wskazujące na aktywną chorobę wątroby lub poziom transaminaz w surowicy (ALT) przekracza 2,5-krotność górnej granicy normy (patrz ŚRODKI OSTROŻNOŚCI, Wpływ na wątrobę).
Osoby w podeszłym wieku: u zdrowych osób w podeszłym wieku maksymalne stężenia pioglitazonu w surowicy i całkowitego pioglitazonu nie są znacząco różne, ale wartości AUC są nieco wyższe, a końcowe wartości okresu półtrwania nieco dłuższe niż dla młodsi przedmioty. Zmiany te nie były tak duże, że można je uznać za istotne klinicznie.
Dzieci: Dane farmakokinetyczne w populacji pediatrycznej nie są dostępne.
Płeć: Średnia Cmax a wartości AUC wzrosły o 20% do 60% u kobiet. W monoterapii oraz w połączeniu z pochodnymi sulfonylomocznika, metforminą lub insuliną Actos poprawiał kontrolę glikemii zarówno u mężczyzn, jak iu kobiet. W kontrolowanych badaniach klinicznych hemoglobina A.1c (HbA1c) spadki w stosunku do wartości wyjściowej były na ogół większe u kobiet niż u mężczyzn (średnia średnia różnica w HbA1c 0.5%). Ponieważ leczenie powinno być zindywidualizowane dla każdego pacjenta w celu uzyskania kontroli glikemii, nie zaleca się dostosowywania dawki w zależności od płci.
Pochodzenie etniczne: Dane farmakokinetyczne dla różnych grup etnicznych nie są dostępne.
Interakcje między lekami
Następujące leki były badane u zdrowych ochotników przy jednoczesnym podawaniu Actos 45 mg raz na dobę. Poniżej wymieniono wyniki:
Doustne środki antykoncepcyjne: Jednoczesne podawanie Actos (45 mg raz na dobę) i doustnych środków antykoncepcyjnych (1 mg noretyndronu plus 0,035 mg etynyloestradiolu raz na dobę) przez 21 dni, powodowało zmniejszenie AUC etynyloestradiolu o 11% i 11-14% (0–24 godz.) i Cmax odpowiednio. Nie stwierdzono istotnych zmian wartości AUC noretyndronu (0–24 godz.) I Cmax. Ze względu na dużą zmienność farmakokinetyki etynyloestradiolu znaczenie kliniczne tego odkrycia jest nieznane.
Feksofenadyna HCl: Jednoczesne podawanie Actos przez 7 dni z 60 mg feksofenadyny podawanej doustnie dwa razy dziennie nie miało znaczącego wpływu na farmakokinetykę pioglitazonu. Actos nie miał znaczącego wpływu na farmakokinetykę feksofenadyny.
Glipizyd: Jednoczesne podawanie Actos i 5 mg glipizydu, podawanych doustnie raz dziennie przez 7 dni, nie zmieniało farmakokinetyki glipizydu w stanie stacjonarnym.
Digoksyna: Jednoczesne podawanie Actos z 0,25 mg digoksyny podawanej doustnie raz dziennie przez 7 dni nie wpłynęło na farmakokinetykę digoksyny w stanie stacjonarnym.
Warfaryna: Jednoczesne podawanie Actos przez 7 dni z warfaryną nie wpłynęło na farmakokinetykę warfaryny w stanie stacjonarnym. Actos nie ma istotnego klinicznie wpływu na czas protrombinowy, gdy jest podawany pacjentom przewlekle leczonym warfaryną.
Metformina: Jednoczesne podawanie pojedynczej dawki metforminy (1000 mg) i Actos po 7 dniach Actos nie wpłynęło na farmakokinetykę pojedynczej dawki metforminy.
Midazolam: Podawanie Actos przez 15 dni, a następnie pojedyncza dawka 7,5 mg syropu midazolamu spowodowała zmniejszenie o 26% midazolamu Cmax i AUC.
HCl ranitydyny: Jednoczesne podawanie Actos przez 7 dni z ranitydyną podawaną doustnie dwa razy dziennie przez 4 lub 7 dni nie powodowało znaczącego wpływu na farmakokinetykę pioglitazonu. Actos nie wykazywał znaczącego wpływu na farmakokinetykę ranitydyny.
Nifedypina ER: Jednoczesne podawanie Actos przez 7 dni z 30 mg ER nifedypiny podawanej doustnie raz dziennie przez 4 dni w celu ochotnicy płci męskiej i żeńskiej uzyskali co najmniej średnie wartości kwadratowe (90% CI) dla niezmienionej nifedypiny wynoszące 0,83 (0,73 - 0,95) dla domax i 0,88 (0,80 - 0,96) dla AUC. Ze względu na dużą zmienność farmakokinetyki nifedypiny znaczenie kliniczne tego odkrycia jest nieznane.
Ketokonazol: Jednoczesne podawanie Actos przez 7 dni z ketokonazolem 200 mg podawanym dwukrotnie codziennie dawało co najmniej średnie kwadratowe (90% CI) dla niezmienionego pioglitazonu wynoszące 1,14 (1,06 - 1,23) dla C.max, 1,34 (1,26 - 1,41) dla AUC i 1,87 (1,71 - 2,04) dla Cmin.
Atorwastatyna Wapń: jednoczesne podawanie Actos przez 7 dni z atorwastatyną wapniową (LIPITOR®) 80 mg raz dziennie dawało co najmniej średnie kwadratowe (90% CI) dla niezmienionego pioglitazonu wynoszące 0,69 (0,57 - 0,85) dla C.max, 0,76 (0,65 - 0,88) dla AUC i 0,96 (0,87 - 1,05) dla Cmin. Dla niezmienionej atorwastatyny najmniejsze średnie kwadratowe (90% CI) wynosiły 0,77 (0,66 - 0,90) dla Cmax, 0,86 (0,78 - 0,94) dla AUC i 0,92 (0,82 - 1,02) dla Cmin.
Teofilina: Jednoczesne podawanie Actos przez 7 dni z teofiliną 400 mg podawaną dwa razy dziennie nie powodowało zmiany farmakokinetyki żadnego z leków.
Cytochrom P450: patrz ŚRODKI OSTROŻNOŚCI
Gemfibrozyl: Jednoczesne podawanie gemfibrozylu (doustnie 600 mg dwa razy na dobę), inhibitora CYP2C8, z pioglitazonem (doustnie 30 mg) u 10 zdrowych ochotników wcześniej leczonych przez 2 dni wcześniej z gemfibrozylem (doustnie 600 mg dwa razy dziennie) powodowało ekspozycję na pioglitazon (AUC0-24), co stanowi 226% ekspozycji na pioglitazon przy braku gemfibrozylu (widzieć ŚRODKI OSTROŻNOŚCI).
Ryfampina: Jednoczesne podawanie ryfampicyny (doustnie 600 mg raz na dobę), induktor CYP2C8 z pioglitazonem (doustnie 30 mg) u 10 zdrowych ochotnicy leczeni wcześniej przez 5 dni ryfampiną (doustnie 600 mg raz na dobę) spowodowali zmniejszenie AUC pioglitazonu o 54% (patrz ŚRODKI OSTROŻNOŚCI).
Farmakodynamika i efekty kliniczne
Badania kliniczne wykazują, że Actos poprawia wrażliwość na insulinę u pacjentów opornych na insulinę. Actos zwiększa odpowiedź komórkową na insulinę, zwiększa zależne od insuliny usuwanie glukozy, poprawia wrażliwość wątroby na insulinę i poprawia dysfunkcyjną homeostazę glukozy. U pacjentów z cukrzycą typu 2 obniżona insulinooporność spowodowana przez Actos powoduje niższe stężenie glukozy w osoczu, niższe poziomy insuliny w osoczu i niższe HbA1c wartości. W oparciu o wyniki otwartego badania przedłużającego działanie Actos wydaje się utrzymywać przez co najmniej rok. W kontrolowanych badaniach klinicznych Actos w połączeniu z pochodną sulfonylomocznika, metforminą lub insuliną działał addytywnie na kontrolę glikemii.
Pacjenci z nieprawidłowościami lipidowymi zostali włączeni do badań klinicznych z Actos. Ogólnie rzecz biorąc, pacjenci leczeni Actos mieli średni spadek trójglicerydów, średni wzrost cholesterolu HDL i brak spójnych średnich zmian LDL i cholesterolu całkowitego.
W 26-tygodniowym, kontrolowanym placebo badaniu, w zależności od dawki, średnie poziomy triglicerydów zmniejszyły się w grupach dawek Actos 15 mg, 30 mg i 45 mg w porównaniu ze średnim wzrostem w grupie placebo. Średnie poziomy HDL wzrosły w większym stopniu u pacjentów leczonych Actos niż u pacjentów otrzymujących placebo. Nie stwierdzono spójnych różnic dla LDL i cholesterolu całkowitego u pacjentów leczonych Actos w porównaniu do placebo (Tabela 1).
Tabela 1 Lipidy w 26-tygodniowym badaniu kontrolowanym placebo w monoterapii w zakresie dawek
| Placebo | Actos 15 mg Pewnego razu Codziennie |
Actos 30 mg Pewnego razu Codziennie |
Actos 45 mg Pewnego razu Codziennie |
|
| Triglicerydy (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Wartość początkowa (średnia) | 262.8 | 283.8 | 261.1 | 259.7 |
| Zmiana procentowa od wartości początkowej (średnia) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL Cholesterol (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Wartość początkowa (średnia) | 41.7 | 40.4 | 40.8 | 40.7 |
| Zmiana procentowa od wartości początkowej (średnia) | 8.1% | 14.1% | 12.2% | 19.1% |
| Cholesterol LDL (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Wartość początkowa (średnia) | 138.8 | 131.9 | 135.6 | 126.8 |
| Zmiana procentowa od wartości początkowej (średnia) | 4.8% | 7.2% | 5.2% | 6.0% |
| Cholesterol ogółem (mg / dl) | N = 79 | N = 79 | N = 84 | N = 77 |
| Wartość początkowa (średnia) | 224.6 | 220.0 | 222.7 | 213.7 |
| Zmiana procentowa od wartości początkowej (średnia) | 4.4% | 4.6% | 3.3% | 6.4% |
W dwóch innych badaniach monoterapii (24 tygodnie i 16 tygodni) oraz w badaniach terapii skojarzonej z pochodną sulfonylomocznika (24 tygodnie i 16 tygodni) i metforminy (24 tygodnie i 16 tygodni), wyniki były zasadniczo zgodne z danymi powyżej. W badaniach kontrolowanych placebo średnie zmiany skorygowane placebo od wartości początkowej zmniejszyły się o 5% do 26% dla trójglicerydów i wzrosły o 6% do 13% dla HDL u pacjentów leczonych produktem Actos. Podobny wzór wyników zaobserwowano w 24-tygodniowych badaniach terapii skojarzonej Actos z pochodną sulfonylomocznika lub metforminą.
W badaniu terapii skojarzonej z insuliną (16 tygodni) średnia skorygowana o placebo procentowa zmiana w stosunku do wartości wyjściowych wartości trójglicerydów u pacjentów leczonych preparatem Actos była również zmniejszona. W grupie otrzymującej 15 mg zaobserwowano średnią zmianę cholesterolu LDL o 7% skorygowaną o placebo. Obserwowano wyniki podobne do tych podanych powyżej dla HDL i cholesterolu całkowitego. Podobny wzór wyników zaobserwowano w 24-tygodniowym badaniu terapii skojarzonej z Actos z insuliną.
Studia kliniczne
Monoterapia
W Stanach Zjednoczonych przeprowadzono trzy randomizowane, podwójnie zaślepione, kontrolowane placebo badania trwające od 16 do 26 tygodni w celu oceny zastosowania Actos w monoterapii u pacjentów z cukrzycą typu 2. W badaniach tych badano Actos w dawkach do 45 mg lub placebo raz na dobę u 865 pacjentów.
W 26-tygodniowym badaniu, w zależności od dawki, 408 pacjentów z cukrzycą typu 2 losowo przydzielono do grupy otrzymującej 7,5 mg, 15 mg, 30 mg lub 45 mg Actos lub placebo raz na dobę. Leczenie dowolnym poprzednim lekiem przeciwcukrzycowym przerwano 8 tygodni przed okresem podwójnie ślepej próby. Leczenie 15 mg, 30 mg i 45 mg Actos spowodowało statystycznie znaczącą poprawę HbA1c i glukozy w osoczu na czczo (FPG) w punkcie końcowym w porównaniu z placebo (ryc. 1, tabela 2).
Rycina 1 pokazuje przebieg zmian w FPG i HbA1c dla całej badanej populacji w tym 26-tygodniowym badaniu.

Tabela 2 pokazuje HbA1c i wartości FPG dla całej badanej populacji.
Tabela 2 Parametry glikemiczne w 26-tygodniowym badaniu kontrolowanym placebo w zakresie dawek
| Placebo | Actos 15 mg Pewnego razu Codziennie |
Actos 30 mg Pewnego razu Codziennie |
Actos 45 mg Pewnego razu Codziennie |
|
| OGÓŁ POPULACJI | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Wartość początkowa (średnia) | 10.4 | 10.2 | 10.2 | 10.3 |
| Zmiana od wartości początkowej (skorygowana średnia+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Różnica w stosunku do placebo (skorygowana średnia+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Wartość początkowa (średnia) | 268 | 267 | 269 | 276 |
| Zmiana od wartości początkowej (skorygowana średnia+) | 9 | -30 | -32 | -56 |
| Różnica w stosunku do placebo (skorygowana średnia+) | -39* | -41* | -65* | |
|
+ Skorygowane dla linii podstawowej, centrum puli i centrum puli na podstawie interakcji leczenia * p <0,050 vs. placebo |
Badana populacja obejmowała pacjentów wcześniej nieleczonych lekami przeciwcukrzycowymi (nave; 31%) oraz pacjenci, którzy otrzymywali leki przeciwcukrzycowe w momencie włączenia do badania (wcześniej leczeni; 69%). Dane dla podgrup pacjentów wcześniej i wcześniej leczonych przedstawiono w tabeli 3. Wszyscy pacjenci przeszli 8 tygodniowy okres wypłukiwania / docierania przed leczeniem metodą podwójnie ślepej próby. Ten okres docierania wiązał się z niewielką zmianą HbA1c oraz wartości FPG od badań przesiewowych do wartości wyjściowej dla naiwnych pacjentów; jednak w przypadku grupy wcześniej leczonej wypłukanie z wcześniejszych leków przeciwcukrzycowych spowodowało pogorszenie kontroli glikemii i wzrost HbA1c i FPG. Chociaż większość pacjentów w poprzednio leczonej grupie miała spadek wartości HbA w stosunku do wartości wyjściowej1c oraz FPG z Actos, w wielu przypadkach wartości nie powróciły do poziomów przesiewowych do końca badania. Projekt badania nie pozwolił na ocenę pacjentów, którzy przestawili się bezpośrednio na Actos z innego leku przeciwcukrzycowego.
Tabela 3 Parametry glikemiczne w 26-tygodniowym badaniu kontrolowanym placebo w zakresie dawek
| Placebo | Actos 15 mg Pewnego razu Codziennie |
Actos 30 mg Pewnego razu Codziennie |
Actos 45 mg Pewnego razu Codziennie |
|
| Naà tove to Therapy HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Badania przesiewowe (średnia) | 9.3 | 10.0 | 9.5 | 9.8 |
| Wartość początkowa (średnia) | 9.0 | 9.9 | 9.3 | 10.0 |
| Zmiana od wartości początkowej (skorygowana średnia *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Różnica w stosunku do placebo (skorygowana średnia *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Badania przesiewowe (średnia) | 223 | 245 | 239 | 239 |
| Wartość początkowa (średnia) | 229 | 251 | 225 | 235 |
| Zmiana od wartości początkowej (skorygowana średnia *) | 16 | -37 | -41 | -64 |
| Różnica w stosunku do placebo (skorygowana średnia *) | -52 | -56 | -80 | |
| Wcześniej leczone HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Badania przesiewowe (średnia) | 9.3 | 9.0 | 9.1 | 9.0 |
| Wartość początkowa (średnia) | 10.9 | 10.4 | 10.4 | 10.6 |
| Zmiana od wartości początkowej (skorygowana średnia *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Różnica w stosunku do placebo (skorygowana średnia *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Badania przesiewowe (średnia) | 222 | 209 | 230 | 215 |
| Wartość początkowa (średnia) | 285 | 275 | 286 | 292 |
| Zmiana od wartości początkowej (skorygowana średnia *) | 4 | -32 | -27 | -55 |
| Różnica w stosunku do placebo (skorygowana średnia *) | -36 | -31 | -59 | |
| * Skorygowano dla linii bazowej i centrum puli |
W 24-tygodniowym badaniu kontrolowanym placebo 260 pacjentów z cukrzycą typu 2 zostało losowo przydzielonych do jednej z dwóch grup leczonych Actos z przymusowym zwiększaniem dawki lub grupy placebo do próbnego zwiększania dawki. Leczenie dowolnym poprzednim lekiem przeciwcukrzycowym przerwano 6 tygodni przed okresem podwójnie ślepej próby. W jednej grupie terapeutycznej Actos pacjenci otrzymywali dawkę początkową 7,5 mg raz na dobę. Po czterech tygodniach dawkę zwiększono do 15 mg raz na dobę, a po kolejnych czterech tygodniach dawkę zwiększono do 30 mg raz na dobę do końca badania (16 tygodni). W drugiej grupie leczonej Actos pacjenci otrzymywali początkową dawkę 15 mg raz na dobę i byli stopniowo zwiększani do 30 mg raz na dobę i 45 mg raz na dobę w podobny sposób. Leczenie Actos, jak opisano, spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu do placebo (Tabela 4).
Tabela 4 Parametry glikemii w 24-tygodniowym badaniu wymuszonego miareczkowania kontrolowanym placebo
| Placebo | Actos 30 mg+ Raz dziennie |
Actos 45 mg+ Raz dziennie |
|
| Ogół populacji HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Wartość początkowa (średnia) | 10.8 | 10.3 | 10.8 |
| Zmiana od wartości początkowej (skorygowana średnia++) | 0.9 | -0.6 | -0.6 |
| Różnica w stosunku do placebo (skorygowana średnia++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Wartość początkowa (średnia) | 279 | 268 | 281 |
| Zmiana od wartości początkowej (skorygowana średnia++) | 18 | -44 | -50 |
| Różnica w stosunku do placebo (skorygowana średnia++) | -62* | -68* | |
|
+ Ostateczna dawka w wymuszonym dostosowywaniu dawki ++ Skorygowane dla linii podstawowej, centrum puli i centrum puli na podstawie interakcji leczenia * p <0,050 vs. placebo |
U pacjentów, którzy nie byli wcześniej leczeni lekami przeciwcukrzycowymi (24%), średnie wartości w badaniu przesiewowym wyniosły 10,1% dla HbA1c i 238 mg / dl dla FPG. Na początku średnia HbA1c wynosił 10,2%, a średnia wartość FPG wynosiła 243 mg / dl. W porównaniu z placebo leczenie preparatem Actos miareczkowane do dawki końcowej 30 mg i 45 mg spowodowało zmniejszenie średniej wartości HbA w stosunku do wartości początkowej1c odpowiednio 2,3% i 2,6% oraz średniej wartości FPG odpowiednio 63 mg / dl i 95 mg / dl. U pacjentów, którzy wcześniej byli leczeni lekami przeciwcukrzycowymi (76%), ten lek został przerwany podczas badań przesiewowych. Średnie wartości w badaniu przesiewowym wyniosły 9,4% dla HbA1c i 216 mg / dl dla FPG. Na początku średnia HbA1c wynosił 10,7%, a średnia wartość FPG wynosiła 290 mg / dl. W porównaniu z placebo leczenie preparatem Actos miareczkowane do dawki końcowej 30 mg i 45 mg spowodowało zmniejszenie średniej wartości HbA w stosunku do wartości początkowej1c odpowiednio 1,3% i 1,4%, a średnia wartość FPG wynosi odpowiednio 55 mg / dl i 60 mg / dl. Dla wielu wcześniej leczonych pacjentów HbA1c a FPG nie wróciło do poziomów przesiewowych do końca badania.
W 16-tygodniowym badaniu 197 pacjentów z cukrzycą typu 2 randomizowano do leczenia 30 mg Actos lub placebo raz na dobę. Leczenie dowolnym poprzednim lekiem przeciwcukrzycowym przerwano 6 tygodni przed okresem podwójnie ślepej próby. Leczenie 30 mg Actos spowodowało statystycznie istotną poprawę HbA1c i FPG w punkcie końcowym w porównaniu do placebo (Tabela 5).
Tabela 5 Parametry glikemiczne w 16-tygodniowym badaniu kontrolowanym placebo
| Placebo | Actos 30 mg Raz dziennie |
|
| Ogół populacji HbA1c (%) |
N = 93 | N = 100 |
| Wartość początkowa (średnia) | 10.3 | 10.5 |
| Zmiana od wartości początkowej (skorygowana średnia+) | 0.8 | -0.6 |
| Różnica w stosunku do placebo (skorygowana średnia+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Wartość początkowa (średnia) | 270 | 273 |
| Zmiana od wartości początkowej (skorygowana średnia+) | 8 | -50 |
| Różnica w stosunku do placebo (skorygowana średnia+) | -58* | |
|
+ Skorygowane dla linii podstawowej, centrum puli i centrum puli na podstawie interakcji leczenia * p <0,050 vs. placebo |
U pacjentów, którzy nie byli wcześniej leczeni lekami przeciwcukrzycowymi (40%), średnie wartości podczas badań przesiewowych wynosiły 10,3% dla HbA1c i 240 mg / dL dla FPG. Na początku średnia HbA1c wynosił 10,4%, a średnia wartość FPG wynosiła 254 mg / dl. W porównaniu z placebo leczenie Actos 30 mg spowodowało zmniejszenie średniej wartości HbA w stosunku do wartości początkowej1c 1,0% i średnia wartość FPG 62 mg / dl. W przypadku pacjentów, którzy wcześniej byli leczeni lekami przeciwcukrzycowymi (60%), lek ten został przerwany podczas badań przesiewowych. Średnie wartości w badaniu przesiewowym wyniosły 9,4% dla HbA1c i 216 mg / dl dla FPG. Na początku średnia HbA1c wynosił 10,6%, a średnia wartość FPG wynosiła 287 mg / dl. W porównaniu z placebo leczenie Actos 30 mg spowodowało zmniejszenie średniej wartości HbA w stosunku do wartości początkowej1c 1,3% i średnia FPG 46 mg / dl. Dla wielu wcześniej leczonych pacjentów HbA1c a FPG nie wróciło do poziomów przesiewowych do końca badania.
Terapia skojarzona
Trzy 16-tygodniowe, randomizowane, podwójnie ślepe, kontrolowane placebo badania kliniczne i trzy 24-tygodniowe, randomizowane, podwójnie ślepe, kontrolowane dawką przeprowadzono badania kliniczne w celu oceny wpływu Actos na kontrolę glikemii u pacjentów z cukrzycą typu 2, którzy byli nieodpowiedni kontrolowany (HbA1c • 8%) pomimo obecnej terapii pochodnymi sulfonylomocznika, metforminą lub insuliną. Wcześniejsze leczenie cukrzycy mogło być monoterapią lub terapią skojarzoną.
Actos Plus Sulfonylurea Studies
Przeprowadzono dwa badania kliniczne z Actos w połączeniu z pochodną sulfonylomocznika. Oba badania obejmowały pacjentów z cukrzycą typu 2 leczonych sulfonylomocznikiem, samodzielnie lub w skojarzeniu z innym lekiem przeciwcukrzycowym. Wszystkie inne leki przeciwcukrzycowe zostały wycofane przed rozpoczęciem leczenia badanego. W pierwszym badaniu 560 pacjentów zostało losowo przydzielonych do grupy otrzymującej 15 mg lub 30 mg Actos lub placebo raz na dobę przez 16 tygodni oprócz aktualnego schematu leczenia pochodną sulfonylomocznika. W porównaniu z placebo w 16 tygodniu dodanie Actos do pochodnej sulfonylomocznika znacznie obniżyło średnią HbA1c o 0,9% i 1,3% oraz średni FPG o 39 mg / dl i 58 mg / dl odpowiednio dla dawek 15 mg i 30 mg.
W drugim badaniu 702 pacjentów przydzielono losowo do grupy otrzymującej 30 mg lub 45 mg Actos raz na dobę przez 24 tygodnie, oprócz obecnego schematu pochodnej sulfonylomocznika. Średnie zmniejszenie wartości HbA w stosunku do wartości wyjściowej w tygodniu 241c wynosiły odpowiednio 1,55% i 1,67% dla dawek 30 mg i 45 mg. Średnie zmniejszenie FPG w stosunku do wartości wyjściowej wyniosło 51,5 mg / dl i 56,1 mg / dl.
Efekt terapeutyczny Actos w połączeniu z pochodną sulfonylomocznika obserwowano u pacjentów niezależnie od tego, czy pacjenci otrzymywali niskie, średnie, czy wysokie dawki pochodnych sulfonylomocznika.
Actos Plus Metformin Studies
Przeprowadzono dwa badania kliniczne z Actos w połączeniu z metforminą. Oba badania obejmowały pacjentów z cukrzycą typu 2 leczonych metforminą, samodzielnie lub w skojarzeniu z innym lekiem przeciwcukrzycowym. Wszystkie inne leki przeciwcukrzycowe zostały wycofane przed rozpoczęciem leczenia badanego. W pierwszym badaniu 328 pacjentów zostało losowo przydzielonych do grupy otrzymującej 30 mg Actos lub placebo raz na dobę przez 16 tygodni, oprócz obecnego schematu leczenia metforminą. W porównaniu z placebo w 16. tygodniu dodanie Actos do metforminy znacznie zmniejszyło średnią HbA1c o 0,8% i zmniejszyło średnią FPG o 38 mg / dl.
W drugim badaniu 827 pacjentów zostało losowo przydzielonych do grupy otrzymującej 30 mg lub 45 mg Actos raz na dobę przez 24 tygodnie oprócz aktualnego schematu leczenia metforminą. Średnie zmniejszenie wartości HbA w stosunku do wartości wyjściowej w tygodniu 241c wynosiły odpowiednio 0,80% i 1,01% dla dawek 30 mg i 45 mg. Średnie zmniejszenie FPG w stosunku do wartości wyjściowej wyniosło 38,2 mg / dl i 50,7 mg / dl.
Efekt terapeutyczny Actos w połączeniu z metforminą obserwowano u pacjentów niezależnie od tego, czy pacjenci otrzymywali niższe czy większe dawki metforminy.
Actos Plus Insulin Studies
Przeprowadzono dwa badania kliniczne z Actos w połączeniu z insuliną. Oba badania obejmowały pacjentów z cukrzycą typu 2 przyjmujących insulinę, samodzielnie lub w skojarzeniu z innym lekiem przeciwcukrzycowym. Wszystkie inne leki przeciwcukrzycowe zostały wycofane przed rozpoczęciem leczenia badanego. W pierwszym badaniu 566 pacjentów otrzymujących medianę 60,5 jednostek dziennie insuliny zostało losowo przydzielonych do grupy otrzymywać albo 15 mg lub 30 mg Actos lub placebo raz dziennie przez 16 tygodni oprócz insuliny reżim. W porównaniu z placebo w 16 tygodniu dodanie Actos do insuliny znacznie zmniejszyło zarówno HbA1c o 0,7% i 1,0% oraz FPG o 35 mg / dL i 49 mg / dL odpowiednio dla dawki 15 mg i 30 mg.
W drugim badaniu 690 pacjentów otrzymujących medianę 60,0 jednostek dziennie insuliny otrzymywało 30 mg lub 45 mg Actos raz na dobę przez 24 tygodnie oprócz aktualnego schematu podawania insuliny. Średnie zmniejszenie wartości HbA w stosunku do wartości wyjściowej w tygodniu 241c wynosiły odpowiednio 1,17% i 1,46% dla dawek 30 mg i 45 mg. Średnie zmniejszenie FPG w stosunku do wartości wyjściowych wyniosło 31,9 mg / dl i 45,8 mg / dl. Poprawie kontroli glikemii towarzyszyło średnie zmniejszenie zapotrzebowania na insulinę w stosunku do wartości wyjściowej o 6,0% i 9,4% na dzień odpowiednio dla dawki 30 mg i 45 mg.
Efekt terapeutyczny Actos w połączeniu z insuliną obserwowano u pacjentów bez względu na to, czy pacjenci otrzymywali niższe czy wyższe dawki insuliny.
Top
Wskazania i zastosowanie
Actos jest wskazany jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u osób dorosłych z cukrzycą typu 2.
Top
Przeciwwskazania
Inicjowanie Actos u pacjentów z niewydolnością serca klasy III lub IV według NYHA (New York Heart Association) jest przeciwwskazane (patrz OSTRZEŻONE PUDEŁKO).
Actos jest przeciwwskazany u pacjentów ze znaną nadwrażliwością na ten produkt lub którykolwiek z jego składników.
Top
Ostrzeżenia
Niewydolność serca i inne objawy sercowe
Actos, podobnie jak inne tiazolidynodiony, może powodować zatrzymywanie płynów, gdy jest stosowany samodzielnie lub w połączeniu z innymi lekami przeciwcukrzycowymi, w tym insuliną. Zatrzymanie płynów może prowadzić do zaostrzenia niewydolności serca lub zaostrzać ją. Pacjentów należy obserwować pod kątem objawów niewydolności serca. Jeśli pojawią się te objawy, niewydolność serca należy leczyć zgodnie z obowiązującymi standardami opieki. Ponadto należy rozważyć przerwanie lub zmniejszenie dawki Actos (patrz OSTRZEŻONE PUDEŁKO). Pacjenci ze stanem serca klasy III i IV według NYHA nie byli badani podczas badań klinicznych poprzedzających zatwierdzenie, a Actos nie jest zalecany u tych pacjentów (patrz OSTRZEŻONE PUDEŁKO i PRZECIWWSKAZANIA).
W jednym 16-tygodniowym podwójnie ślepym, kontrolowanym placebo badaniu klinicznym w USA z udziałem 566 pacjentów z typem 2 cukrzycę, Actos w dawkach 15 mg i 30 mg w połączeniu z insuliną porównywano z insulinoterapią sam. Badanie obejmowało pacjentów z długotrwałą cukrzycą i wysoką częstością wcześniej istniejących schorzeń, jak następuje: nadciśnienie tętnicze (57,2%), neuropatia obwodowa (22,6%), choroba niedokrwienna serca (19,6%), retinopatia (13,1%), mięsień sercowy zawał (8,8%), choroba naczyniowa (6,4%), dusznica bolesna (4,4%), udar mózgu i / lub przemijający atak niedokrwienny (4,1%) oraz zastoinowa niewydolność serca (2,3%).
W tym badaniu dwóch z 191 pacjentów otrzymujących 15 mg Actos plus insulina (1,1%) i dwóch z 188 pacjentów otrzymujących 30 mg Actos i insulina (1,1%) rozwinęły zastoinową niewydolność serca w porównaniu z żadnym z 187 pacjentów leczonych wyłącznie insulinoterapią. Wszyscy czterej pacjenci mieli wcześniejsze historie chorób sercowo-naczyniowych, w tym choroby wieńcowej, poprzednich zabiegów CABG i zawału mięśnia sercowego. W 24-tygodniowym badaniu z kontrolowaną dawką, w którym Actos podawano jednocześnie z insuliną, 0,3% pacjentów (1/345) w dawce 30 mg i 0,9% (3/345) pacjentów w dawce 45 mg zgłaszało CHF jako poważne zdarzenie niepożądane .
Analiza danych z tych badań nie zidentyfikowała specyficznych czynników, które przewidują zwiększone ryzyko zastoinowej niewydolności serca podczas terapii skojarzonej z insuliną.
W cukrzycy typu 2 i zastoinowej niewydolności serca (zaburzenia skurczowe)
Przeprowadzono 24-tygodniowe badanie bezpieczeństwa po wprowadzeniu do obrotu w celu porównania Actos (n = 262) z gliburydem (n = 256) u niekontrolowanych pacjentów z cukrzycą (średnia HbA1c 8,8% na początku) z niewydolnością serca klasy II i III według NYHA i frakcją wyrzutową mniejszą niż 40% (średnia EF 30% na początku). W trakcie badania hospitalizację z powodu zastoinowej niewydolności serca zgłoszono w ciągu 9,9% przypadków pacjentów leczonych Actos w porównaniu do 4,7% pacjentów przyjmujących gliburyd, przy czym zaobserwowano różnicę w leczeniu od 6 tygodnie To zdarzenie niepożądane związane z produktem Actos było bardziej wyraźne u pacjentów stosujących insulinę na początku badania oraz u pacjentów w wieku powyżej 64 lat. Nie zaobserwowano różnicy w śmiertelności sercowo-naczyniowej między grupami leczenia.
Actos należy rozpoczynać od najniższej zatwierdzonej dawki, jeśli jest przepisywany pacjentom z cukrzycą typu 2 i skurczową niewydolnością serca (klasa II wg NYHA). Jeśli konieczne jest kolejne zwiększenie dawki, dawkę należy stopniowo zwiększać dopiero po kilku miesięcy leczenia z uważnym monitorowaniem pod kątem przyrostu masy ciała, obrzęku lub oznak i objawów CHF zaostrzenie.
Prospektywna próba kliniczna pioglitazonu w zdarzeniach makronaczyniowych (PROactive)
W PROactive 5238 pacjentów z cukrzycą typu 2 i wcześniejszą chorobą makronaczyniową leczono Actos (n = 2605), stopniowo zwiększając dawkę do 45 mg raz na dobę lub placebo (n = 2633) (patrz DZIAŁANIA NIEPOŻĄDANE). Odsetek pacjentów z ciężką niewydolnością serca był wyższy u pacjentów leczonych Actos (5,7%, n = 149) niż u pacjentów otrzymujących placebo (4,1%, n = 108). Częstość zgonów po zgłoszeniu ciężkiej niewydolności serca wynosiła 1,5% (n = 40) u pacjentów leczonych Actos i 1,4% (n = 37) u pacjentów otrzymujących placebo. U pacjentów leczonych schematem zawierającym insulinę na początku częstość występowania ciężkiej niewydolności serca wynosiła 6,3% (n = 54/864) w przypadku Actos i 5,2% (n = 47/896) w przypadku placebo. W przypadku pacjentów leczonych schematem zawierającym sulfonylomocznik na początku częstość występowania ciężkiej niewydolności serca wynosiła 5,8% (n = 94/1624) w przypadku Actos i 4,4% (n = 71/1626) w przypadku placebo.
Top
Środki ostrożności
Generał
Actos wywiera działanie przeciwhiperglikemiczne tylko w obecności insuliny. Dlatego Actos nie powinien być stosowany u pacjentów z cukrzycą typu 1 lub w leczeniu cukrzycowej kwasicy ketonowej.
Hipoglikemia: u pacjentów otrzymujących Actos w skojarzeniu z insuliną lub doustnymi lekami hipoglikemicznymi może wystąpić ryzyko hipoglikemii i może być konieczne zmniejszenie dawki jednocześnie stosowanego leku.
Układ sercowo-naczyniowy: W amerykańskich badaniach klinicznych kontrolowanych placebo, w których wykluczono pacjentów ze stanem serca klasy III i IV według NYHA (Heart York Association), częstość występowania poważne zdarzenia niepożądane ze strony serca związane ze zwiększeniem objętości nie wzrosły u pacjentów leczonych Actos w monoterapii lub w skojarzeniu z pochodnymi sulfonylomocznika lub metforminą vs. pacjenci otrzymujący placebo. W badaniach skojarzonych z insuliną niewielka liczba pacjentów z historią wcześniej istniejących choroba serca rozwinęła zastoinową niewydolność serca podczas leczenia Actos w połączeniu z insuliną (widzieć OSTRZEŻENIA). Pacjenci ze stanem serca klasy III i IV według NYHA nie byli badani w tych badaniach klinicznych Actos. Actos nie jest wskazany u pacjentów ze stanem serca klasy III lub IV według NYHA.
Po wprowadzeniu leku Actos do obrotu zgłaszano przypadki zastoinowej niewydolności serca u pacjentów zarówno z rozpoznaną wcześniej chorobą serca, jak i bez niej.
Obrzęki: Actos należy stosować ostrożnie u pacjentów z obrzękami. We wszystkich badaniach klinicznych w USA obrzęk zgłaszano częściej u pacjentów leczonych preparatem Actos niż u pacjentów otrzymujących placebo i wydaje się, że jest zależny od dawki (patrz DZIAŁANIA NIEPOŻĄDANE). Po wprowadzeniu do obrotu otrzymano zgłoszenia o rozpoczęciu lub nasileniu obrzęku. Ponieważ tiazolidynodiony, w tym Actos, mogą powodować zatrzymywanie płynów, co może zaostrzać lub prowadzić do zastoinowej niewydolności serca, Actos należy stosować ostrożnie u pacjentów z ryzykiem niewydolności serca. Pacjentów należy monitorować pod kątem objawów niewydolności serca (patrz OSTRZEŻONE PUDEŁKO, OSTRZEŻENIA, i ŚRODKI OSTROŻNOŚCI).
Przyrost masy ciała: Przyrost masy ciała związany z dawką obserwowano w przypadku samego Actos i w skojarzeniu z innymi lekami hipoglikemicznymi (Tabela 6). Mechanizm przyrostu masy ciała jest niejasny, ale prawdopodobnie obejmuje połączenie zatrzymywania płynów i gromadzenia tłuszczu.
Tabela 6 Zmiany masy ciała (kg) od wartości początkowej podczas podwójnie ślepych prób klinicznych z Actos
| Grupa kontrolna (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Mediana (25th/75th percentyl) |
Mediana (25th/75th percentyl) |
Mediana (25th/75th percentyl) |
Mediana (25th/75th percentyl) |
||
| Monoterapia | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Terapia skojarzona | Sulfonylomocznik | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformina | -1.4 (-3.2/0.3) n = 160 |
Nie dotyczy | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insulina | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Uwaga: Okres próbny wynosi od 16 do 26 tygodni |
Owulacja: Leczenie Actos, podobnie jak inne tiazolidynodiony, może powodować owulację u niektórych kobiet przed menopauzą bez jajeczkowania. W rezultacie u tych pacjentów może wystąpić zwiększone ryzyko ciąży podczas przyjmowania Actos. Dlatego należy zalecić odpowiednią antykoncepcję u kobiet przed menopauzą. Ten możliwy efekt nie był badany w badaniach klinicznych, więc częstość tego zdarzenia nie jest znana.
Hematologiczny: Actos może powodować zmniejszenie stężenia hemoglobiny i hematokrytu. We wszystkich badaniach klinicznych średnie wartości hemoglobiny spadły o 2% do 4% u pacjentów leczonych produktem Actos. Zmiany te wystąpiły przede wszystkim w ciągu pierwszych 4–12 tygodni leczenia, a następnie pozostały względnie stałe. Zmiany te mogą być związane ze zwiększoną objętością osocza i rzadko były związane z jakimikolwiek znaczącymi hematologicznymi efektami klinicznymi (patrz DZIAŁANIA NIEPOŻĄDANE, Nieprawidłowości laboratoryjne).
Wpływ na wątrobę: W badaniach klinicznych poprzedzających zatwierdzenie na całym świecie Actos stosowało ponad 4500 pacjentów. W badaniach klinicznych w USA ponad 4700 pacjentów z cukrzycą typu 2 otrzymało Actos. W badaniach klinicznych nie stwierdzono dowodów na hepatotoksyczność indukowaną lekami lub zwiększenie poziomów ALT.
Podczas badań klinicznych kontrolowanych placebo przed zatwierdzeniem placebo w USA łącznie 4 z 1526 (0,26%) pacjentów leczonych Actos i 2 z 793 (0,25%) pacjentów otrzymujących placebo miało wartości ALT - 3-krotnie górną granicę normalna. Zwiększenie aktywności AlAT u pacjentów leczonych Actos było odwracalne i nie było wyraźnie związane z leczeniem Actos.
Po wprowadzeniu leku Actos do obrotu otrzymano zgłoszenia zapalenia wątroby i zwiększenia aktywności enzymów wątrobowych do 3 lub więcej razy powyżej górnej granicy normy. Bardzo rzadko doniesienia te dotyczyły niewydolności wątroby ze skutkiem śmiertelnym i bez niej, chociaż nie ustalono związku przyczynowego.
W oczekiwaniu na dostępność wyników dodatkowych dużych, długoterminowych kontrolowanych badań klinicznych i dodatkowych po wprowadzeniu do obrotu danych dotyczących bezpieczeństwa zaleca się okresowe monitorowanie czynności wątroby u pacjentów leczonych produktem Actos enzymy.
Poziomy ALT (aminotransferazy alaninowej) w surowicy należy ocenić przed rozpoczęciem leczenia Actos u wszystkich pacjentów, a następnie okresowo zgodnie z oceną kliniczną opieki zdrowotnej profesjonalny. Należy również wykonać testy czynności wątroby u pacjentów, jeśli wystąpią objawy wskazujące na zaburzenia czynności wątroby, np. Nudności, wymioty, ból brzucha, zmęczenie, anoreksja lub ciemne zabarwienie moczu. Decyzja o kontynuowaniu leczenia produktem Actos powinna opierać się na ocenie klinicznej do czasu oceny laboratoryjnej. W przypadku zaobserwowania żółtaczki należy przerwać leczenie farmakologiczne.
Nie należy rozpoczynać leczenia preparatem Actos, jeśli u pacjenta występują kliniczne dowody wskazujące na aktywną chorobę wątroby lub poziom ALT przekracza 2,5-krotność górnej granicy normy. Pacjenci z nieznacznie podwyższonym poziomem enzymów wątrobowych (poziomy ALT 1 do 2,5-krotności górnej granicy normy) w należy ocenić wartość wyjściową lub w dowolnym momencie leczenia produktem Actos w celu ustalenia przyczyny enzymu wątrobowego podniesienie. Należy rozpocząć lub kontynuować leczenie produktem Actos u pacjentów z umiarkowanie podwyższonymi enzymami wątrobowymi z zachowaniem ostrożności i należy uwzględnić odpowiednią obserwację kliniczną, która może obejmować częstsze enzymy wątrobowe monitorowanie Jeśli poziomy aminotransferaz w surowicy są zwiększone (AlAT> 2,5-krotność górnej granicy normy), wątroba testy funkcji należy oceniać częściej, aż poziomy powrócą do normy lub leczenia wstępnego wartości. Jeżeli poziomy ALT przekraczają 3-krotność górnej granicy normy, badanie należy powtórzyć jak najszybciej. Jeśli poziomy ALT utrzymają się> 3 razy powyżej górnej granicy normy lub jeśli pacjent zostanie żółtaczkowany, leczenie preparatem Actos należy przerwać.
Obrzęk plamki: po wprowadzeniu produktu do obrotu zgłaszano obrzęk plamki u pacjentów z cukrzycą, którzy przyjmowali pioglitazon lub inny tiazolidynodion. Niektórzy pacjenci mieli niewyraźne widzenie lub zmniejszoną ostrość wzroku, ale u niektórych pacjentów zdiagnozowano rutynowe badanie okulistyczne. Niektórzy pacjenci mieli obrzęk obwodowy w momencie rozpoznania obrzęku plamki żółtej. U niektórych pacjentów poprawił się obrzęk plamki żółtej po odstawieniu tiazolidynodionu. Nie wiadomo, czy istnieje związek przyczynowy między pioglitazonem a obrzękiem plamki żółtej. Pacjenci z cukrzycą powinni poddawać się regularnym badaniom okulistycznym przeprowadzanym przez okulistę zgodnie ze Standardami Opieki Amerykańskiego Towarzystwa Diabetologicznego. Ponadto każdy cukrzyca, który zgłosi jakikolwiek objaw wzrokowy, powinien zostać niezwłocznie skierowany do okulisty, niezależnie od podstawowych leków pacjenta lub innych ustaleń fizycznych (patrz DZIAŁANIA NIEPOŻĄDANE).
Złamania: W randomizowanym badaniu (PROactive) u pacjentów z cukrzycą typu 2 (średni czas trwania cukrzyca 9,5 roku), odnotowano zwiększoną częstość złamań kości u kobiet przyjmujących pioglitazon. Podczas średniego okresu obserwacji wynoszącego 34,5 miesiąca częstość złamań kości u kobiet wynosiła 5,1% (44/870) w przypadku pioglitazonu w porównaniu do 2,5% (23/905) w przypadku placebo. Różnicę tę odnotowano po pierwszym roku leczenia i utrzymywała się w trakcie badania. Większość złamań zaobserwowanych u kobiet stanowiły złamania pozakręgowe, w tym kończyna dolna i dystalna kończyna górna. Nie zaobserwowano wzrostu częstości złamań u mężczyzn leczonych pioglitazonem o 1,7% (30/1735) w porównaniu do placebo 2,1% (37/1728). Ryzyko złamania należy wziąć pod uwagę w opiece nad pacjentami, zwłaszcza kobietami, leczonymi pioglitazon i należy zwrócić uwagę na ocenę i utrzymanie zdrowia kości zgodnie z obowiązującymi standardami Opieki.
Wyniki makronaczyniowe: Nie przeprowadzono badań klinicznych, które potwierdziłyby jednoznaczne dowody zmniejszenia ryzyka makronaczyniowego za pomocą Actos lub jakiegokolwiek innego leku przeciwcukrzycowego.
Testy laboratoryjne
FPG i HbA1c pomiary należy wykonywać okresowo w celu monitorowania kontroli glikemii i odpowiedzi terapeutycznej na Actos.
U wszystkich pacjentów zaleca się monitorowanie aktywności enzymów wątrobowych przed rozpoczęciem leczenia produktem Actos, a następnie okresowo zgodnie z oceną kliniczną pracownika służby zdrowia (patrz ŚRODKI OSTROŻNOŚCI, Ogólne, Wpływ na wątrobę i DZIAŁANIA NIEPOŻĄDANE, Poziomy transaminaz w surowicy).
Informacje dla pacjentów
Ważne jest, aby instruować pacjentów, aby przestrzegali instrukcji dietetycznych i regularnie badali poziom glukozy we krwi i hemoglobiny glikozylowanej. W okresach stresu, takich jak gorączka, uraz, infekcja lub operacja, wymagania dotyczące leczenia mogą ulec zmianie i należy przypomnieć pacjentom, aby niezwłocznie zwrócili się o pomoc lekarską.
Pacjenci, u których występuje wyjątkowo szybki wzrost masy ciała lub obrzęk lub u których występuje duszność lub inne objawy niewydolności serca podczas przyjmowania Actos powinny natychmiast zgłosić te objawy Lekarz.
Pacjentom należy poinformować, że badania krwi dotyczące czynności wątroby będą przeprowadzane przed rozpoczęciem leczenia, a następnie okresowo zgodnie z oceną kliniczną pracownika służby zdrowia. Pacjentów należy poinformować o konieczności niezwłocznego zasięgnięcia porady lekarskiej w przypadku niewyjaśnionych nudności, wymiotów, bólu brzucha, zmęczenia, anoreksji lub ciemnego moczu.
Należy poinformować pacjentów, aby przyjmowali Actos raz na dobę. Actos można przyjmować z posiłkami lub bez posiłków. W przypadku pominięcia dawki jednego dnia dawki nie należy podwoić następnego dnia.
Podczas stosowania terapii skojarzonej z insuliną lub doustnymi lekami hipoglikemicznymi ryzyko hipoglikemii, jej objawy i leczenie i stany predysponujące do jego rozwoju należy wyjaśnić pacjentom i ich rodzinie członkowie.
Terapia preparatem Actos, podobnie jak inne tiazolidynodiony, może powodować owulację u niektórych kobiet przed menopauzą bez jajeczkowania. W rezultacie u tych pacjentów może wystąpić zwiększone ryzyko ciąży podczas przyjmowania Actos. Dlatego należy zalecić odpowiednią antykoncepcję u kobiet przed menopauzą. Ten możliwy efekt nie był badany w badaniach klinicznych, więc częstość tego zdarzenia nie jest znana.
Interakcje z lekami
Badania interakcji lekowych in vivo sugerowały, że pioglitazon może być słabym induktorem substratu izoformy 3A4 CYP 450 (patrz FARMAKOLOGIA KLINICZNA, Metabolizm i Interakcje między lekami).
Inhibitor enzymu CYP2C8 (taki jak gemfibrozyl) może znacznie zwiększyć AUC pioglitazon i induktor enzymu CYP2C8 (taki jak rifampina) mogą znacznie zmniejszać AUC pioglitazon. Dlatego, jeśli inhibitor lub induktor CYP2C8 zostanie uruchomiony lub zatrzymany podczas leczenia pioglitazonem, mogą być potrzebne zmiany w leczeniu cukrzycy w zależności od odpowiedzi klinicznej (patrz FARMAKOLOGIA KLINICZNA, Interakcje między lekami).
Rakotwórczość, mutageneza, upośledzenie płodności
Dwuletnie badanie rakotwórczości przeprowadzono na samcach i samicach szczurów w dawkach doustnych do 63 mg / kg (około 14-krotność maksymalnej zalecanej dawki doustnej u ludzi wynoszącej 45 mg w przeliczeniu na mg / m2). Guzy wywołane lekami nie były obserwowane w żadnym narządzie oprócz pęcherza moczowego. Łagodne i / lub złośliwe nowotwory komórek przejściowych obserwowano u samców szczurów w dawce 4 mg / kg / dobę i większej (w przybliżeniu równej maksymalnej zalecanej doustnej dawce dla ludzi w oparciu o mg / m2). Dwuletnie badanie rakotwórczości przeprowadzono na myszach płci męskiej i żeńskiej w dawkach doustnych do 100 mg / kg / dobę (około 11-krotność maksymalnej zalecanej dawki doustnej u ludzi w oparciu o mg / m2). W żadnym narządzie nie zaobserwowano guzów wywołanych przez leki.
Podczas prospektywnej oceny cytologii moczu z udziałem ponad 1800 pacjentów otrzymujących Actos w badaniach klinicznych trwających do jednego roku, nie zidentyfikowano żadnych nowych przypadków guzów pęcherza moczowego. W dwóch 3-letnich badaniach, w których pioglitazon porównywano z placebo lub gliburydem, przeprowadzono 16/3656 (0,44%) zgłoszenia raka pęcherza moczowego u pacjentów przyjmujących pioglitazon w porównaniu z 5/3679 (0,14%) u pacjentów nie przyjmujących pioglitazon. Po wykluczeniu pacjentów, u których ekspozycja na badany lek była krótsza niż rok w chwili rozpoznania raka pęcherza moczowego, odnotowano sześć (0,16%) przypadków pioglitazonu i dwa (0,05%) placebo.
Pioglitazon HCl nie działał mutagennie w szeregu badań toksykologii genetycznej, w tym w teście bakteryjnym Amesa, genie do przodu komórki ssaka test mutacji (CHO / HPRT i AS52 / XPRT), test cytogenetyczny in vitro z wykorzystaniem komórek CHL, test nieplanowanej syntezy DNA i mikrojądra in vivo analiza.
Nie obserwowano niekorzystnego wpływu na płodność u samców i samic szczurów w dawkach doustnych do 40 mg / kg HCl pioglitazonu na dobę przed kryciem i podczas krycia i ciąży (około 9-krotność maksymalnej zalecanej dawki doustnej dla ludzi w oparciu o mg / m2).
Toksykologia Zwierząt
Powiększenie serca obserwowano u myszy (100 mg / kg), szczurów (4 mg / kg i więcej) i psów (3 mg / kg) leczonych doustnie pioglitazon HCl (około 11, 1 i 2-krotność maksymalnej zalecanej dawki doustnej u ludzi, odpowiednio u myszy, szczurów i psów, na podstawie mg / m2). W rocznym badaniu na szczurach przedwczesna śmierć związana z narkotykami z powodu pozornej dysfunkcji serca wystąpiła w czasie dawka doustna 160 mg / kg / dobę (około 35-krotność maksymalnej zalecanej dawki doustnej dla człowieka w oparciu o mg / m2). Powiększenie serca obserwowano w 13-tygodniowym badaniu na małpach w dawkach doustnych 8,9 mg / kg i większych (około 4-krotność maksymalnej zalecanej dawki doustnej u ludzi w oparciu o mg / m22), ale nie w 52-tygodniowym badaniu przy dawkach doustnych do 32 mg / kg (około 13-krotność maksymalnej zalecanej dawki doustnej dla ludzi w oparciu o mg / m22).
Ciąża
Kategoria ciąży C. Pioglitazon nie wykazywał działania teratogennego u szczurów w dawkach doustnych do 80 mg / kg ani u królików otrzymujących do 160 mg / kg podczas organogenezy (około 17 i 40-krotność maksymalnej zalecanej dawki doustnej dla człowieka na mg / m2odpowiednio). Opóźniony poród i embriotoksyczność (o czym świadczą zwiększone straty po implantacji, opóźniony rozwój i zmniejszenie masy płodu) obserwowano u szczurów przy dawkach doustnych 40 mg / kg / dobę i większych (około 10-krotność maksymalnej zalecanej dawki doustnej dla ludzi na podstawie mg / m2). Nie obserwowano toksyczności funkcjonalnej ani behawioralnej u potomstwa szczurów. U królików embriotoksyczność obserwowano po doustnej dawce 160 mg / kg (około 40-krotność maksymalnej zalecanej dawki doustnej dla ludzi w oparciu o mg / m22). Opóźniony rozwój pourodzeniowy, przypisany zmniejszonej masie ciała, obserwowano u potomstwa szczurów w dawkach doustnych 10 mg / kg i więcej w późnych okresach ciąży i laktacji (około 2-krotność maksymalnej zalecanej dawki doustnej u ludzi w oparciu o mg / m2).
Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Actos należy stosować w okresie ciąży tylko wtedy, gdy potencjalna korzyść uzasadnia potencjalne ryzyko dla płodu.
Ponieważ aktualne informacje zdecydowanie sugerują, że nieprawidłowe poziomy glukozy we krwi w czasie ciąży są również związane z większą częstością występowania wrodzonych anomalii w związku ze zwiększoną zachorowalnością i umieralnością noworodków większość ekspertów zaleca stosowanie insuliny podczas ciąży w celu utrzymania poziomu glukozy we krwi tak zbliżonego do możliwy.
Matki karmiące
Pioglitazon jest wydzielany do mleka szczurów w okresie laktacji. Nie wiadomo, czy Actos przenika do mleka ludzkiego. Ponieważ wiele leków przenika do mleka ludzkiego, Actos nie powinien być podawany kobietom karmiącym piersią.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność Actos u pacjentów pediatrycznych nie zostały ustalone.
Osoby w podeszłym wieku
Około 500 pacjentów w kontrolowanych placebo badaniach klinicznych Actos miało 65 lat i więcej. Nie stwierdzono istotnych różnic w skuteczności i bezpieczeństwie między tymi pacjentami a młodszymi pacjentami.
Top
Działania niepożądane
Ponad 8500 pacjentów z cukrzycą typu 2 było leczonych Actos w randomizowanych, kontrolowanych badaniach klinicznych z podwójnie ślepą próbą. Obejmuje to 2605 pacjentów wysokiego ryzyka z cukrzycą typu 2 leczonych Actos z badania klinicznego PROactive. Ponad 6000 pacjentów było leczonych przez 6 miesięcy lub dłużej, a ponad 4500 pacjentów przez rok lub dłużej. Ponad 3000 pacjentów otrzymywało Actos od co najmniej 2 lat.
Ogólna częstość występowania i rodzaje zdarzeń niepożądanych zgłoszone w kontrolowanych placebo badaniach klinicznych Actos w monoterapii w dawkach 7,5 mg, 15 mg, 30 mg lub 45 mg raz na dobę przedstawiono w tabeli 7.
Tabela 7 Kontrolowane placebo badania kliniczne Actos w monoterapii: zdarzenia niepożądane zgłaszane z częstotliwością - 5% pacjentów leczonych Actos
| (% pacjentów) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Zakażenia górnych dróg oddechowych | 8.5 | 13.2 |
| Bół głowy | 6.9 | 9.1 |
| Zapalenie zatok | 4.6 | 6.3 |
| Bóle mięśni | 2.7 | 5.4 |
| Zaburzenia zębów | 2.3 | 5.3 |
| Cukrzyca pogarsza się | 8.1 | 5.1 |
| Zapalenie gardła | 0.8 | 5.1 |
W przypadku większości klinicznych zdarzeń niepożądanych częstość występowania była podobna w grupach leczonych Actos monoterapią i leczonych w skojarzeniu z pochodnymi sulfonylomocznika, metforminą i insuliną. Wystąpił wzrost występowania obrzęku u pacjentów leczonych Actos i insuliną w porównaniu do samej insuliny.
W 16-tygodniowym, kontrolowanym placebo badaniu Actos plus z insuliną (n = 379), 10 pacjentów leczonych Actos plus insulina rozwijała duszność, a także w pewnym momencie leczenia rozwijała się zmiana masy ciała lub obrzęk. Siedmiu z tych 10 pacjentów otrzymało leki moczopędne w celu leczenia tych objawów. Nie zgłoszono tego w grupie przyjmującej insulinę i placebo.
Częstość rezygnacji z badań klinicznych kontrolowanych placebo z powodu zdarzenia niepożądanego innego niż hiperglikemia była podobna u pacjentów leczonych placebo (2,8%) lub Actos (3,3%).
W kontrolowanych badaniach terapii skojarzonej z pochodną sulfonylomocznika lub insuliną zgłaszano łagodną do umiarkowanej hipoglikemię, która wydaje się być zależna od dawki (patrz ŚRODKI OSTROŻNOŚCI, Ogólne, hipoglikemia i Dawkowanie i sposób podawania, Terapia skojarzona).
W amerykańskich badaniach z podwójnie ślepą próbą niedokrwistość zgłoszono u 2% pacjentów leczonych Actos plus pochodną sulfonylomocznika, metforminą lub insuliną (patrz ŚRODKI OSTROŻNOŚCI, General, Hematologic).
W badaniach monoterapii obrzęki zgłaszano u 4,8% (przy dawkach od 7,5 mg do 45 mg) pacjentów leczonych produktem Actos w porównaniu do 1,2% pacjentów otrzymujących placebo. W badaniach terapii skojarzonej obrzęk odnotowano u 7,2% pacjentów leczonych Actos i pochodnymi sulfonylomocznika w porównaniu do 2,1% pacjentów leczonych wyłącznie pochodnymi sulfonylomocznika. W badaniach terapii skojarzonej metforminą obrzęki zgłaszano u 6,0% pacjentów stosujących leczenie skojarzone w porównaniu do 2,5% pacjentów przyjmujących samą metforminę. W badaniach terapii skojarzonej z insuliną obrzęki zgłaszano u 15,3% pacjentów leczonych skojarzoną w porównaniu z 7,0% pacjentów leczonych samą insuliną. Większość z tych zdarzeń została uznana za łagodną lub umiarkowaną intensywność (patrz ŚRODKI OSTROŻNOŚCI, Ogólne, Obrzęk).
W jednym 16-tygodniowym badaniu klinicznym terapii skojarzonej insuliną Actos u większej liczby pacjentów rozwinęła się zastoinowa niewydolność serca podczas terapii skojarzonej (1,1%) w porównaniu do żadnej z nich samej insuliny (patrz OSTRZEŻENIA, Niewydolność serca i inne objawy sercowe).
Prospektywna próba kliniczna pioglitazonu w zdarzeniach makronaczyniowych (PROactive)
W PROactive 5238 pacjentów z cukrzycą typu 2 i wcześniejszą chorobą makronaczyniową było leczone Actos (n = 2605), miareczkowane siłą do 45 mg dziennie lub placebo (n = 2633) oprócz standardowego Opieki. Prawie wszyscy pacjenci (95%) otrzymywali leki sercowo-naczyniowe (beta-blokery, inhibitory ACE, ARB, blokery kanałów wapniowych, azotany, leki moczopędne, aspiryna, statyny, fibraty). Średni wiek pacjentów wynosił 61,8 lat, średni czas trwania cukrzycy 9,5 lat, a średni HbA1c 8,1%. Średni czas obserwacji wyniósł 34,5 miesiąca. Głównym celem tego badania było zbadanie wpływu Actos na śmiertelność i zachorowalność makronaczyniowa u pacjentów z cukrzycą typu 2, którzy byli narażeni na wysokie ryzyko zdarzenia makronaczyniowe. Podstawową zmienną skuteczności był czas do pierwszego wystąpienia dowolnego zdarzenia w złożonym punkcie końcowym sercowo-naczyniowym (patrz tabela 8 poniżej). Chociaż nie było statystycznie istotnej różnicy między Actos a placebo dla 3-letniej zapadalności pierwsze zdarzenie w obrębie tego kompozytu nie spowodowało wzrostu śmiertelności ani całkowitej liczby zdarzeń makronaczyniowych Actos.
Tabela 8 Liczba zdarzeń pierwszych i całkowitych dla każdego komponentu w złożonym punkcie końcowym układu sercowo-naczyniowego
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Zdarzenia sercowo-naczyniowe | Pierwsze wydarzenia (N) |
Wszystkich wydarzeń (N) |
Pierwsze wydarzenia (N) |
Wszystkich wydarzeń (N) |
| Jakiekolwiek wydarzenie | 572 | 900 | 514 | 803 |
| Śmiertelność z jakiejkolwiek przyczyny | 122 | 186 | 110 | 177 |
| Nieśmiertelny zawał serca | 118 | 157 | 105 | 131 |
| Uderzenie | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Interwencja kardiologiczna | 101 | 240 | 101 | 195 |
| Poważna amputacja nogi | 15 | 28 | 9 | 28 |
| Rewaskularyzacja nóg | 57 | 92 | 71 | 115 |
Otrzymano również zgłoszenia po wprowadzeniu do obrotu nowego lub nasilającego się cukrzycowego obrzęku plamki ze zmniejszoną ostrością wzroku (patrz ŚRODKI OSTROŻNOŚCI, Ogólne, obrzęk plamki).
Nieprawidłowości laboratoryjne
Hematologiczny: Actos może powodować zmniejszenie stężenia hemoglobiny i hematokrytu. Spadek poziomu hemoglobiny i hematokrytu w przypadku Actos wydaje się być zależny od dawki. We wszystkich badaniach klinicznych średnie wartości hemoglobiny spadły o 2% do 4% u pacjentów leczonych produktem Actos. Zmiany te na ogół występowały w ciągu pierwszych 4–12 tygodni leczenia, a następnie pozostały względnie stabilne. Zmiany te mogą być związane ze zwiększoną objętością osocza związaną z leczeniem Actos i rzadko były związane z jakimikolwiek znaczącymi efektami hematologicznymi.
Poziomy aminotransferaz w surowicy: Podczas wszystkich badań klinicznych w USA u 14 z 4780 (0,30%) pacjentów leczonych preparatem Actos wartości ALT były 3-krotnie wyższe niż górna granica normy podczas leczenia. Wszyscy pacjenci z wartościami kontrolnymi mieli odwracalne zwiększenie aktywności AlAT. W populacji pacjentów leczonych produktem Actos średnie wartości bilirubiny, AspAT, AlAT, fosfatazy alkalicznej i GGT były zmniejszone podczas ostatniej wizyty w porównaniu z wartością początkową. Mniej niż 0,9% pacjentów leczonych Actos zostało wycofanych z badań klinicznych w USA z powodu nieprawidłowych testów czynności wątroby.
W badaniach klinicznych poprzedzających rejestrację nie stwierdzono przypadków idiosynkratycznych reakcji na leki prowadzących do niewydolności wątroby (patrz ŚRODKI OSTROŻNOŚCI, Ogólne, Wpływ na wątrobę).
Poziomy CPK: Podczas wymaganych badań laboratoryjnych w badaniach klinicznych obserwowano sporadyczne, przemijające zwiększenie poziomów fosfokinazy kreatynowej (CPK). Izolowane podniesienie do ponad 10-krotności górnej granicy normy odnotowano u 9 pacjentów (wartości od 2150 do 11400 IU / l). Sześciu z tych pacjentów nadal otrzymywało Actos, dwóch pacjentów ukończyło badanie leki w momencie podwyższenia wartości i jeden pacjent przerwał podawanie badanego leku z powodu podniesienie. Wzrosty te ustąpiły bez widocznych następstw klinicznych. Związek tych zdarzeń z terapią Actos jest nieznany.
Top
Przedawkować
Podczas kontrolowanych badań klinicznych zgłoszono jeden przypadek przedawkowania Actos. Mężczyzna przyjmował 120 mg dziennie przez cztery dni, a następnie 180 mg dziennie przez siedem dni. Pacjent zaprzeczył jakimkolwiek objawom klinicznym w tym okresie.
W przypadku przedawkowania należy rozpocząć odpowiednie leczenie podtrzymujące zgodnie z objawami klinicznymi pacjenta.
Top
Dawkowanie i sposób podawania
Actos należy przyjmować raz dziennie bez względu na posiłki.
Postępowanie w leczeniu przeciwcukrzycowym powinno być zindywidualizowane. Najlepiej byłoby, gdyby odpowiedź na leczenie była oceniana za pomocą HbA1c który jest lepszym wskaźnikiem długoterminowej kontroli glikemii niż sam FPG. HbA1c odzwierciedla glikemię w ciągu ostatnich dwóch do trzech miesięcy. W zastosowaniu klinicznym zaleca się, aby pacjenci byli leczeni Actos przez czas wystarczający do oceny zmiany HbA1c (trzy miesiące), chyba że pogorszy się kontrola glikemii. Po rozpoczęciu stosowania Actos lub po zwiększeniu dawki należy uważnie obserwować pacjentów pod kątem działań niepożądanych związanych z zatrzymywaniem płynów (patrz OSTRZEŻONE PUDEŁKO i OSTRZEŻENIA).
Monoterapia
Actos monoterapię u pacjentów niedostatecznie kontrolowanych za pomocą diety i ćwiczeń fizycznych można rozpocząć od dawki 15 mg lub 30 mg raz na dobę. W przypadku pacjentów, którzy nie reagują odpowiednio na początkową dawkę Actos, dawkę można zwiększać stopniowo do 45 mg raz na dobę. W przypadku pacjentów niewystarczająco reagujących na monoterapię należy rozważyć leczenie skojarzone.
Terapia skojarzona
Sulfonylomoczniki: Actos w połączeniu z pochodną sulfonylomocznika można rozpoczynać od dawki 15 mg lub 30 mg raz na dobę. Obecną dawkę sulfonylomocznika można kontynuować po rozpoczęciu leczenia Actos. Jeśli pacjenci zgłaszają hipoglikemię, dawkę pochodnej sulfonylomocznika należy zmniejszyć.
Metformina: Actos w skojarzeniu z metforminą można rozpoczynać od 15 mg lub 30 mg raz na dobę. Obecną dawkę metforminy można kontynuować po rozpoczęciu leczenia Actos. Jest mało prawdopodobne, aby dawka metforminy wymagała dostosowania z powodu hipoglikemii podczas terapii skojarzonej z Actos.
Insulina: Actos w skojarzeniu z insuliną można rozpoczynać od 15 mg lub 30 mg raz na dobę. Obecną dawkę insuliny można kontynuować po rozpoczęciu leczenia Actos. U pacjentów otrzymujących Actos i insulinę dawkę insuliny można zmniejszyć o 10% do 25%, jeśli pacjent zgłosi hipoglikemię lub jeśli stężenie glukozy w osoczu spadnie poniżej 100 mg / dl. Dalsze dostosowania powinny być zindywidualizowane w oparciu o odpowiedź na obniżenie poziomu glukozy.
Maksymalna zalecana dawka
Dawka Actos nie powinna przekraczać 45 mg raz na dobę w monoterapii lub w skojarzeniu z pochodną sulfonylomocznika, metforminą lub insuliną.
Dostosowanie dawki u pacjentów z niewydolnością nerek nie jest zalecane (patrz FARMAKOLOGIA KLINICZNA, Farmakokinetyka i metabolizm leków).
Nie należy rozpoczynać terapii preparatem Actos, jeśli u pacjenta występują kliniczne dowody wskazujące na aktywną chorobę wątroby lub zwiększone poziomy transaminaz w surowicy (ALT ponad 2,5 razy większa niż górna granica normy) na początku leczenia (widzieć ŚRODKI OSTROŻNOŚCI, Ogólne, Wpływ na wątrobę i FARMAKOLOGIA KLINICZNA, Szczególne populacje, Niewydolność wątroby). Zaleca się monitorowanie aktywności enzymów wątrobowych u wszystkich pacjentów przed rozpoczęciem leczenia produktem Actos, a następnie okresowo (patrz ŚRODKI OSTROŻNOŚCI, Ogólne, Wpływ na wątrobę).
Brak danych dotyczących stosowania Actos u pacjentów w wieku poniżej 18 lat; dlatego nie zaleca się stosowania Actos u pacjentów pediatrycznych.
Brak danych dotyczących stosowania Actos w połączeniu z innym tiazolidynodionem.
Top
Jak dostarczone
Actos jest dostępny w tabletkach 15 mg, 30 mg i 45 mg w następujący sposób:
Tabletka 15 mg: biała lub prawie biała, okrągła, wypukła tabletka bez podziału z „Actos” po jednej stronie i „15” po drugiej, dostępna w:
NDC 64764-151-04 Butelki po 30
NDC 64764-151-05 Butelki 90
NDC 64764-151-06 Butelki 500
Tabletka 30 mg: biała lub prawie biała, okrągła, płaska tabletka bez podziału z „Actos” po jednej stronie i „30” po drugiej, dostępna w:
NDC 64764-301-14 Butelki po 30 sztuk
NDC 64764-301-15 Butelki 90
NDC 64764-301-16 Butelki po 500 sztuk
Tabletka 45 mg: biała lub prawie biała, okrągła, płaska tabletka bez podziału z „Actos” po jednej stronie i „45” po drugiej, dostępna w:
NDC 64764-451-24 Butelki po 30
NDC 64764-451-25 Butelki po 90
NDC 64764-451-26 Butelki po 500 sztuk
PRZECHOWYWANIE
Przechowywać w temperaturze 25 ° C (77 ° F); wycieczki dozwolone do 15-30 ° C (59-86 ° F) [patrz temperatura pokojowa kontrolowana przez USP]. Przechowywać pojemnik szczelnie zamknięty i chronić przed wilgocią i wilgocią.
Top
Bibliografia
- Deng, LJ i in. Wpływ gemfibrozylu na farmakokinetykę pioglitazonu. Eur J Clin Pharmacol 2005; 61: 831–836, tabela 1.
2. Jaakkola, T, i in. Wpływ ryfampicyny na farmakokinetykę pioglitazonu. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Tylko Rx
Wyprodukowano przez:
Takeda Pharmaceutical Company Limited
Osaka, Japonia
Sprzedawane przez:
Takeda Pharmaceuticals America, Inc.
One Takeda Parkway
Deerfield, IL 60015
Actos® jest zastrzeżonym znakiem towarowym firmy Takeda Pharmaceutical Company Limited i jest używany na licencji przez Takeda Pharmaceuticals America, Inc.
Wszystkie pozostałe nazwy znaków towarowych są własnością ich właścicieli.
Ostatnia aktualizacja: 08/09
Actos, pioglitazone hcl, informacje dla pacjentów (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chciałbyś uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę

