Provigil: Leczenie bezsenności (pełne informacje na receptę)
Nazwa marki: Provigil
Nazwa ogólna: modafinil
Zawartość:
Opis
Farmakologia
Szlaki kliniczne
Wskazania i zastosowanie
Przeciwwskazania
Ostrzeżenia
Środki ostrożności
Działania niepożądane
Nadużywanie narkotyków i uzależnienie
Przedawkowanie
Dawkowanie i sposób podawania
Jak dostarczone
Karta informacyjna dla pacjenta Provigil (modafinil) (w prostym angielskim)
Opis
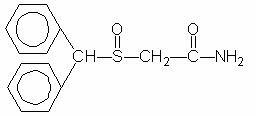
Provigil (modafinil) jest środkiem pobudzającym przebudzenie do podawania doustnego. Modafinil jest związkiem racemicznym. Nazwa chemiczna modafinilu to 2 - [(difenylometylo) sulfinylo] acetamid. Wzór cząsteczkowy to C15H15NO2S, a masa cząsteczkowa wynosi 273,35.
Struktura chemiczna to:
Modafinil jest białym lub prawie białym, krystalicznym proszkiem, który jest praktycznie nierozpuszczalny w wodzie i cykloheksanie. Jest słabo rozpuszczalny w metanolu i acetonie. Tabletki Provigil zawierają 100 mg lub 200 mg modafinilu i następujące nieaktywne składniki: laktoza, celuloza mikrokrystaliczna, wstępnie żelatynizowana skrobia, kroskarmeloza sodowa, powidon i magnez stearynian.
Top
Farmakologia kliniczna
Mechanizm działania i farmakologia
Dokładny mechanizm (mechanizmy), poprzez które modafinil promuje czuwanie, jest nieznany. Modafinil ma działanie pobudzające podobne do środków sympatykomimetycznych, takich jak amfetamina i metylofenidat, chociaż profil farmakologiczny nie jest identyczny z profilem amin sympatykomimetycznych.
Modafinil ma słabe lub nieistotne interakcje z receptorami noradrenaliny, serotoniny, dopaminy, GABA, adenozyny, histaminy-3, melatoniny i benzodiazepin. Modafinil nie hamuje również aktywności MAO-B ani fosfodiesteraz II-V.
Pobudka indukowana modafinilem może być osłabiona przez antagonistę receptora antagon ± 1-adrenergicznego prazosin; jednak modafinil jest nieaktywny w innych układach testowych in vitro, o których wiadomo, że reagują na agonistów receptorów adrenergicznych, takich jak preparat nasieniowodu szczura.
Modafinil nie jest agonistą receptora dopaminy działającym bezpośrednio lub pośrednio. Jednak in vitro modafinil wiąże się z transporterem dopaminy i hamuje wychwyt zwrotny dopaminy. Aktywność ta była powiązana in vivo ze zwiększonymi pozakomórkowymi poziomami dopaminy w niektórych obszarach mózgu zwierząt. U genetycznie zmodyfikowanych myszy pozbawionych transportera dopaminy (DAT) modafinil nie wykazywał aktywności pobudzającej, co sugeruje, że aktywność ta była zależna od DAT. Jednak pobudzające działanie modafinilu, w przeciwieństwie do amfetaminy, nie było antagonizowane przez haloperidol będący antagonistą receptora dopaminy. Ponadto alfa-metylo-p-tyrozyna, inhibitor syntezy dopaminy, blokuje działanie amfetaminy, ale nie blokuje aktywności ruchowej indukowanej przez modafinil.
U kota równe dawki metylofenidatu i amfetaminy pobudzające czuwanie zwiększały aktywację neuronów w mózgu. Modafinil w równoważnej dawce pobudzającej czuwanie wybiórczo i wyraźnie zwiększał aktywację neuronów w bardziej dyskretnych obszarach mózgu. Związek tego odkrycia u kotów z działaniem modafinilu u ludzi jest nieznany.
Oprócz działania pobudzającego i zdolności do zwiększania aktywności ruchowej u zwierząt, modafinil wytwarza efekty psychoaktywne i euforyczne, zmiany nastroju, percepcji, myślenia i uczuć typowe dla innych stymulantów OUN w ludziach. Modafinil ma właściwości wzmacniające, o czym świadczy jego samodzielne podawanie małpom uprzednio przeszkolonym do samodzielnego podawania kokainy. Modafinil był również częściowo dyskryminowany jako środek pobudzający.
Enancjomery optyczne modafinilu mają podobne działanie farmakologiczne u zwierząt. Wydaje się, że dwa główne metabolity modafinilu, kwas modafinilu i sulfon modafinilu nie wpływają na właściwości modafinilu aktywujące OUN.
Farmakokinetyka
Modafinil jest związkiem racemicznym, którego enancjomery mają różne właściwości farmakokinetyczne (np. Okres półtrwania izomeru l jest około trzy razy dłuższy niż izomeru d u dorosłych ludzi). Enancjomery nie konwertują. W stanie ustalonym całkowite narażenie na izomer l jest około trzy razy większe niż w przypadku izomeru d. Stężenie minimalne (Cminss) krążącego modafinilu po dawce raz dziennie składa się z 90% izomeru l i 10% izomeru d. Skuteczny okres półtrwania w fazie eliminacji modafinilu po podaniu wielu dawek wynosi około 15 godzin. Enancjomery modafinilu wykazują kinetykę liniową po wielokrotnym dawkowaniu 200-600 mg / dobę raz dziennie zdrowym ochotnikom. Widoczne stany stacjonarne całkowitego modafinilu i 1- (-) - modafinilu osiągane są po 2-4 dniach podawania.
Wchłanianie
Wchłanianie tabletek Provigil jest szybkie, a maksymalne stężenie w osoczu występuje po 2-4 godzinach. Biodostępność tabletek Provigil jest w przybliżeniu równa zawiesinie wodnej. Bezwzględna dostępność biologiczna po podaniu doustnym nie została określona z powodu nierozpuszczalności w wodzie (<1 mg / ml) modafinilu, co wykluczało podawanie dożylne. Pokarm nie ma wpływu na ogólną biodostępność Provigil; jednak jego wchłanianie (tmax) może być opóźniony o około godzinę, jeśli jest przyjmowany z jedzeniem.
Dystrybucja
Modafinil jest dobrze rozprowadzany w tkance ciała, a pozorna objętość dystrybucji (~ 0,9 l / kg) jest większa niż objętość całkowitej wody w organizmie (0,6 l / kg). W osoczu ludzkim, in vitro, modafinil jest umiarkowanie wiązany z białkami osocza (~ 60%, głównie z albuminami). W stężeniach w surowicy uzyskanych w stanie stacjonarnym po dawkach 200 mg / dobę modafinil nie wykazuje wypierania wiązania warfaryny, diazepamu lub propranololu z białkami. Nawet przy znacznie większych stężeniach (1000 µM; > 25-krotność Cmax 40 µM w stanie stacjonarnym przy 400 mg / dzień), modafinil nie ma wpływu na wiązanie warfaryny. Kwas modafinilowy w stężeniach> 500 µM zmniejsza stopień wiązania warfaryny, ale stężenia te są> 35 razy większe niż osiągane terapeutycznie.
Metabolizm i eliminacja
Główną drogą eliminacji jest metabolizm (~ 90%), głównie przez wątrobę, a następnie nerkowa eliminacja metabolitów. Alkalizacja moczu nie ma wpływu na eliminację modafinilu.
Metabolizm zachodzi przez dehydrolizację hydrolityczną, utlenianie S, hydroksylację pierścienia aromatycznego i sprzęganie glukuronidu. Mniej niż 10% podanej dawki jest wydalane jako związek macierzysty. W badaniu klinicznym z zastosowaniem modafinilu znakowanego radioaktywnie, 81% podanej radioaktywności zostało odzyskane w 11 dni po dawce, głównie w moczu (80% w porównaniu z moczem 1,0% w kale). Największą frakcją leku w moczu był kwas modafinilowy, ale co najmniej sześć innych metabolitów było obecnych w niższych stężeniach. Tylko dwa metabolity osiągają znaczące stężenia w osoczu, tj. Kwas modafinilu i sulfon modafinilu. W modelach przedklinicznych kwas modafinilowy, sulfon modafinilu, kwas 2 - [(difenylometylo) sulfonylo] octowy i 4-hydroksymodafinil były nieaktywne lub nie wydawały się pośredniczyć w pobudzającym działaniu modafinilu.
Sugeruje to, że u dorosłych obserwowano obniżenie minimalnych poziomów modafinilu po wielu tygodniach dawkowania autoindukcja, ale wielkość spadków i niespójność ich występowania sugerują, że ich znaczenie kliniczne jest minimalny. Znaczne nagromadzenie sulfonu modafinilu zaobserwowano po wielu dawkach ze względu na jego długi okres półtrwania eliminacji wynoszący 40 godzin. Indukcję enzymów metabolizujących, przede wszystkim cytochromu P-450 (CYP) 3A4, obserwowano również in vitro po inkubacja pierwotnych kultur ludzkich hepatocytów z modafinilem i in vivo po przedłużonym podaniu modafinilu w 400 mg / dzień. (Dalsze omówienie wpływu modafinilu na aktywność enzymu CYP, patrz ŚRODKI OSTROŻNOŚCI, Interakcje z lekami).
Interakcje między lekami:
Na podstawie danych in vitro modafinil jest metabolizowany częściowo w podrodzinie izoformy 3A wątrobowego cytochromu P450 (CYP3A4). Ponadto modafinil może hamować CYP2C19, hamować CYP2C9 i indukować CYP3A4, CYP2B6 i CYP1A2. Ponieważ modafinil i sulfon modafinilu są odwracalnymi inhibitorami enzymu CYP2C19 metabolizującego lek, jednoczesne podawanie modafinilu z leki takie jak diazepam, fenytoina i propranolol, które są w dużej mierze wydalane tą drogą, mogą zwiększać poziomy krążących związki. Ponadto u osób z niedoborem enzymu CYP2D6 (tj. 7–10% populacji rasy białej; podobny lub niższy w innych populacjach), poziomy substratów CYP2D6, takich jak trójpierścieniowe leki przeciwdepresyjne i selektywna serotonina inhibitory wychwytu zwrotnego, które mają dodatkowe drogi eliminacji przez CYP2C19, można zwiększyć przez jednoczesne podawanie modafinil. U pacjentów leczonych tymi i podobnymi lekami może być konieczne dostosowanie dawki (patrz ŚRODKI OSTROŻNOŚCI, Interakcje z lekami). Badanie in vitro wykazało, że armodafinil (jeden z enancjomerów modafinilu) jest substratem glikoproteiny P.
Jednoczesne podawanie modafinilu z innymi lekami działającymi na OUN, takimi jak metylofenidat i dekstroamfetamina, nie zmieniało znacząco farmakokinetyki żadnego z tych leków.
Stwierdzono, że przewlekłe podawanie modafinilu w dawce 400 mg zmniejsza ogólnoustrojową ekspozycję na dwa CYP3A4 substraty, etynyloestradiol i triazolam, po podaniu doustnym, co sugeruje, że był CYP3A4 wywołany. Przewlekłe podawanie modafinilu może zwiększyć eliminację substratów CYP3A4. U pacjentów leczonych tymi i podobnymi lekami może być konieczne dostosowanie dawki (patrz ŚRODKI OSTROŻNOŚCI, Interakcje z lekami).
Pozorną supresję aktywności CYP2C9 zaobserwowano w ludzkich hepatocytach po ekspozycji na modafinil in vitro sugerując, że istnieje możliwość interakcji metabolicznej między modafinilem i substratami tego enzymu (np. S-warfaryna, fenytoina). Jednak w badaniu interakcji u zdrowych ochotników przewlekłe leczenie modafinilem nie wykazało znaczącego wpływu na farmakokinetykę warfaryny w porównaniu z placebo. (Widzieć ŚRODKI OSTROŻNOŚCI, Interakcje z innymi lekami, inne leki, warfaryna).
Specjalne populacje
Efekt płci:
Płeć nie wpływa na farmakokinetykę modafinilu.
Wpływ wieku:
Nieznaczne zmniejszenie (~ 20%) klirensu po podaniu doustnym (CL / F) modafinilu zaobserwowano w badaniu z pojedynczą dawką przy 200 mg na 12 osoby w średnim wieku 63 lata (zakres 53–72 lata), ale zmiana nie została uznana za kliniczną znaczący. W badaniu z wieloma dawkami (300 mg / dobę) u 12 pacjentów w średnim wieku 82 lat (zakres 67 - 87 lat) średnia poziomy modafinilu w osoczu były około dwa razy wyższe niż w przeszłości u dopasowanych młodszych osobników przedmioty. Ze względu na potencjalne skutki wielu jednoczesnych leków, z którymi była większość pacjentów leczonych widoczna różnica w farmakokinetyce modafinilu może nie wynikać wyłącznie z działania starzenie się. Jednak wyniki sugerują, że klirens modafinilu może być zmniejszony u osób starszych (patrz Dawkowanie i sposób podawania).
Efekt wyścigu:
Wpływ rasy na farmakokinetykę modafinilu nie był badany.
Zaburzenia czynności nerek:
W badaniu dotyczącym pojedynczej dawki 200 mg modafinilu ciężka przewlekła niewydolność nerek (klirens kreatyniny - 20 ml / min) nie znacząco wpływają na farmakokinetykę modafinilu, ale ekspozycja na kwas modafinilowy (nieaktywny metabolit) była zwiększona 9-krotnie (patrz ŚRODKI OSTROŻNOŚCI).
Zaburzenia czynności wątroby:
Farmakokinetykę i metabolizm badano u pacjentów z marskością wątroby (6 mężczyzn i 3 kobiety). Trzech pacjentów miało marskość w stopniu B lub B + (zgodnie z kryteriami dziecka), a 6 pacjentów miało marskość w stopniu C lub C +. Klinicznie 8 z 9 pacjentów miało żółtaczkę i wszyscy mieli wodobrzusze. U tych pacjentów klirens doustny modafinilu zmniejszył się o około 60%, a stężenie w stanie stacjonarnym zostało podwojone w porównaniu do normalnych pacjentów. Dawkę Provigilu należy zmniejszyć u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz ŚRODKI OSTROŻNOŚCI i Dawkowanie i sposób podawania).
Top
Szlaki kliniczne
Skuteczność Provigil w zmniejszaniu nadmiernej senności została ustalona podczas następnego snu zaburzenia: narkolepsja, obturacyjny bezdech senny / zespół hipopnea (OSAHS) i zaburzenia snu w pracy zmianowej (SWSD).
Narkolepsja
Skuteczność Provigil w zmniejszaniu nadmiernej senności (ES) związanej z narkolepsją została ustalona w dwóch amerykańskich 9-tygodniowych, wieloośrodkowe, kontrolowane placebo, dwie dawki (200 mg na dobę i 400 mg na dobę), prowadzone w grupach równoległych, podwójnie zaślepione badania pacjentów ambulatoryjnych, którzy spełnili Kryteria narkolepsji ICD-9 i American Sleep Disorders Association (zgodne również z American Psychiatric Association) Kryteria DSM-IV). Kryteria te obejmują albo 1) powtarzające się drzemki w ciągu dnia lub zasypianie, które występują prawie codziennie przez co najmniej trzy miesiące, a także nagła obustronna utrata napięcia mięśniowego postawy w związku z intensywnymi emocjami (katapleksja) lub 2) skarga na nadmierną senność lub nagłe osłabienie mięśni z powiązanymi cechami: paraliż senny, halucynacje hipnagogiczne, zachowania automatyczne, zakłócony większy sen epizod; oraz polisomnografia wykazująca jedno z poniższych: opóźnienie snu krótsze niż 10 minut lub opóźnienie snu szybkiego ruchu (REM) krótsze niż 20 minut. Ponadto, aby wziąć udział w tych badaniach, wszyscy pacjenci musieli obiektywnie udokumentować nadmierną senność w ciągu dnia, wielokrotny sen Test utajenia (MSLT) z co najmniej dwoma okresami REM snu i bez jakiegokolwiek innego klinicznie czynnego medycznego lub psychiatrycznego nieład. MSLT, obiektywna polisomnograficzna ocena w ciągu dnia zdolności pacjenta do zasypiania bez stymulacji środowisko, mierzy opóźnienie (w minutach) uśpienia początku uśrednione podczas 4 sesji testowych w 2-godzinnych odstępach po nocy polisomnografia. Podczas każdej sesji testowej badanemu kazano leżeć spokojnie i próbować spać. Każda sesja testowa została zakończona po 20 minutach, jeśli nie wystąpił sen lub 15 minut po jego rozpoczęciu.
W obu badaniach podstawowymi miarami skuteczności były: 1) opóźnienie snu, zgodnie z oceną testu utrzymania czuwania (MWT) i 2) zmiana ogólnego stanu chorobowego pacjenta, mierzona na podstawie Globalnego wrażenia zmiany klinicznej (CGI-C). Aby badanie zakończyło się sukcesem, oba środki musiały wykazać znaczną poprawę.
MWT mierzy opóźnienie (w minutach) uśpienia początku uśrednione podczas 4 sesji testowych w 2-godzinnych odstępach po nocnej polisomnografii. Podczas każdej sesji testowej badana była proszona o próbę pozostania na jawie bez stosowania nadzwyczajnych środków. Każda sesja testowa została zakończona po 20 minutach, jeśli sen nie wystąpił lub 10 minut po jego rozpoczęciu. CGI-C jest skalą 7-punktową, wyśrodkowaną na Bez zmian, i waha się od Bardzo Znacznie Gorzej do Bardzo Dużo Udoskonalonej. Pacjenci byli oceniani przez osoby oceniające, które nie miały dostępu do żadnych danych o pacjentach poza miarą ich wyjściowego nasilenia. Oceniającym nie udzielono żadnych szczegółowych wskazówek dotyczących kryteriów, które mieli stosować przy ocenie pacjentów.
Inne oceny wpływu obejmowały test wielokrotnego opóźnienia uśpienia (MSLT), skalę senności Epworth (ESS; seria pytań mających na celu ocenę stopnia senności w codziennych sytuacjach) Steer Clear Performance Test (SCPT; komputerowa ocena zdolności pacjenta do unikania uderzania w przeszkody w symulowanej sytuacji na drodze), standardowa polisomnografia nocna i dzienny dziennik snu pacjenta. Pacjentów oceniano także za pomocą skali jakości życia w narkolepsji (QOLIN), która zawiera sprawdzony kwestionariusz zdrowotny SF-36.
Oba badania wykazały poprawę w obiektywnych i subiektywnych pomiarach nadmiernej senności w ciągu dnia zarówno dla dawek 200 mg, jak i 400 mg w porównaniu z placebo. Pacjenci leczeni jedną z dawek Provigilu wykazywali statystycznie istotnie zwiększoną zdolność do pozostawania w stanie czuwania na MWT (wszystkie wartości p <0,001) przy tygodnie 3, 6, 9 i ostatnia wizyta w porównaniu z placebo i statystycznie istotnie większa globalna poprawa, oceniana na skali CGI-C (wszystkie wartości p <0.05).
Średnie opóźnienia snu (w minutach) na MWT w punkcie początkowym dla 2 kontrolowanych badań przedstawiono w Tabeli 1 poniżej, wraz ze średnią zmianą w stosunku do wartości wyjściowej w MWT podczas wizyty końcowej.
Odsetki pacjentów, którzy wykazali jakikolwiek stopień poprawy CGI-C w dwóch badaniach klinicznych pokazano w Tabeli 2 poniżej.
Podobne statystycznie znaczące ulepszenia związane z leczeniem zaobserwowano w przypadku innych miar upośledzenia w narkolepsja, w tym oceniany przez pacjenta poziom senności w ciągu dnia w ESS (p <0,001 dla każdej dawki w porównaniu do placebo).
Zastosowanie Provigil nie miało wpływu na sen nocny mierzony za pomocą polisomnografii.
Obturacyjny bezdech senny / zespół hipopnea (OSAHS)
Skuteczność Provigil w zmniejszaniu nadmiernej senności związanej z OSAHS została ustalona w dwóch badaniach klinicznych. W obu badaniach włączono pacjentów spełniających międzynarodową klasyfikację zaburzeń snu (ICSD) kryteria OSAHS (które są również zgodne z American Psychiatric Association DSM-IV kryteria). Kryteria te obejmują: 1) nadmierną senność lub bezsenność, a także częste epizody zaburzeń oddychanie podczas snu i związane z nim cechy, takie jak głośne chrapanie, poranne bóle głowy i suchość w jamie ustnej budzenie; lub 2) nadmierna senność lub bezsenność i polisomnografia wykazujące jeden z następujących objawów: więcej niż pięć bezdechów obturacyjnych, z których każda trwa dłużej niż 10 sekund, na godzinę snu i co najmniej jednego z poniższych: częste pobudzenia ze snu związane z bezdechami, bradykardię i desaturację tlenu w tętnicach w związku z bezdechy. Ponadto, aby wziąć udział w tych badaniach, wszyscy pacjenci musieli wykazywać nadmierną senność, jak wykazano wynikiem 10 on w skali senności Epworth, pomimo leczenia ciągłym dodatnim ciśnieniem w drogach oddechowych (CPAP). Wymagane były dowody, że CPAP skutecznie zmniejszał epizody bezdechu / hipopnei, wraz z dokumentacją stosowania CPAP.
W pierwszym badaniu, w 12-tygodniowym wieloośrodkowym badaniu kontrolowanym placebo, łącznie 327 pacjentów przydzielono losowo do grupy otrzymującej Provigil w dawce 200 mg / dobę, Provigil w dawce 400 mg / dobę lub pasujące placebo. Większość pacjentów (80%) była w pełni zgodna z CPAP, zdefiniowanym jako stosowanie CPAP> 4 godziny / noc w> 70% nocy. Pozostałe były częściowo zgodne z CPAP, zdefiniowane jako użycie CPAP 30% nocy. Stosowanie CPAP kontynuowano przez cały czas trwania badania. Głównymi miarami skuteczności były 1) opóźnienie snu, oceniane przez test utrzymania czuwania (MWT) i 2) zmiana ogólnego stanu chorobowego pacjenta, mierzona za pomocą globalnego obrazu klinicznego zmiany (CGI-C) w 12. tygodniu lub w ostatnim odwiedzić. (Widzieć Szlaki kliniczne, Sekcja Narkolepsja powyżej zawierająca opis tych testów).
U pacjentów leczonych preparatem Provigil wykazano statystycznie istotną poprawę zdolności do pozostać przytomny w porównaniu do pacjentów otrzymujących placebo, mierzonych za pomocą MWT (p <0,001) w punkcie końcowym [Tabela 1]. Pacjenci leczeni produktem Provigil wykazali również statystycznie istotną poprawę stanu klinicznego ocenianą na podstawie skali CGI-C (p <0,001) [Tabela 2]. Dwie dawki Provigil działały podobnie.
W drugim badaniu, w 4-tygodniowym wieloośrodkowym badaniu kontrolowanym placebo, 157 pacjentów zostało losowo przydzielonych do grupy Provigil w dawce 400 mg / dobę lub placebo. Wymagana była dokumentacja regularnego stosowania CPAP (co najmniej 4 godziny / noc w 70% nocy) dla wszystkich pacjentów. Pierwszorzędową miarą wyniku była zmiana w stosunku do wartości wyjściowej w ESS w 4. tygodniu lub podczas ostatniej wizyty. Wyjściowe wyniki ESS dla grup Provigil i placebo wyniosły odpowiednio 14,2 i 14,4. W 4. tygodniu ESS zmniejszył się o 4,6 w grupie Provigil i o 2,0 w grupie placebo, różnica była istotna statystycznie (p <0,0001).
Zastosowanie Provigil nie miało wpływu na sen nocny mierzony za pomocą polisomnografii.
Shift Work Sleep Disorder (SWSD)
Skuteczność Provigilu w nadmiernej senności związanej z SWSD wykazano w 12-tygodniowym badaniu klinicznym kontrolowanym placebo. W sumie 209 pacjentów z przewlekłą SWSD zrandomizowano do grupy otrzymującej Provigil w dawce 200 mg / dobę lub placebo. Wszyscy pacjenci spełnili kryteria Międzynarodowej Klasyfikacji Zaburzeń Snu (ICSD-10) dla przewlekłego SWSD (które są zgodny z kryteriami DSM-IV Amerykańskiego Towarzystwa Psychiatrycznego dla zaburzenia snu w rytmie okołodobowym: praca zmianowa Rodzaj). Kryteria te obejmują 1) albo: a) pierwotną skargę na nadmierną senność lub bezsenność, która jest czasowo związana z okresem pracy (zwykle praca nocna), który występuje podczas fazy zwykłego snu lub b) polisomnografia, a MSLT wykazuje utratę normalnego wzorca snu i czuwania (tj. zaburzony chronobiologiczny rytmika); oraz 2) żadne inne zaburzenie medyczne lub psychiczne nie powoduje objawów, oraz 3) objawy nie spełniają kryteriów w przypadku innych zaburzeń snu powodujących bezsenność lub nadmierną senność (np. zmiana strefy czasowej [jet lag] zespół).
Należy zauważyć, że nie wszyscy pacjenci z dolegliwościami senności, którzy również biorą udział w pracy zmianowej, spełniają kryteria rozpoznania SWSD. Do badania klinicznego włączono tylko pacjentów z objawami przez co najmniej 3 miesiące.
Zarejestrowani pacjenci byli również zobowiązani do pracy co najmniej 5 nocnych zmian w miesiącu, nadmiernej senności czas nocnych zmian (wynik MSLT <6 minut) i bezsenność w ciągu dnia udokumentowana polisomnogramem w ciągu dnia (PSG).
Podstawowymi miarami skuteczności były 1) opóźnienie snu, oceniane w teście wielokrotnego opóźnienia snu (MSLT) przeprowadzonym podczas symulowanej nocnej zmiany w 12. tygodniu lub ostatnia wizyta i 2) zmiana ogólnego stanu chorobowego pacjenta, mierzona za pomocą globalnego obrazu klinicznego zmian (CGI-C) w 12. tygodniu lub ostatniego odwiedzić. U pacjentów leczonych Provigil wykazano statystycznie istotne wydłużenie czasu do zaśnięcia w porównaniu do pacjentów otrzymujących placebo, co zmierzono za pomocą nocnej MSLT [Tabela 1] (p <0,05). Zaobserwowano również, że poprawa CGI-C była statystycznie istotna (p <0,001). (Widzieć Szlaki kliniczne, Sekcja Narkolepsja powyżej zawierająca opis tych testów).
Stosowanie Provigil nie miało wpływu na sen dzienny mierzony za pomocą polisomnografii.
Schowek HTML
| Nieład | Pomiar | Provigil 200 mg * |
Provigil 400 mg * |
Placebo | |||
| * Znacząco różny od placebo dla wszystkich badań (p <0,01 dla wszystkich badań, ale SWSD, który wynosił p <0,05) | |||||||
| Linia bazowa | Zmiana od linii podstawowej |
Linia bazowa | Zmiana od linii podstawowej |
Linia bazowa | Zmień z Linia bazowa |
||
| Narkolepsja I | MWT | 5.8 | 2.3 | 6.6 | 2.3 | 5.8 | -0.7 |
| Narkolepsja II | MWT | 6.1 | 2.2 | 5.9 | 2.0 | 6.0 | -0.7 |
| OSAHS | MWT | 13.1 | 1.6 | 13.6 | 1.5 | 13.8 | -1.1 |
| SWSD | MSLT | 2.1 | 1.7 | - | - | 2.0 | 0.3 |
| Nieład | Provigil 200 mg * |
Provigil 400 mg * |
Placebo |
| * Znacząco różni się od placebo we wszystkich badaniach (p <0,01) | |||
| Narkolepsja I | 64% | 72% | 37% |
| Narkolepsja II | 58% | 60% | 38% |
| OSAHS | 61% | 68% | 37% |
| SWSD | 74% | - | 36% |
Top
Wskazania i zastosowanie
Provigil jest wskazany do poprawy czuwania u dorosłych pacjentów z nadmierną sennością związaną z narkolepsją, obturacyjnym bezdechem sennym / zespołem hipopnea i zaburzeniami snu podczas pracy zmianowej.
W OSAHS Provigil jest wskazany jako uzupełnienie standardowego leczenia (leczenia) w przypadku niedrożności leżącej u podstaw. Jeśli ciągłe dodatnie ciśnienie w drogach oddechowych (CPAP) jest leczeniem z wyboru dla pacjenta, należy podjąć maksymalne wysiłki w celu leczenia CPAP przez odpowiedni okres czasu przed rozpoczęciem Provigil. Jeżeli Provigil stosuje się łącznie z CPAP, konieczne jest zachęcanie i okresowa ocena zgodności CPAP.
We wszystkich przypadkach bardzo ważna jest ostrożność w diagnozowaniu i leczeniu leżących u podstaw zaburzeń snu. Lekarze powinni mieć świadomość, że niektórzy pacjenci mogą mieć więcej niż jedno zaburzenie snu, które przyczynia się do ich nadmiernej senności.
Skuteczność modafinilu w długotrwałym stosowaniu (ponad 9 tygodni w badaniach klinicznych nad narkolepsją i 12 tygodni w badaniach klinicznych OSAHS i SWSD) nie była systematycznie oceniana w kontrolowanych placebo próby. Lekarz, który zdecyduje się przepisać Provigil na dłuższy czas pacjentom z narkolepsją, OSAHS lub SWSD, powinien okresowo dokonywać ponownej oceny długoterminowej przydatności dla danego pacjenta.
Top
Przeciwwskazania
Provigil jest przeciwwskazany u pacjentów ze znaną nadwrażliwością na modafinil, armodafinil lub jego nieaktywne składniki.
Top
Ostrzeżenia
Poważna wysypka, w tym zespół Stevensa-Johnsona
Zgłaszano ciężką wysypkę wymagającą hospitalizacji i przerwania leczenia u dorosłych i dzieci w związku ze stosowaniem modafinilu.
Modafinil nie jest zatwierdzony do stosowania u dzieci i młodzieży z jakiegokolwiek powodu.
W badaniach klinicznych modafinilu częstość występowania wysypki powodującej przerwanie leczenia wynosiła około 0,8% (13 na 1585) u dzieci i młodzieży (wiek <17 lat); wysypki te obejmowały 1 przypadek możliwego zespołu Stevensa-Johnsona (SJS) i 1 przypadek pozornej reakcji nadwrażliwości na wiele narządów. Kilka przypadków wiązało się z gorączką i innymi nieprawidłowościami (np. Wymioty, leukopenia). Mediana czasu na wysypkę, która spowodowała przerwanie leczenia, wyniosła 13 dni. Nie zaobserwowano takich przypadków wśród 380 pacjentów pediatrycznych otrzymujących placebo. Nie obserwowano poważnych wysypek skórnych w badaniach klinicznych u dorosłych (0 na 4 264) modafinilu.
Rzadkie przypadki ciężkiej lub zagrażającej życiu wysypki, w tym SJS, toksycznej martwicy naskórka (TEN) i wysypki lekowej z Eozynofilia i objawy ogólnoustrojowe (DRESS) były zgłaszane u dorosłych i dzieci na całym świecie po wprowadzeniu do obrotu doświadczenie. Wskaźnik zgłaszania TEN i SJS związanych ze stosowaniem modafinilu, który jest ogólnie uznawany za niedoszacowany ze względu na zaniżone zgłaszanie, przekracza wskaźnik zapadalności w tle. Szacunkowy wskaźnik zapadalności na te poważne reakcje skórne w ogólnej populacji wynosi od 1 do 2 przypadków na milion osobolat.
Nie ma czynników, które są znane z przewidywania ryzyka wystąpienia lub nasilenia wysypki związanej z modafinilem. Prawie wszystkie przypadki ciężkiej wysypki związanej z modafinilem wystąpiły w ciągu 1 do 5 tygodni po rozpoczęciu leczenia. Jednak pojedyncze przypadki zgłaszano po długotrwałym leczeniu (np. 3 miesiące). W związku z tym nie można polegać na czasie trwania terapii jako sposobie przewidywania potencjalnego ryzyka zwiastunem pierwszego pojawienia się wysypki.
Chociaż łagodne wysypki występują również w przypadku modafinilu, nie można wiarygodnie przewidzieć, które wysypki okażą się poważne. W związku z tym modafinil należy zwykle odstawiać przy pierwszych objawach wysypki, chyba że wysypka wyraźnie nie jest związana z lekami. Przerwanie leczenia nie może zapobiec wysypce, która może zagrażać życiu, trwale unieruchomić lub zniekształcić.
Obrzęk naczynioruchowy i reakcje anafilaktoidalne
Jeden poważny przypadek obrzęku naczynioruchowego i jeden przypadek nadwrażliwości (z wysypką, dysfagią i skurczem oskrzeli) to: zaobserwowano wśród 1595 pacjentów leczonych armodafinilem, enancjomerem R modafinilu (który jest racemiczny mieszanina). Nie obserwowano takich przypadków w badaniach klinicznych modafinilu. Jednak obrzęk naczynioruchowy zgłaszano po wprowadzeniu do obrotu modafinilu. Pacjentom należy zalecić przerwanie leczenia i natychmiastowe zgłoszenie lekarzowi wszelkich oznak lub objawy sugerujące obrzęk naczynioruchowy lub anafilaksję (np. obrzęk twarzy, oczu, warg, języka lub krtań; trudności w połykaniu lub oddychaniu; chrypka).
Reakcje nadwrażliwości na wiele narządów
Reakcje nadwrażliwości na wiele narządów, w tym co najmniej jedno zgon w doświadczeniu po wprowadzeniu do obrotu, występują wystąpił w ścisłym związku czasowym (mediana czasu do wykrycia 13 dni: zakres 4-33) do rozpoczęcia modafinil.
Chociaż liczba zgłoszeń była ograniczona, reakcje nadwrażliwości narządów mogą prowadzić do hospitalizacji lub zagrażać życiu. Nie są znane czynniki pozwalające przewidzieć ryzyko wystąpienia lub nasilenie reakcji nadwrażliwości narządów związanych z modafinilem. Objawy tego zaburzenia były zróżnicowane; jednak pacjenci zwykle, choć nie wyłącznie, cierpieli na gorączkę i wysypkę związaną z zajęciem innych narządów. Inne powiązane objawy to zapalenie mięśnia sercowego, zapalenie wątroby, nieprawidłowe wyniki testów czynnościowych wątroby, zaburzenia hematologiczne (np. eozynofilia, leukopenia, trombocytopenia), świąd i astenia. Ponieważ nadwrażliwość wielonarządowa ma zmienną ekspresję, mogą wystąpić inne objawy i oznaki narządu, nie wymienione tutaj.
Jeśli podejrzewa się reakcję nadwrażliwości na wiele narządów, Provigil należy przerwać. Chociaż nie ma przypadków opisujących wrażliwość krzyżową na inne leki wywołujące ten zespół, doświadczenie z lekami związanymi z nadwrażliwością wielonarządową wskazywałoby na to możliwość.
Trwała senność
Pacjentów z nienormalnym poziomem senności, którzy przyjmują Provigil, należy poinformować, że ich poziom czuwania może nie powrócić do normy. Pacjenci z nadmierną sennością, w tym pacjenci przyjmujący Provigil, powinni być często poddawani ponownej ocenie stopień senności i, w stosownych przypadkach, zaleca się unikanie prowadzenia pojazdu lub innych potencjalnie niebezpiecznych czynności. Osoby przepisujące lek powinny również zdawać sobie sprawę, że pacjenci mogą nie uznać senności lub senności, dopóki nie zostaną bezpośrednio zapytani o senność lub senność podczas określonych czynności.
Objawy psychiczne
Zgłaszano niepożądane działania psychiatryczne u pacjentów leczonych modafinilem. Zdarzenia niepożądane po wprowadzeniu do obrotu związane ze stosowaniem modafinilu obejmowały manię, urojenia, omamy, myśli samobójcze i agresję, niektóre z nich skutkowały hospitalizacją. Wielu, ale nie wszyscy pacjenci mieli wcześniej wywiad psychiatryczny. Jeden zdrowy mężczyzna-ochotnik opracował pomysły referencyjne, urojenia paranoidalne i halucynacje słuchowe w związku z wieloma codziennymi dawkami 600 mg modafinilu i pozbawieniem snu. Nie stwierdzono dowodów psychozy po 36 godzinach od odstawienia leku.
W bazie danych badań kontrolowanych modafinilu dla dorosłych objawy psychiczne prowadzące do przerwania leczenia (z częstością> 0,3%) i zgłaszane częściej u pacjentów leczeni modafinilem w porównaniu z placebo leczonymi byli: lęk (1%), nerwowość (1%), bezsenność (<1%), splątanie (<1%), pobudzenie (<1%) i depresja (<1%). Należy zachować ostrożność, gdy Provigil jest podawany pacjentom z historią psychozy, depresji lub manii. Należy wziąć pod uwagę możliwe pojawienie się lub zaostrzenie objawów psychicznych u pacjentów leczonych produktem Provigil. Jeśli objawy psychiczne rozwijają się w związku z podawaniem leku Provigil, należy rozważyć odstawienie leku Provigil.
Top
Środki ostrożności
Diagnoza zaburzeń snu
Provigil powinien być stosowany tylko u pacjentów, którzy zostali poddani pełnej ocenie nadmiernej senności iu których: rozpoznanie narkolepsji, OSAHS i / lub SWSD przeprowadzono zgodnie z kryteriami diagnostycznymi ICSD lub DSM (patrz Szlaki kliniczne). Taka ocena zazwyczaj składa się z pełnej historii i badania fizykalnego i może być uzupełniona badaniami w warunkach laboratoryjnych. Niektórzy pacjenci mogą mieć więcej niż jedno zaburzenie snu przyczyniające się do ich nadmiernej senności (np. OSAHS i SWSD występują u tego samego pacjenta).
Generał
Chociaż nie wykazano, aby modafinil powodował zaburzenia czynnościowe, każdy lek wpływający na OUN może wpływać na zdolność oceny, myślenia i zdolności motorycznych. Należy ostrzec pacjentów przed prowadzeniem samochodu lub innego niebezpiecznego urządzenia z uzasadnioną pewnością, że leczenie Provigilem nie wpłynie negatywnie na ich zdolność do takiego zaangażowania zajęcia.
Zastosowanie CPAP u pacjentów z OSAHS
W OSAHS Provigil jest wskazany jako uzupełnienie standardowego leczenia (leczenia) w przypadku niedrożności leżącej u podstaw. Jeśli ciągłe dodatnie ciśnienie w drogach oddechowych (CPAP) jest leczeniem z wyboru dla pacjenta, należy podjąć maksymalne wysiłki w celu leczenia CPAP przez odpowiedni okres czasu przed rozpoczęciem Provigil. Jeżeli Provigil stosuje się łącznie z CPAP, konieczne jest zachęcanie i okresowa ocena zgodności CPAP.
Układu sercowo-naczyniowego
Modafinil nie był oceniany u pacjentów z zawałem mięśnia sercowego lub niestabilną dławicą piersiową w wywiadzie, dlatego należy zachować ostrożność podczas leczenia takich pacjentów.
W badaniach klinicznych produktu Provigil objawy przedmiotowe i podmiotowe, w tym ból w klatce piersiowej, kołatanie serca, duszność i przemijające niedokrwienie Zmiany załamka T w EKG zaobserwowano u trzech osób w związku z wypadnięciem zastawki mitralnej lub lewej komory hipertrofia. Zaleca się, aby nie stosować tabletek Provigil u pacjentów z przerostem lewej komory serca w wywiadzie pacjenci z wypadnięciem zastawki mitralnej, którzy doświadczyli zespołu wypadnięcia zastawki mitralnej podczas wcześniejszego przyjmowania OUN stymulanty. Takie objawy mogą obejmować między innymi niedokrwienne zmiany w EKG, ból w klatce piersiowej lub arytmię. Jeśli wystąpi jakikolwiek z tych objawów, rozważ ocenę serca.
Monitorowanie ciśnienia krwi w krótkoterminowych (<3 miesiące) kontrolowanych badaniach nie wykazało klinicznie istotnego wpływu zmiany średniego skurczowego i rozkurczowego ciśnienia krwi u pacjentów otrzymujących Provigil w porównaniu do placebo. Jednak retrospektywna analiza stosowania leków przeciwnadciśnieniowych w tych badaniach wykazała, że większy odsetek pacjenci otrzymujący Provigil wymagali nowego lub zwiększonego stosowania leków przeciwnadciśnieniowych (2,4%) w porównaniu do pacjentów otrzymujących placebo (0,7%). Zróżnicowane użycie było nieco większe, gdy uwzględniono tylko badania OSAHS, z udziałem 3,4% pacjentów Provigil i 1,1% pacjentów otrzymujących placebo, wymagających takich zmian w stosowaniu leków przeciwnadciśnieniowych lek. U pacjentów przyjmujących Provigil właściwe może być zwiększone monitorowanie ciśnienia krwi.
Pacjenci stosujący steroidowe środki antykoncepcyjne
Skuteczność steroidowych środków antykoncepcyjnych może być zmniejszona, gdy stosuje się je z tabletkami Provigil i przez jeden miesiąc po zakończeniu leczenia (patrz Środki ostrożności, Interakcje z lekami). Zaleca się stosowanie alternatywnych lub jednoczesnych metod antykoncepcji u pacjentów leczonych tabletkami Provigil i przez miesiąc po odstawieniu Provigil.
Pacjenci stosujący cyklosporynę
Stężenia cyklosporyny we krwi mogą być zmniejszone podczas stosowania z Provigil (patrz Środki ostrożności, Interakcje z lekami). W przypadku jednoczesnego stosowania tych leków należy rozważyć monitorowanie stężeń cyklosporyny w krążeniu i odpowiednie dostosowanie dawki cyklosporyny.
Pacjenci z ciężkim zaburzeniem czynności wątroby
U pacjentów z ciężkimi zaburzeniami czynności wątroby, z marskością wątroby lub bez (patrz Farmakologia kliniczna), Provigil należy podawać w zmniejszonej dawce (patrz Dawkowanie i sposób podawania).
Pacjenci z ciężkim zaburzeniem czynności nerek
Brak wystarczających informacji do ustalenia bezpieczeństwa i skuteczności dawkowania u pacjentów z ciężkimi zaburzeniami czynności nerek. (Aby zapoznać się z farmakokinetyką w zaburzeniach czynności nerek, patrz Farmakologia kliniczna.)
Starsi pacjenci
U pacjentów w podeszłym wieku eliminacja modafinilu i jego metabolitów może być zmniejszona w wyniku starzenia się. Dlatego należy rozważyć zastosowanie niższych dawek w tej populacji. (Widzieć Farmakologia kliniczna i Dawkowanie i sposób podawania).
Informacje dla pacjentów
Zaleca się, aby lekarze omawiali następujące kwestie z pacjentami, którym przepisują Provigil.
Provigil jest wskazany u pacjentów z nienormalnym poziomem senności. Wykazano, że Provigil poprawia się, ale nie eliminuje tej nienormalnej tendencji do zasypiania. Dlatego pacjenci nie powinni zmieniać swoich wcześniejszych zachowań w odniesieniu do potencjalnie niebezpiecznych czynności (np. Prowadzenia pojazdów, obsługiwania maszyn) lub innych czynności wymagające odpowiedniego poziomu czuwania, dopóki nie zostanie wykazane, że leczenie produktem Provigil wywołuje takie poziomy czuwania, które pozwalają na takie zajęcia. Należy poinformować pacjentów, że Provigil nie zastępuje snu.
Pacjentów należy poinformować, że może być niezwykle ważne, aby kontynuowali wcześniej przepisane leczenie (np. Pacjenci z OSAHS otrzymujący CPAP powinni nadal to robić).
Pacjentów należy poinformować o dostępności ulotki informacyjnej dla pacjenta i poinstruować ją, aby przeczytała ulotkę przed zastosowaniem leku Provigil.
Pacjentom należy doradzić, aby skontaktowali się z lekarzem, jeśli odczują ból w klatce piersiowej, wysypkę, depresję, niepokój lub oznaki psychozy lub manii.
Ciąża
Pacjentom należy zalecić powiadomienie lekarza, jeśli zajdzie w ciążę lub planuje zajść w ciążę podczas terapii. Należy ostrzec pacjentkę przed potencjalnym zwiększonym ryzykiem zajścia w ciążę podczas stosowania steroidowych środków antykoncepcyjnych (w tym zajezdni lub implantów środki antykoncepcyjne) z Provigil i przez miesiąc po zakończeniu leczenia (patrz Rakotwórczość, Mutageneza, Upośledzenie Płodności i Ciąża).
Pielęgniarstwo
Pacjentom należy zalecić powiadomienie lekarza, jeśli karmią niemowlę.
Jednoczesne leki
Pacjentom należy doradzić, aby poinformowali swojego lekarza, jeśli przyjmują lub planują przyjmować jakiekolwiek leki na receptę lub bez recepty, ze względu na możliwość interakcji między Provigil i inne leki.
Alkohol
Należy poinformować pacjentów, że stosowanie Provigil w połączeniu z alkoholem nie było badane. Należy poinformować pacjentów, że ostrożne jest unikanie spożywania alkoholu podczas przyjmowania leku Provigil.
Reakcje alergiczne
Pacjentom należy zalecić zaprzestanie przyjmowania leku Provigil i powiadomić lekarza, jeśli wystąpi wysypka, pokrzywka, owrzodzenia jamy ustnej, pęcherze, łuszczenie się skóry, problemy z przełykaniem lub oddychaniem lub pokrewna alergia zjawisko.
Interakcje z lekami
Aktywne leki CNS
Metylofenidat
W badaniu z pojedynczą dawką u zdrowych ochotników jednoczesne podawanie modafinilu (200 mg) z metylofenidat (40 mg) nie spowodował żadnych istotnych zmian w farmakokinetyce żadnego z nich narkotyk. Jednak wchłanianie Provigilu może być opóźnione o około godzinę w przypadku jednoczesnego podawania z metylofenidatem.
W badaniu wielokrotnych dawek w stanie stacjonarnym u zdrowych ochotników modafinil podawano raz dziennie w dawce 200 mg / dobę przez 7 dni, a następnie 400 mg / dobę przez 21 dni. Podawanie metylofenidatu (20 mg / dzień) podczas 22-28 dni leczenia modafinilem 8 godzin później dzienna dawka modafinilu nie spowodowała żadnych istotnych zmian w farmakokinetyce modafinil.
Dekstroamfetamina
W badaniu z pojedynczą dawką u zdrowych ochotników jednoczesne podawanie modafinilu (200 mg) z dekstroamfetamina (10 mg) nie spowodowała żadnych istotnych zmian w farmakokinetyce żadnego z nich narkotyk. Jednak wchłanianie Provigilu może być opóźnione o około godzinę w przypadku jednoczesnego podawania z dekstroamfetaminą.
W badaniu wielokrotnych dawek w stanie stacjonarnym u zdrowych ochotników modafinil podawano raz dziennie w dawce 200 mg / dobę przez 7 dni, a następnie 400 mg / dobę przez 21 dni. Podawanie dekstroamfetaminy (20 mg / dzień) podczas 22-28 dni leczenia modafinilem 7 godzin później dzienna dawka modafinilu nie spowodowała żadnych istotnych zmian w farmakokinetyce modafinil.
Klomipramina
Jednoczesne stosowanie pojedynczej dawki klomipraminy (50 mg) w pierwszym z trzech dni leczenia modafinil (200 mg / dzień) u zdrowych ochotników nie wykazywał wpływu na farmakokinetykę żadnego z leków. Jednak u pacjenta z narkolepsją podczas leczenia modafinilem zgłoszono jeden przypadek zwiększonego poziomu klomipraminy i jej aktywnego metabolitu demetyloklomipraminy.
Triazolam
W badaniu interakcji między Provigilem a etynyloestradiolem (EE2) w tych samych dniach, co dla w próbce osocza pod kątem farmakokinetyki EE2 podano również pojedynczą dawkę triazolamu (0,125 mg). Średnie Cmax i AUC0-β triazolamu zmniejszyły się odpowiednio o 42% i 59%, a okres półtrwania w fazie eliminacji zmniejszył się o około godzinę po leczeniu modafinilem.
Inhibitory monoaminooksydazy (MAO)
Nie przeprowadzono badań interakcji z inhibitorami monoaminooksydazy. Dlatego należy zachować ostrożność podczas jednoczesnego podawania inhibitorów MAO i modafinilu.
Inne leki
Warfaryna
Nie stwierdzono istotnych zmian w profilach farmakokinetycznych warfaryny R i S u zdrowych osób, którym podano pojedynczą dawkę warfaryny racemicznej (5 mg) po przewlekłym podawaniu modafinilu (200 mg / dobę przez 7 dni, a następnie 400 mg / dobę przez 27 dni) w odniesieniu do profili u badanych placebo. Jednak zaleca się częstsze monitorowanie czasów protrombiny / INR, ilekroć Provigil jest podawany jednocześnie z warfaryną (patrz Farmakologia kliniczna, Farmakokinetyka, interakcje między lekami).
Etynyloestradiol
Podawanie modafinilu ochotniczkom raz dziennie w dawce 200 mg / dobę przez 7 dni, a następnie 400 mg / dzień przez 21 dni spowodował średni spadek Cmax o 11% i spadek AUC0-24 etynyloestradiolu o 18% (EE2; 0,035 mg; podawany doustnie z norgestimate). Nie było widocznej zmiany w szybkości eliminacji etynyloestradiolu.
Cyklosporyna
Jeden przypadek interakcji między modafinilem a cyklosporyną, substratem CYP3A4, odnotowano u 41-letniej kobiety, która przeszła przeszczep narządu. Po miesiącu podawania 200 mg / dobę modafinilu poziomy cyklosporyny we krwi zmniejszyły się o 50%. Postulowano, że interakcja jest spowodowana zwiększonym metabolizmem cyklosporyny, ponieważ nie zmienił się żaden inny czynnik mający wpływ na dyspozycję leku. Może być konieczne dostosowanie dawki cyklosporyny.
Potencjalne interakcje z lekami, które hamują, indukują lub są metabolizowane przez izoenzymy cytochromu P-450 i inne enzymy wątrobowe
W badaniach in vitro z wykorzystaniem pierwotnych kultur ludzkich hepatocytów modafinil nieznacznie indukował CYP1A2, CYP2B6 i CYP3A4 w sposób zależny od stężenia. Chociaż wyniki indukcji oparte na doświadczeniach in vitro niekoniecznie przewidują odpowiedź in vivo, należy zachować ostrożność należy ćwiczyć, gdy Provigil jest podawany jednocześnie z lekami zależnymi od tych trzech enzymów luz. W szczególności może to spowodować obniżenie poziomu takich leków we krwi (patrz Inne leki, Cyklosporyna powyżej).
Ekspozycja ludzkich hepatocytów na modafinil in vitro spowodowała pozorną supresję ekspresji aktywności CYP2C9 sugerując, że istnieje możliwość interakcji metabolicznej między modafinilem i substratami tego enzymu (np. S-warfaryna i fenytoina). W kolejnym badaniu klinicznym z udziałem zdrowych ochotników przewlekłe leczenie modafinilem nie wykazało znaczącego wpływu na farmakokinetykę warfaryny w pojedynczej dawce w porównaniu z placebo (patrz Środki ostrożności, Interakcje z lekami, warfaryna).
Badania in vitro z wykorzystaniem mikrosomów ludzkiej wątroby wykazały, że modafinil odwracalnie hamował CYP2C19 przy farmakologicznie istotnych stężeniach modafinilu. CYP2C19 jest również odwracalnie hamowany, z podobną siłą, przez krążący metabolit, sulfon modafinilu. Chociaż maksymalne stężenia sulfonu modafinilowego w osoczu są znacznie niższe niż stężenia macierzystego modafinil, połączone działanie obu związków może powodować przedłużone częściowe hamowanie enzym. Leki, które są w dużej mierze eliminowane przez metabolizm CYP2C19, takie jak diazepam, propranolol, fenytoina (również poprzez CYP2C9) lub S-mefenytoina może ulegać przedłużonej eliminacji po jednoczesnym podaniu z Provigil i może wymagać zmniejszenia dawki i monitorowania dla toksyczności.
Trójpierścieniowe leki przeciwdepresyjne
CYP2C19 zapewnia również pomocniczy szlak metabolizmu niektórych trójpierścieniowych leków przeciwdepresyjnych (np. Klomipraminy i dezypraminy), które są metabolizowane głównie przez CYP2D6. U pacjentów leczonych trójpierścieniami z niedoborem CYP2D6 (tj. Tych, którzy są słabo metabolizowani debrizochiny; 7–10% populacji kaukaskiej; podobny lub niższy w innych populacjach), poziom metabolizmu przez CYP2C19 może być znacznie zwiększony. Provigil może powodować podwyższenie poziomów leków trójpierścieniowych w tej podgrupie pacjentów. Lekarze powinni mieć świadomość, że u tych pacjentów może być konieczne zmniejszenie dawki leków trójpierścieniowych.
Ponadto, ze względu na częściowe zaangażowanie CYP3A4 w metaboliczną eliminację modafinilu, jednoczesne podawanie silnych induktorów CYP3A4 (np. karbamazepina, fenobarbital, ryfampina) lub inhibitory CYP3A4 (np. ketokonazol, itrakonazol) mogą zmieniać stężenie w osoczu modafinil.
Rakotwórczość, mutageneza, upośledzenie płodności
Rakotwórczość
Przeprowadzono badania rakotwórczości, w których modafinil podawano w diecie myszom przez 78 tygodni i szczurom przez 104 tygodnie w dawkach 6, 30 i 60 mg / kg / dobę. Najwyższa badana dawka to 1,5 (mysz) lub 3 (szczur) razy większa niż zalecana dzienna dawka modafinilu dla dorosłych ludzi (200 mg) w przeliczeniu na mg / m2. W tych badaniach nie stwierdzono dowodów na nowotwór związany z podawaniem modafinilu. Ponieważ jednak w badaniu na myszach zastosowano nieodpowiednią wysoką dawkę, która nie była reprezentatywna dla maksymalnej tolerowanej dawki, kolejne badanie rakotwórczości przeprowadzono w Tg. Mysz transgeniczna AC. Dawki oceniane w Tg. Testy AC wynosiły 125, 250 i 500 mg / kg / dzień, podawane skórnie. Nie stwierdzono dowodów na rakotwórczość związaną z podawaniem modafinilu; jednak ten model skóry nie może odpowiednio ocenić potencjału rakotwórczego doustnie podawanego leku.
Mutageneza
Modafinil nie wykazał potencjału mutagennego ani klastogennego w serii in vitro (tj. W teście odwrotnej mutacji bakteryjnej, teście tkaka chłoniaka myszy, aberracji chromosomalnej test na ludzkich limfocytach, test transformacji komórek w mysich komórkach zarodkowych BALB / 3T3) test przy braku lub w obecności aktywacji metabolicznej lub in vivo (mikrojądro mysiego szpiku kostnego) testy. Modafinil był również ujemny w nieplanowanym teście syntezy DNA w hepatocytach szczurów.
Upośledzenie płodności
Doustne podawanie modafinilu (dawki do 480 mg / kg / dobę) samcom i samcom szczurów przed i przez cały okres kojarzenie i utrzymywanie się u samic do 7 dnia ciąży spowodowało wydłużenie czasu do kojarzenia w najwyższym czasie dawka; nie zaobserwowano wpływu na inne parametry płodności lub reprodukcyjne. Dawka niepowodująca zmian wynosząca 240 mg / kg / dobę była związana z ekspozycją na modafinil w osoczu (AUC) w przybliżeniu równą ekspozycji u ludzi przy zalecanej dawce 200 mg.
Ciąża
Ciąża Kategoria C:
W badaniach przeprowadzonych na szczurach i królikach obserwowano toksyczność rozwojową przy klinicznie istotnych ekspozycjach.
Modafinil (50, 100 lub 200 mg / kg / dzień) podawany doustnie ciężarnym szczurom przez cały okres organogenezy spowodowany brakiem toksyczność dla matek, zwiększenie resorpcji i zwiększenie częstości zmian trzewnych i szkieletowych u potomstwa dawka. Wyższa dawka niepowodująca zmian w toksyczności rozwojowej zarodka i płodu szczura była związana z osoczem ekspozycja na modafinil około 0,5 razy AUC u ludzi w zalecanej dawce dobowej (RHD) wynoszącej 200 mg Jednak w kolejnym badaniu do 480 mg / kg / dobę (ekspozycja na modafinil w osoczu około 2 razy większa niż AUC u ludzi przy RHD) nie zaobserwowano niekorzystnego wpływu na rozwój zarodka i płodu.
Modafinil podawany doustnie ciężarnym królikom przez cały okres organogenezy w dawkach 45, 90 i 180 mg / kg / dobę zwiększało częstość zmian strukturalnych płodu i śmierci zarodka i płodu po podaniu największej dawki. Najwyższa dawka niepowodująca efektów toksyczności rozwojowej była związana z AUC modafinilu w osoczu w przybliżeniu równym AUC u ludzi przy RHD.
Podawanie doustne armodafinilu (enancjomer R modafinilu; 60, 200 lub 600 mg / kg / dzień) ciężarnym szczurom przez cały okres organogenezy powodowało zwiększenie częstości zmiany trzewiowe i szkieletowe płodu przy dawce pośredniej lub większej i najwyższe zmniejszenie masy ciała płodu dawka. Dawka niepowodująca skutków toksyczności rozwojowej zarodka i płodu szczura była związana z armodafinilem w osoczu ekspozycja (AUC) około jednej dziesiątej wartości AUC armodafinilu u ludzi leczonych modafinilem w RHD.
Podawanie modafinilu szczurom podczas ciąży i laktacji w dawkach doustnych do 200 mg / kg / dobę powodowało zmniejszenie żywotność u potomstwa w dawkach większych niż 20 mg / kg / dobę (AUC modafinilu w osoczu około 0,1 razy AUC u ludzi w RHD). Nie zaobserwowano wpływu na parametry rozwojowe po urodzeniu i parametry neurobehawioralne u potomstwa, które przeżyło.
Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Zgłoszono dwa przypadki wewnątrzmacicznego opóźnienia wzrostu i jeden przypadek samoistnej aborcji w związku z armodafinilem i modafinilem. Chociaż farmakologia modafinilu i armodafinilu nie jest identyczna z farmakologią amin sympatykomimetycznych, mają one pewne właściwości farmakologiczne z tą klasą. Niektóre z tych leków wiążą się z wewnątrzmacicznym opóźnieniem wzrostu i spontanicznymi poronieniami. Nie wiadomo, czy zgłoszone przypadki dotyczą narkotyków.
Modafinil należy stosować w okresie ciąży tylko wtedy, gdy potencjalna korzyść uzasadnia potencjalne ryzyko dla płodu.
Praca i dostawa
Wpływ modafinilu na poród i poród u ludzi nie był systematycznie badany.
Matki karmiące
Nie wiadomo, czy modafinil lub jego metabolity przenikają do mleka ludzkiego. Ponieważ wiele leków przenika do mleka ludzkiego, należy zachować ostrożność podczas podawania tabletek Provigil kobiecie karmiącej.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność u dzieci i młodzieży w wieku poniżej 16 lat nie zostały ustalone. Poważne wysypki skórne, w tym rumień wielopostaciowy (EMM) i zespół Stevensa-Johnsona (SJS), były związane ze stosowaniem modafinilu u dzieci (patrz Ostrzeżenia, Ciężka wysypka, w tym zespół Stevensa-Johnsona).
W kontrolowanym 6-tygodniowym badaniu 165 pacjentów pediatrycznych (w wieku 5-17 lat) z narkolepsją leczono modafinilem (n = 123) lub placebo (n = 42). Nie było istotnych statystycznie różnic faworyzujących modafinil w porównaniu z placebo w przedłużaniu latencji snu mierzone za pomocą MSLT lub postrzegania senności zgodnie z globalną skalą kliniczno-impresyjną (CGI-C).
W kontrolowanych i otwartych badaniach klinicznych leczenie ujawniło zdarzenia niepożądane ze strony układu psychicznego i nerwowego obejmował zespół Tourette'a, bezsenność, wrogość, wzrost katapleksji, zwiększenie halucynacji hipnagogicznych i samobójczych ideacja. Obserwowano również przejściową leukopenię, która ustąpiła bez interwencji medycznej. W kontrolowanym badaniu klinicznym u 3 z 38 dziewcząt w wieku 12 lat lub starszych leczonych modafinilem wystąpiło bolesne miesiączkowanie w porównaniu z 0 z 10 dziewcząt, które otrzymały placebo.
Zastosowanie geriatryczne
Bezpieczeństwo i skuteczność u osób powyżej 65 roku życia nie zostały ustalone. Doświadczenie u ograniczonej liczby pacjentów w wieku powyżej 65 lat w badaniach klinicznych wykazało występowanie działań niepożądanych podobnych do innych grup wiekowych.
Top
Działania niepożądane
Modafinil oceniono pod kątem bezpieczeństwa u ponad 3500 pacjentów, w tym u ponad 2000 pacjentów z nadmiarem senność związana z pierwotnymi zaburzeniami snu i czuwania podano co najmniej jedną dawkę modafinil. W badaniach klinicznych modafinil był ogólnie dobrze tolerowany, a większość działań niepożądanych była łagodna do umiarkowanej.
Najczęściej obserwowane zdarzenia niepożądane (â ‰% 5%) związane ze stosowaniem Provigil częściej niż pacjenci otrzymujący placebo u pacjentów kontrolowanych placebo badaniami klinicznymi dotyczącymi pierwotnych zaburzeń snu i czuwania były: ból głowy, nudności, nerwowość, nieżyt nosa, biegunka, ból pleców, lęk, bezsenność, zawroty głowy i niestrawność. Profil zdarzeń niepożądanych był podobny we wszystkich badaniach.
W kontrolowanych placebo badaniach klinicznych 74 z 934 pacjentów (8%), którzy otrzymywali Provigil, przerwało leczenie z powodu działań niepożądanych w porównaniu z 3% pacjentów otrzymujących placebo. Najczęstsze przyczyny przerwania leczenia, które występowały częściej w przypadku Provigilu niż placebo u pacjentów występowały bóle głowy (2%), nudności, niepokój, zawroty głowy, bezsenność, ból w klatce piersiowej i nerwowość (każdy <1%). W kanadyjskim badaniu klinicznym 35-letni otyły narkoleptyczny mężczyzna z wcześniejszymi epizodami omdlenia wystąpił 9-sekundowy epizod asystolii po 27 dniach leczenia modafinilem (300 mg / dzień podzielony dawki).
Częstość występowania w kontrolowanych badaniach
Poniższa tabela (Tabela 3) przedstawia działania niepożądane występujące w tempie 1% lub większym i występowały częściej u dorosłych pacjentów leczonych produktem Provigil niż u pacjentów otrzymujących placebo w głównej grupie klinicznej kontrolowanej placebo próby.
Lekarz przepisujący lek powinien mieć świadomość, że przedstawione poniżej dane liczbowe nie mogą być wykorzystane do przewidzenia częstości występowania działań niepożądanych w przebieg zwykłej praktyki medycznej, w której cechy pacjenta i inne czynniki mogą różnić się od tych występujących podczas badań klinicznych studia. Podobnie cytowanych częstotliwości nie można bezpośrednio porównać z danymi uzyskanymi z innych badań klinicznych obejmujących różne metody leczenia, zastosowania lub badaczy. Przegląd tych częstości daje jednak lekarzom podstawy do oszacowania względnego wkładu czynników odurzających i nielekowych w częstość występowania zdarzeń niepożądanych w badanej populacji.
| Układ organizmu | Preferowany termin | Modafinil (n = 934) |
Placebo (n = 567) |
| * Sześć podwójnie zaślepionych, kontrolowanych placebo badań klinicznych w narkolepsji, OSAHS i SWSD. 1 Uwzględniono zdarzenia zgłoszone przez co najmniej 1% pacjentów leczonych produktem Provigil, które występowały częściej niż w grupie placebo; zapadalność zaokrągla się do najbliższego 1%. Terminologia działań niepożądanych jest kodowana przy użyciu standardowego zmodyfikowanego słownika COSTART. Zdarzenia, dla których częstość występowania Provigil wynosiła co najmniej 1%, ale równa lub mniejsza niż placebo, nie są wymienione w tabeli. Zdarzenia te obejmowały: zakażenie, ból, przypadkowe uszkodzenie, ból brzucha, hipotermię, reakcję alergiczną, osłabienie, gorączkę, zakażenie wirusowe, ból szyi, migrenę, nieprawidłowy elektrokardiogram, niedociśnienie, zaburzenia zębów, wymioty, ropień przyzębia, zwiększony apetyt, wybroczyny, hiperglikemia, obrzęki obwodowe, utrata masy ciała, waga zysk, bóle mięśni, skurcze nóg, zapalenie stawów, katapleksja, zaburzenia myślenia, zaburzenia snu, zwiększony kaszel, zapalenie zatok, duszność, zapalenie oskrzeli, wysypka, zapalenie spojówek, ból ucha, bolesne miesiączkowanie4, zakażenie dróg moczowych. 2 Podwyższone enzymy wątrobowe. 3 Dyskinezy ustno-twarzowe. 4 Częstość występowania dostosowana do płci. | |||
| Ciało jako całość | Bół głowy | 34% | 23% |
| Ból pleców | 6% | 5% | |
| Syndrom grypy | 4% | 3% | |
| Ból w klatce piersiowej | 3% | 1% | |
| Dreszcze | 1% | 0% | |
| Sztywność szyi | 1% | 0% | |
| Sercowo-naczyniowe | Nadciśnienie | 3% | 1% |
| Częstoskurcz | 2% | 1% | |
| Palpitacja | 2% | 1% | |
| Rozszerzenie naczyń krwionośnych | 2% | 0% | |
| Trawienny | Nudności | 11% | 3% |
| Biegunka | 6% | 5% | |
| Niestrawność | 5% | 4% | |
| Suche usta | 4% | 2% | |
| Anoreksja | 4% | 1% | |
| Zaparcie | 2% | 1% | |
| Nieprawidłowa czynność wątroby2 | 2% | 1% | |
| Bębnica | 1% | 0% | |
| Owrzodzenie jamy ustnej | 1% | 0% | |
| Pragnienie | 1% | 0% | |
| Hemic / Lymphatic | Eozynofilia | 1% | 0% |
| Metaboliczny / odżywczy | Obrzęk | 1% | 0% |
| Nerwowy | Nerwowość | 7% | 3% |
| Bezsenność | 5% | 1% | |
| Niepokój | 5% | 1% | |
| Zawroty głowy | 5% | 4% | |
| Depresja | 2% | 1% | |
| Parestezja | 2% | 0% | |
| Senność | 2% | 1% | |
| Hipertonia | 1% | 0% | |
| Dyskinezy3 | 1% | 0% | |
| Hiperkinezja | 1% | 0% | |
| Podniecenie | 1% | 0% | |
| Zamieszanie | 1% | 0% | |
| Drżenie | 1% | 0% | |
| Labilność emocjonalna | 1% | 0% | |
| Zawrót głowy | 1% | 0% | |
| Oddechowy | Katar | 7% | 6% |
| Zapalenie gardła | 4% | 2% | |
| Zaburzenia płuc | 2% | 1% | |
| Krwawienie z nosa | 1% | 0% | |
| Astma | 1% | 0% | |
| Skórka / Dodatki | Wyzysk | 1% | 0% |
| Herpes Simplex | 1% | 0% | |
| Specjalne zmysły | Niedowidzenie | 1% | 0% |
| Nieprawidłowe widzenie | 1% | 0% | |
| Perwersja smaku | 1% | 0% | |
| Ból oka | 1% | 0% | |
| Moczowo-płciowy | Nieprawidłowość moczu | 1% | 0% |
| Krwiomocz | 1% | 0% | |
| Pyuria | 1% | 0% |
Zależność dawki od zdarzeń niepożądanych
W kontrolowanych placebo badaniach klinicznych dla dorosłych, w których porównywano dawki 200, 300 i 400 mg na dobę Provigil i placebo, jedynymi zdarzeniami niepożądanymi, które były wyraźnie związane z dawką były bóle głowy i niepokój.
Zmiany w zakresie funkcji życiowych
Chociaż nie było spójnej zmiany średnich wartości częstości akcji serca lub skurczowego i rozkurczowego ciśnienia krwi, to zapotrzebowanie na leki przeciwnadciśnieniowe było nieco większe u pacjentów przyjmujących Provigil w porównaniu do placebo (patrz Środki ostrożności).
Zmiany masy ciała
Nie stwierdzono istotnych klinicznie różnic w zmianie masy ciała u pacjentów leczonych Provigilem w porównaniu do pacjentów otrzymujących placebo w kontrolowanych placebo badaniach klinicznych.
Zmiany laboratoryjne
Parametry kliniczne chemii, hematologii i analizy moczu monitorowano w badaniach fazy 1, 2 i 3. W tych badaniach stwierdzono, że średnie poziomy gamma glutamylotransferazy (GGT) i fosfatazy alkalicznej (AP) były wyższe po podaniu Provigilu, ale nie placebo. Jednak niewielu pacjentów miało podwyższenie GGT lub AP poza normalnym zakresem. Przesunięcia do wyższych, ale nie klinicznie istotnych nieprawidłowości, wartości GGT i AP wydawały się zwiększać z czasem w populacji leczonej Provigilem w badaniach klinicznych fazy 3. Nie stwierdzono różnic w aminotransferazie alaninowej, aminotransferazie asparaginianowej, białku całkowitym, albuminie lub bilirubinie całkowitej.
Zmiany w EKG
W badaniach klinicznych kontrolowanych placebo po podaniu produktu Provigil nie stwierdzono wzorca powstałego w wyniku leczenia zaburzeń EKG.
Raporty po wprowadzeniu do obrotu
Podczas stosowania produktu Provigil po zatwierdzeniu stwierdzono następujące działania niepożądane. Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, nie można wiarygodnie oszacować ich częstości ani ustalić związku przyczynowego z ekspozycją na lek. Decyzje o włączeniu tych reakcji do oznakowania zazwyczaj opierają się na jednym lub więcej z następujących czynników: (1) powaga reakcji, (2) częstotliwość zgłaszania lub (3) siła związku przyczynowego z Provigil.
Hematologiczna: agranulocytoza
Top
Nadużywanie narkotyków i uzależnienie
Klasa substancji kontrolowanych
Modafinil (Provigil) jest wymieniony w załączniku IV ustawy o kontrolowanych substancjach.
Potencjalne nadużycie i uzależnienie
Oprócz działania promującego bezsenność i zwiększonej aktywności ruchowej u zwierząt, u ludzi, Provigil wytwarza efekty psychoaktywne i euforyczne, zmiany nastroju, percepcji, myślenia i uczuć typowe dla innych stymulantów OUN. W badaniach wiązania in vitro modafinil wiąże się z miejscem wychwytu zwrotnego dopaminy i powoduje wzrost pozakomórkowej dopaminy, ale nie zwiększa uwalniania dopaminy. Modafinil wzmacnia, o czym świadczy jego samodzielne podawanie małpom uprzednio przeszkolonym do samodzielnego podawania kokainy. W niektórych badaniach modafinil był również częściowo dyskryminowany jako środek pobudzający. Lekarze powinni uważnie obserwować pacjentów, szczególnie tych, którzy w przeszłości używali narkotyków i / lub stymulantów (np. Metylofenidatu, amfetaminy lub kokainy). Pacjentów należy obserwować pod kątem oznak niewłaściwego stosowania lub nadużywania (np. Zwiększania dawek lub zachowań związanych z poszukiwaniem narkotyków).
Potencjał nadużywania modafinilu (200, 400 i 800 mg) oceniono w porównaniu z metylofenidatem (45 i 90 mg) w badaniu stacjonarnym z udziałem osób doświadczających nadużywania narkotyków. Wyniki tego badania klinicznego wykazały, że modafinil wywoływał efekty psychoaktywne i euforyczne oraz odczucia zgodne z innymi zaplanowanymi stymulantami OUN (metylofenidat).
Wycofanie
Skutki odstawienia modafinilu monitorowano po 9 tygodniach stosowania modafinilu w jednym kontrolowanym badaniu klinicznym fazy 3 w USA. Podczas 14 dni obserwacji nie zaobserwowano żadnych szczególnych objawów odstawienia, chociaż u pacjentów z narkolepsją wróciła senność.
Top
Przedawkowanie
Ludzkie doświadczenie
W badaniach klinicznych w sumie 151 dawek określonych w protokole, w zakresie od 1000 do 1600 mg / dobę (5 do 8 razy więcej niż zalecana dawka dobowa 200 mg) podano 32 pacjentom, w tym 13 osobom, które otrzymywały dawki 1000 lub 1200 mg / dobę przez 7 do 21 kolejnych dni. Ponadto wystąpiło kilka celowych ostrych przedawkowania; dwa największe to 4500 mg i 4000 mg podjęte przez dwóch uczestników biorących udział w zagranicznych badaniach depresji. Żaden z tych uczestników badania nie doświadczył żadnych nieoczekiwanych lub zagrażających życiu efektów. Działania niepożądane zgłaszane przy tych dawkach obejmowały pobudzenie lub pobudzenie, bezsenność oraz niewielkie lub umiarkowane zwiększenie parametrów hemodynamicznych. Inne obserwowane skutki dużych dawek w badaniach klinicznych obejmowały lęk, drażliwość, agresywność, splątanie, nerwowość, drżenie, kołatanie serca, zaburzenia snu, nudności, biegunka i zmniejszona protrombina czas.
Z doświadczenia po wprowadzeniu do obrotu nie wynika, że śmiertelne przedawkowanie dotyczyło samego modafinilu (dawki do 12 gramów). Przedawkowanie wielu leków, w tym modafinilu, doprowadziło do zgonu. Do objawów najczęściej towarzyszących przedawkowaniu modafinilu, samych lub w skojarzeniu z innymi lekami, należą: bezsenność; objawy ośrodkowego układu nerwowego, takie jak niepokój, dezorientacja, splątanie, pobudzenie i omamy; zmiany trawienne, takie jak nudności i biegunka; oraz zmiany sercowo-naczyniowe, takie jak tachykardia, bradykardia, nadciśnienie i ból w klatce piersiowej.
Zgłaszano przypadki przypadkowego połknięcia / przedawkowania u dzieci w wieku 11 miesięcy. Największe zgłoszone przypadkowe spożycie w przeliczeniu na mg / kg wystąpiło u trzyletniego chłopca, który spożywał 800-1000 mg (50-63 mg / kg) modafinilu. Dziecko pozostało stabilne. Objawy związane z przedawkowaniem u dzieci były podobne do obserwowanych u dorosłych.
Zarządzanie przedawkowaniem
Dotychczas nie zidentyfikowano żadnego antidotum na toksyczne skutki przedawkowania modafinilu. W przypadku takiego przedawkowania należy leczyć przede wszystkim poprzez leczenie podtrzymujące, w tym monitorowanie układu krążenia. Jeśli nie ma przeciwwskazań, należy rozważyć wywołane wymioty lub płukanie żołądka. Brak danych sugerujących przydatność dializy lub zakwaszenia moczu lub alkalizacji w zwiększaniu eliminacji leku. Lekarz powinien rozważyć skontaktowanie się z centrum kontroli zatruć w sprawie leczenia przedawkowania.
Top
Dawkowanie i sposób podawania
Zalecana dawka Provigil wynosi 200 mg raz na dobę.
W przypadku pacjentów z narkolepsją i OSAHS Provigil należy przyjmować w pojedynczej dawce rano.
W przypadku pacjentów z SWSD Provigil należy przyjmować około 1 godzinę przed rozpoczęciem zmiany roboczej.
Dawki do 400 mg / dzień podawane w pojedynczej dawce były dobrze tolerowane, ale nie ma spójnych dowodów na to, że dawka ta zapewnia dodatkowe korzyści poza dawką 200 mg (patrz Farmakologia kliniczna i Szlaki kliniczne).
Ogólne uwagi
Należy rozważyć dostosowanie dawki w przypadku jednoczesnych leków będących substratami CYP3A4, takich jak triazolam i cyklosporyna (patrz Środki ostrożności, Interakcje z lekami).
Leki, które są w dużej mierze eliminowane przez metabolizm CYP2C19, takie jak diazepam, propranolol, fenytoina (również poprzez CYP2C9) lub S-mefenytoina może ulegać przedłużonej eliminacji po jednoczesnym podaniu z Provigil i może wymagać zmniejszenia dawki i monitorowania dla toksyczności.
U pacjentów z ciężkimi zaburzeniami czynności wątroby dawkę Provigilu należy zmniejszyć do połowy dawki zalecanej dla pacjentów z prawidłową czynnością wątroby (patrz CFarmakologia kliniczna i Środki ostrożności).
Brak wystarczających informacji do ustalenia bezpieczeństwa i skuteczności dawkowania u pacjentów z ciężkimi zaburzeniami czynności nerek (patrz Farmakologia kliniczna i Środki ostrożności).
U pacjentów w podeszłym wieku eliminacja Provigilu i jego metabolitów może być zmniejszona w wyniku starzenia się. Dlatego należy rozważyć zastosowanie niższych dawek w tej populacji (patrz Farmakologia kliniczna i Środki ostrożności).
Top
Jak dostarczone
Provigil® (modafinil) Tabletki
100 mg: Każda biała, niepowlekana tabletka w kształcie kapsułki jest wytłoczona z „Provigil” na jednej stronie i „100 MG” na drugiej.
NDC 63459-101-01 - Butelki po 100 sztuk
200 mg: Każda tabletka niepowlekana w kształcie kapsułki, biała, z linią podziału, z wytłoczonym napisem „Provigil” na jednej stronie i „200 MG” na drugiej.
NDC 63459-201-01 - Butelki po 100
Przechowywać w temperaturze 20–25 ° C (68–77 ° F).
Wyprodukowano dla:
Cephalon, Inc.
Frazer, PA 19355
Patenty USA nr RE37,516 / 4 927 855
© Cephalon, Inc., 2008. Wszelkie prawa zastrzeżone
PROV-011
Ostatnia aktualizacja: 03/08
Karta informacyjna dla pacjenta Provigil (modafinil) (w prostym angielskim)
Szczegółowe informacje na temat Znaki, objawy, przyczyny, leczenie zaburzeń snu
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do:
~ wszystkie artykuły na temat zaburzeń snu



