Starlix do leczenia cukrzycy
Nazwa marki: Starlix
Nazwa ogólna: tabletki nateglinidu
Zawartość:
Opis
Farmakologia kliniczna
Studia kliniczne
Wskazania i zastosowanie
Przeciwwskazania
Środki ostrożności
Działania niepożądane
Przedawkowanie
Dawkowanie i sposób podawania
Jak dostarczone
Starlix, nateglinid, pełna informacja dla pacjenta (w prostym angielskim)
Opis
Starlix® (nateglinid) jest doustnym lekiem przeciwcukrzycowym stosowanym w leczeniu cukrzycy typu 2 [znanej również jako cukrzyca insulinoniezależna (NIDDM) lub cukrzyca dorosła]. Starlix, (-) - N - [(trans-4-izopropylocykloheksan) karbonylo] -D-fenyloalanina, jest strukturalnie niezwiązany z doustnymi środkami pobudzającymi wydzielanie insuliny z pochodnymi sulfonylomocznika.
Wzór strukturalny jest taki, jak pokazano
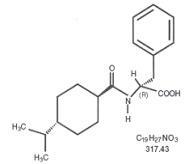
Nateglinid jest białym proszkiem o masie cząsteczkowej 317,43. Jest łatwo rozpuszczalny w metanolu, etanolu i chloroformie, rozpuszczalny w eterze, trudno rozpuszczalny w acetonitrylu i oktanolu i praktycznie nierozpuszczalny w wodzie. Dwuwypukłe tabletki Starlix zawierają 60 mg lub 120 mg nateglinidu do podawania doustnego.
Składniki nieaktywne: koloidalny dwutlenek krzemu, kroskarmeloza sodowa, hydroksypropylometyloceluloza, tlenki żelaza (czerwony lub żółty), monohydrat laktozy, stearynian magnezu, celuloza mikrokrystaliczna, glikol polietylenowy, powidon, talk i tytan dwutlenek.
Top
Farmakologia kliniczna
Mechanizm akcji
Nateglinid jest pochodną aminokwasu, która obniża poziom glukozy we krwi poprzez stymulowanie wydzielania insuliny z trzustki. Działanie to zależy od funkcjonowania komórek beta w wysepkach trzustkowych. Nateglinid oddziałuje z kanałem potasowym wrażliwym na ATP (K + ATP) w komórkach beta trzustki. Późniejsza depolaryzacja komórki beta otwiera kanał wapniowy, powodując napływ wapnia i wydzielanie insuliny. Stopień uwalniania insuliny zależy od glukozy i zmniejsza się przy niskim poziomie glukozy. Nateglinid jest wysoce selektywny względem tkanek, z niskim powinowactwem do serca i mięśni szkieletowych.
Farmakokinetyka
Wchłanianie
Po podaniu doustnym bezpośrednio przed posiłkiem nateglinid jest szybko wchłaniany, a średnie maksymalne stężenie leku w osoczu (Cmax) zwykle występuje w ciągu 1 godziny (Tmax) po podaniu. Przy podawaniu pacjentom z cukrzycą typu 2 w zakresie dawek od 60 mg do 240 mg trzy razy dziennie dla jednego tydzień, nateglinid wykazał liniową farmakokinetykę zarówno dla AUC (pole pod krzywą czas / stężenie w osoczu), jak i Cmax. Stwierdzono również, że Tmax jest niezależne od dawki w tej populacji pacjentów. Bezwzględna dostępność biologiczna szacowana jest na około 73%. Po podaniu z posiłkami lub po posiłku stopień wchłaniania nateglinidu (AUC) pozostaje niezmieniony. Występuje jednak opóźnienie w szybkości wchłaniania charakteryzujące się zmniejszeniem Cmax i opóźnieniem czasu do osiągnięcia maksymalnego stężenia w osoczu (Tmax). Profile osocza charakteryzują się wieloma pikami stężeń w osoczu, gdy nateglinid jest podawany na czczo. Efekt ten zmniejsza się, gdy nateglinid jest przyjmowany przed posiłkiem.
Dystrybucja
Na podstawie danych po dożylnym (IV) podaniu nateglinidu, objętość dystrybucji nateglinidu w stanie stacjonarnym szacuje się na około 10 litrów u zdrowych osób. Nateglinid jest w dużym stopniu związany (98%) z białkami surowicy, głównie z albuminami surowicy, aw mniejszym stopniu z Î ± 1 kwaśnej glikoproteiny. Stopień wiązania białka z surowicą jest niezależny od stężenia leku w zakresie testowym 0,1-10 µg / ml.
Metabolizm
Nateglinid jest metabolizowany przez układ oksydazy o mieszanej funkcji przed eliminacją. Głównymi drogami metabolizmu są hydroksylacja, a następnie sprzęganie z glukuronidem. Główne metabolity są słabszymi środkami przeciwcukrzycowymi niż nateglinid. Mniejszy metabolit izoprenu ma moc podobną do nateglinidu, związku macierzystego.
Dane in vitro pokazują, że nateglinid jest metabolizowany głównie przez izoenzymy CYP2C9 cytochromu P450 (70%) i CYP3A4 (30%).
Wydalanie
Nateglinid i jego metabolity są szybko i całkowicie eliminowane po podaniu doustnym. W ciągu 6 godzin po podaniu około 75% podanego nateglinidu 14C zostało wydalone z moczem. Osiemdziesiąt trzy procent nateglinidu 14C było wydalane z moczem, a dodatkowe 10% z kałem. Około 16% nateglinidu 14C było wydalane z moczem jako związek macierzysty. We wszystkich badaniach zdrowych ochotników i pacjentów z cukrzycą typu 2 stężenie nateglinidu w osoczu gwałtownie spadało, a średni okres półtrwania w fazie eliminacji wynosił około 1,5 godziny. Zgodnie z tym krótkim okresem półtrwania eliminacji, nie stwierdzono widocznej kumulacji nateglinidu po wielokrotnym dawkowaniu do 240 mg trzy razy dziennie przez 7 dni.
Interakcje z lekami
Badania metabolizmu leków in vitro wskazują, że Starlix jest metabolizowany głównie przez izoenzym CYP2C9 cytochromu P450 (70%) oraz w mniejszym stopniu CYP3A4 (30%). Starlix jest potencjalnym inhibitorem izoenzymu CYP2C9 in vivo, na co wskazuje jego zdolność do hamowania metabolizmu tolbutamidu in vitro. Hamowanie reakcji metabolicznych CYP3A4 nie zostało wykryte w eksperymentach in vitro.
Gliburyd: W randomizowanym badaniu krzyżowym z wieloma dawkami pacjenci z cukrzycą typu 2 byli podawano 120 mg Starlix trzy razy dziennie przed posiłkami przez 1 dzień w połączeniu z gliburydem 10 mg dziennie. Nie stwierdzono istotnych klinicznie zmian w farmakokinetyce żadnego z tych środków.
Metformina: Gdy Starlix 120 mg trzy razy dziennie przed posiłkami podawano w połączeniu z metforminą 500 mg trzy u pacjentów z cukrzycą typu 2 razy dziennie nie wystąpiły klinicznie istotne zmiany w farmakokinetyce żadnego z nich agent.
Digoksyna: Gdy Starlix 120 mg przed posiłkami podawano w połączeniu z pojedynczą dawką 1 mg wynoszącą digoksyny u zdrowych ochotników, nie wystąpiły klinicznie istotne zmiany w farmakokinetyce żadnego z nich agent.
Warfaryna: Gdy zdrowym ochotnikom podawano Starlix 120 mg trzy razy dziennie przed posiłkami przez cztery dni w połączeniu z pojedynczą dawką warfaryny 30 mg w dniu 2, nie było zmian w farmakokinetyce żadnego z nich agent. Nie wpływał na czas protrombinowy.
Diklofenak: Podawanie porannej i obiadowej dawki Starlix 120 mg w połączeniu z pojedynczą dawką 75 mg dawka diklofenaku u zdrowych ochotników nie spowodowała znaczących zmian w farmakokinetyce żadnego z nich agent.
Specjalne populacje
Osoby w podeszłym wieku: wiek nie wpływał na właściwości farmakokinetyczne nateglinidu. Dlatego nie ma konieczności dostosowania dawki u pacjentów w podeszłym wieku.
Płeć: Nie stwierdzono istotnych klinicznie różnic w farmakokinetyce nateglinidu między mężczyznami i kobietami. Dlatego nie jest konieczne dostosowanie dawki w zależności od płci.
Rasa: Wyniki populacyjnej analizy farmakokinetycznej obejmującej osoby rasy białej, czarnej i innych pochodzenia etnicznego sugerują, że rasa ma niewielki wpływ na farmakokinetykę nateglinidu.
Zaburzenia czynności nerek: w porównaniu ze zdrowymi dobranymi osobnikami, pacjentami z cukrzycą typu 2 i umiarkowana do ciężkiej niewydolność nerek (CrCl 15–50 ml / min) nie poddawana dializie wykazywała podobne objawy klirens, AUC i Cmax. Pacjenci z cukrzycą typu 2 i niewydolnością nerek podczas dializy wykazywali zmniejszoną całkowitą ekspozycję na lek. Jednak pacjenci poddawani hemodializie doświadczyli również zmniejszenia wiązania z białkami osocza w porównaniu z dobranymi zdrowymi ochotnikami.
Zaburzenia czynności wątroby: szczytowe i całkowite narażenie na nateglinid u pacjentów bez cukrzycy z łagodną niewydolnością wątroby wzrosło o 30% w porównaniu z dobranymi zdrowymi osobami. Starlix® (nateglinid) należy stosować ostrożnie u pacjentów z przewlekłą chorobą wątroby. (Patrz ŚRODKI OSTROŻNOŚCI, Zaburzenia czynności wątroby.)
Farmakodynamika
Starlix jest szybko wchłaniany i stymuluje wydzielanie insuliny trzustkowej w ciągu 20 minut po podaniu doustnym. Kiedy Starlix podaje się trzy razy dziennie przed posiłkami, następuje gwałtowny wzrost poziomu insuliny w osoczu, z maksymalnym poziomem około 1 godziny po podaniu i spadkiem do wartości wyjściowej o 4 godziny po podaniu.
W kontrolowanym badaniu klinicznym z podwójnie ślepą próbą, w którym Starlix podawano przed każdym z trzech posiłki, poziomy glukozy w osoczu określono w ciągu 12 godzin, w ciągu dnia po 7 tygodniach leczenie. Starlix podano 10 minut przed posiłkiem. Posiłki oparto na standardowych menu podtrzymujących cukrzycę z całkowitą kalorycznością w zależności od wzrostu każdego pacjenta. Starlix spowodował statystycznie istotny spadek glikemii na czczo i po posiłku w porównaniu z placebo.
Top
Studia kliniczne
W dziewięciu badaniach z podwójnie ślepą próbą, kontrolowanych placebo lub aktywnie, trwających od 8 do 24 tygodni, losowo oceniano 3566 pacjentów w celu oceny bezpieczeństwa i skuteczności Starlix® (nateglinid). 3513 pacjentów miało wartości skuteczności przekraczające wartość początkową. W tych badaniach Starlix podawano do 30 minut przed każdym z trzech głównych posiłków dziennie.
Starlix® Monoterapia w porównaniu do placebo
W 24-tygodniowym randomizowanym badaniu z podwójnie ślepą próbą, kontrolowanym placebo, pacjenci z cukrzycą typu 2 z HbA1C - 6,8% na samej diecie losowo przydzielano do grupy Starlix (60 mg lub 120 mg trzy razy dziennie przed posiłkami) lub placebo. Wyjściowa wartość HbA1C wynosiła od 7,9% do 8,1%, a 77,8% pacjentów nie było wcześniej leczonych doustną terapią przeciwcukrzycową. Pacjenci uprzednio leczeni lekami przeciwcukrzycowymi musieli przerwać ten lek przez co najmniej 2 miesiące przed randomizacją. Dodanie Starlix przed posiłkami spowodowało statystycznie istotne zmniejszenie średniego HbA1C i średniego poziomu glukozy w osoczu na czczo (FPG) w porównaniu z placebo (patrz Tabela 1). Zmniejszenie HbA1C i FPG było podobne u pacjentów, którzy wcześniej nie byli leczeni lekami przeciwcukrzycowymi.
W tym badaniu zgłoszono jeden epizod ciężkiej hipoglikemii (stężenie glukozy w osoczu <36 mg / dl) u pacjenta leczonego Starlix 120 mg trzy razy dziennie przed posiłkami. Żaden z pacjentów nie doświadczył hipoglikemii wymagającej pomocy strony trzeciej. U pacjentów leczonych Starlix stwierdzono statystycznie istotny wzrost masy ciała w porównaniu do placebo (patrz Tabela 1).
W innym randomizowanym, podwójnie zaślepionym, 24-tygodniowym badaniu kontrolowanym aktywnie i placebo pacjenci z cukrzycą typu 2 zostali losowo przydzieleni do grupy otrzymującej Starlix (120 mg trzy razy codziennie przed posiłkami), metformina 500 mg (trzy razy dziennie), kombinacja Starlix 120 mg (trzy razy dziennie przed posiłkami) i metformina 500 mg (trzy razy dziennie), lub placebo. Wyjściowa wartość HbA1C wynosiła od 8,3% do 8,4%. Pięćdziesiąt siedem procent pacjentów było wcześniej nieleczonych doustną terapią przeciwcukrzycową. Monoterapia Starlix spowodowała znaczne zmniejszenie średniego HbA1C i średniej FPG w porównaniu z placebo, które były podobne do wyników badania przedstawionego powyżej (patrz Tabela 2).
Tabela 1: Wyniki punktu końcowego dla 24-tygodniowego badania z ustaloną dawką monoterapii Starlix®
|
Placebo |
Starlix® 60 mg trzy razy codziennie przed posiłkami |
Starlix® 120 mg trzy razy codziennie przed posiłkami |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Wartość początkowa (średnia) | 8.0 | 7.9 | 8.1 |
| Zmiana od wartości początkowej (średnia) | +0.2 | -0.3 | -0.5 |
| Różnica od placebo (średnia) | -0.5 za | -0.7 za | |
| FPG (mg / dL) | N = 172 | N = 171 | N = 169 |
| Wartość początkowa (średnia) | 167.9 | 161.0 | 166.5 |
| Zmiana od wartości początkowej (średnia) | +9.1 | +0.4 | -4.5 |
| Różnica od placebo (średnia) | -8.7 za | -13.6 za | |
| waga (kg) | N = 170 | N = 169 | N = 166 |
| Wartość początkowa (średnia) | 85.8 | 83.7 | 86.3 |
| Zmiana od wartości początkowej (średnia) | -0.7 | +0.3 | +0.9 |
| Różnica od placebo (średnia) | +1.0 za | +1.6 za |
wartość p 0,004
Starlix® Monoterapia w porównaniu z innymi doustnymi lekami przeciwcukrzycowymi
Gliburyd
W 24-tygodniowym, podwójnie ślepym, kontrolowanym aktywnie badaniu, pacjenci z cukrzycą typu 2, którzy byli na pochodnej sulfonylomocznika przez 3 miesiące i którzy miał wyjściowy poziom HbA1C - 6,5% losowo przydzielono do grupy otrzymującej Starlix (60 mg lub 120 mg trzy razy dziennie przed posiłkami) lub gliburyd 10 mg raz codziennie. Pacjenci zrandomizowani do Starlix mieli znaczący wzrost średniego HbA1C i średniego FPG w punkcie końcowym w porównaniu z pacjentami zrandomizowanymi do gliburydu.
Metformina
W innym randomizowanym, podwójnie zaślepionym, 24-tygodniowym badaniu kontrolowanym aktywnie i placebo pacjenci z cukrzycą typu 2 zostali losowo przydzieleni do grupy otrzymującej Starlix (120 mg trzy razy codziennie przed posiłkami), metformina 500 mg (trzy razy dziennie), kombinacja Starlix 120 mg (trzy razy dziennie przed posiłkami) i metformina 500 mg (trzy razy dziennie), lub placebo. Wyjściowa wartość HbA1C wynosiła od 8,3% do 8,4%. Pięćdziesiąt siedem procent pacjentów było wcześniej nieleczonych doustną terapią przeciwcukrzycową. Zmniejszenie średniego HbA1C i średniego FPG w punkcie końcowym w monoterapii metforminą było znacznie większe niż zmniejszenie tych zmiennych w monoterapii Starlix (patrz Tabela 2). W porównaniu z placebo monoterapia Starlix była związana ze znaczącym wzrostem średniej masy ciała, podczas gdy monoterapia metforminą była związana ze znacznym spadkiem średniej masy ciała. W podgrupie pacjentów, u których nie stosowano leczenia przeciwcukrzycowego, zmniejszenie średniego HbA1C i średniego FPG w monoterapii Starlix było podobne jak w monoterapii metforminą (patrz Tabela 2). Wśród podgrupy pacjentów wcześniej leczonych innymi lekami przeciwcukrzycowymi, głównie gliburydem, HbA1C w Starlix grupa monoterapii nieznacznie wzrosła od wartości wyjściowej, podczas gdy HbA1C była zmniejszona w grupie monoterapii metforminą (patrz Tabela 2).
Terapia skojarzona Starlix®
Metformina
W innym randomizowanym, podwójnie zaślepionym, 24-tygodniowym badaniu kontrolowanym aktywnie i placebo pacjenci z cukrzycą typu 2 zostali losowo przydzieleni do grupy otrzymującej Starlix (120 mg trzy razy codziennie przed posiłkami), metformina 500 mg (trzy razy dziennie), kombinacja Starlix 120 mg (trzy razy dziennie przed posiłkami) i metformina 500 mg (trzy razy dziennie), lub placebo. Wyjściowa wartość HbA1C wynosiła od 8,3% do 8,4%. Pięćdziesiąt siedem procent pacjentów było wcześniej nieleczonych doustną terapią przeciwcukrzycową. Pacjenci wcześniej leczeni lekami przeciwcukrzycowymi byli zobowiązani do przerwania leczenia przez co najmniej 2 miesiące przed randomizacją. Połączenie Starlix i metforminy spowodowało statystycznie istotnie większe zmniejszenie HbA1C i FPG w porównaniu z monoterapią Starlix lub metforminą (patrz Tabela 2). Starlix, sam lub w skojarzeniu z metforminą, znacznie zmniejszał podwyższenie poziomu glukozy po posiłku z posiłku do 2 godzin po posiłku w porównaniu z placebo i samą metforminą.
W tym badaniu zgłoszono jeden epizod ciężkiej hipoglikemii (stężenie glukozy w osoczu - 36 mg / dl) u pacjenta otrzymującego połączenie preparatu Starlix i metforminy oraz czterech epizodów ciężkiej hipoglikemii zgłoszono u jednego pacjenta z metforminą ramię zabiegowe. Żaden pacjent nie doświadczył epizodu hipoglikemii wymagającego pomocy strony trzeciej. W porównaniu z placebo monoterapia Starlix była związana ze statystycznie istotnym wzrostem masy ciała, podczas gdy nie obserwowano znaczącej zmiany masy ciała podczas skojarzonego leczenia Starlix i metforminą (patrz Tabela 2).
W innym 24-tygodniowym badaniu z podwójnie ślepą próbą, kontrolowanym placebo, pacjenci z cukrzycą typu 2 z HbA1C - 6,8% po leczeniu metforminą (1500 mg na dobę przez miesiąc) w czterotygodniowy okres monoterapii metforminą (2000 mg na dobę), a następnie losowo przydzielany do grupy otrzymującej Starlix (60 mg lub 120 mg trzy razy dziennie przed posiłkami) lub placebo oprócz metforminy. Leczenie skojarzone ze Starlix i metforminą wiązało się ze statystycznie istotnie większym zmniejszeniem HbA1C w porównaniu do monoterapii metforminą (-0,4% i -0,6% dla Starlix 60 mg i Starlix 120 mg plus metformina, odpowiednio).
Tabela 2: Wyniki końcowe dla 24-tygodniowego badania monoterapii Starlix® i skojarzenia z metforminą
|
Placebo |
Starlix® 120 mg trzy razy codziennie wcześniej posiłki |
Metformina 500 mg trzy razy codziennie |
Starlix® 120 mg przed posiłki plus Metformina * |
|
| HbA1C (%) | ||||
| Wszystko | N = 160 | N = 171 | N = 172 | N = 162 |
| Wartość początkowa (średnia) | 8.3 | 8.3 | 8.4 | 8.4 |
| Zmiana od wartości początkowej (średnia) | +0.4 | -0.4 pne | -0.8 do | -1.5 |
| Różnica w stosunku do placebo | -0.8 za | -1.2 za | -1.9 za | |
| NaÑ-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Wartość początkowa (średnia) | 8.2 | 8.1 | 8.3 | 8.2 |
| Zmiana od wartości początkowej (średnia) | +0.3 | -0.7 do | -0.8 do | -1.6 |
| Różnica w stosunku do placebo | -1.0 za | -1.1 za | -1.9 za | |
| Non-NaÑ — ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Wartość początkowa (średnia) | 8.3 | 8.5 | 8.7 | 8.7 |
| Zmiana od wartości początkowej (średnia) | +0.6 | +0.004 pne | -0.8 do | -1.4 |
| Różnica w stosunku do placebo | -0.6 za | -1.4 za | -2.0 za | |
| FPG (mg / dL) | ||||
| Wszystko | N = 166 | N = 173 | N = 174 | N = 167 |
| Wartość początkowa (średnia) | 194.0 | 196.5 | 196.0 | 197.7 |
| Zmiana od wartości początkowej (średnia) | +8.0 | -13.1 pne | -30.0 do | -44.9 |
| Różnica w stosunku do placebo | -21.1 za | -38.0 za | -52.9 za | |
| waga (kg) | ||||
| Wszystko | N = 160 | N = 169 | N = 169 | N = 160 |
| Wartość początkowa (średnia) | 85.0 | 85.0 | 86.0 | 87.4 |
| Zmiana od wartości początkowej (średnia) | -0.4 | +0.9 pne | -0.1 | +0.2 |
| Różnica w stosunku do placebo | +1.3 za | +0.3 | +0.6 |
wartość p 0,05 vs. placebo
b Wartość p - 0,03 vs. metformina
c wartość p - 0,05 vs. połączenie
* Metforminę podawano trzy razy dziennie
Rozyglitazon
U pacjentów z typem 2 przeprowadzono 24-tygodniowe, wieloośrodkowe, kontrolowane placebo badanie z podwójnie ślepą próbą cukrzyca nie jest odpowiednio kontrolowana po odpowiedzi terapeutycznej na monoterapię rozyglitazonem w dawce 8 mg codziennie. Dodanie Starlix (120 mg trzy razy dziennie z posiłkami) wiązało się ze statystycznie istotnie większym zmniejszeniem HbA1C w porównaniu z monoterapią rozyglitazonem. Różnica wynosiła -0,77% po 24 tygodniach. Średnia zmiana masy ciała w stosunku do wartości wyjściowej wyniosła około +3 kg u pacjentów leczonych produktem Starlix plus rozyglitazon w porównaniu do około +1 kg u pacjentów leczonych placebo i rozyglitazon.
Gliburyd
W 12-tygodniowym badaniu z udziałem pacjentów z cukrzycą typu 2 nieodpowiednio kontrolowanych za pomocą gliburydu w dawce 10 mg raz na dobę, dodanie Starlix (60 mg lub 120 mg trzy razy dziennie przed posiłkami) nie spowodowało żadnych dodatkowych zasiłek.
Top
Wskazania i zastosowanie
Starlix® (nateglinid) jest wskazany jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u osób dorosłych z cukrzycą typu 2.
Top
Przeciwwskazania
Starlix® (nateglinid) jest przeciwwskazany u pacjentów z:
1. Znana nadwrażliwość na lek lub jego nieaktywne składniki.
2. Cukrzyca typu 1.
3. Cukrzycowa kwasica ketonowa. Ten stan należy leczyć insuliną.
Top
Środki ostrożności
Wyniki makronaczyniowe: Nie przeprowadzono badań klinicznych potwierdzających jednoznaczne dowody zmniejszenia ryzyka makronaczyniowego za pomocą Starlix lub jakiegokolwiek innego leku przeciwcukrzycowego.
Hipoglikemia: Wszystkie doustne leki obniżające stężenie glukozy we krwi, które są wchłaniane ogólnoustrojowo, mogą powodować hipoglikemię. Częstość hipoglikemii jest związana z ciężkością cukrzycy, poziomem kontroli glikemii i innymi cechami pacjenta. Osoby w podeszłym wieku, niedożywione oraz osoby z niewydolnością kory nadnerczy lub przysadki mózgowej lub ciężkimi zaburzeniami czynności nerek są bardziej podatne na działanie tych leków na obniżenie poziomu glukozy. Ryzyko hipoglikemii może być zwiększone przez wysiłek fizyczny, spożywanie alkoholu, niewystarczające spożycie kalorii w postaci ostrej lub przewlekłej lub kombinacje z innymi doustnymi lekami przeciwcukrzycowymi agenci. Hipoglikemia może być trudna do rozpoznania u pacjentów z autonomiczną neuropatią i (lub) tych, którzy stosują beta-blokery. Starlix® (nateglinid) należy podawać przed posiłkami, aby zmniejszyć ryzyko hipoglikemii. Pacjenci, którzy pomijają posiłki, powinni również pominąć zaplanowaną dawkę Starlix, aby zmniejszyć ryzyko hipoglikemii.
Zaburzenia czynności wątroby: Starlix należy stosować ostrożnie u pacjentów z umiarkowaną do ciężkiej chorobą wątroby, ponieważ takich pacjentów nie badano.
Utrata kontroli glikemii
Przemijająca utrata kontroli glikemii może wystąpić z gorączką, infekcją, urazem lub zabiegiem chirurgicznym. W takich przypadkach może być potrzebna terapia insulinowa zamiast terapii Starlix. Może wystąpić wtórna awaria lub zmniejszona skuteczność Starlix z upływem czasu.
Informacje dla pacjentów
Pacjentów należy poinformować o potencjalnym ryzyku i korzyściach związanych ze stosowaniem Starlix oraz o alternatywnych sposobach leczenia. Należy wyjaśnić ryzyko i postępowanie w przypadku hipoglikemii. Pacjentów należy poinstruować, aby przyjmowali Starlix na 1 do 30 minut przed spożyciem posiłku, ale powinni pominąć zaplanowaną dawkę, jeśli opuszczą posiłek, aby zmniejszyć ryzyko hipoglikemii. Interakcje z lekami należy omawiać z pacjentami. Pacjentów należy poinformować o potencjalnych interakcjach między lekami a produktem Starlix.
Testy laboratoryjne
Odpowiedź na leczenie powinna być okresowo oceniana za pomocą wartości glukozy i poziomów HbA1C.
Interakcje z lekami
Nateglinid silnie wiąże się z białkami osocza (98%), głównie z albuminami. Badania wypierania in vitro z lekami silnie związanymi z białkami, takimi jak furosemid, propranolol, kaptopryl, nikardypina, prawastatyna, gliburyd, warfaryna, fenytoina, kwas acetylosalicylowy, tolbutamid i metformina nie wykazywały wpływu na zakres białka nateglinidu wiążący. Podobnie nateglinid nie miał wpływu na wiązanie propranololu, gliburydu, nikardypiny, warfaryny, fenytoiny, kwasu acetylosalicylowego i tolbutamidu z białkami osocza w warunkach in vitro. Jednak ostrożna ocena poszczególnych przypadków jest uzasadniona w warunkach klinicznych.
Niektóre leki, w tym niesteroidowe leki przeciwzapalne (NLPZ), salicylany, inhibitory monoaminooksydazy oraz nieselektywne leki blokujące receptory beta-adrenergiczne mogą nasilać hipoglikemiczne działanie Starlix i innych doustnych leków przeciwcukrzycowych leki.
Niektóre leki, w tym tiazydy, kortykosteroidy, produkty tarczycy i sympatykomimetyki, mogą zmniejszać hipoglikemiczne działanie Starlix i innych doustnych leków przeciwcukrzycowych.
Gdy leki te są podawane pacjentom otrzymującym Starlix lub wycofywane z nich, należy uważnie obserwować pacjenta pod kątem zmian w kontroli glikemii.
Interakcje między lekami a żywnością
Skład posiłku nie miał wpływu na farmakokinetykę nateglinidu (wysokobiałkowe, tłuszczowe lub węglowodanowe). Jednak maksymalne poziomy w osoczu były znacznie zmniejszone, gdy Starlix podano 10 minut przed płynnym posiłkiem. Starlix nie miał żadnego wpływu na opróżnianie żołądka u zdrowych osób, co oceniono na podstawie testów acetaminofenowych.
Rakotwórczość / Mutageneza / Upośledzenie płodności
Rakotwórczość: Przeprowadzono dwuletnie badanie rakotwórczości u szczurów Sprague-Dawley z doustnymi dawkami nateglinidu do 900 mg / kg / dobę, co spowodowało narażenie na AUC u samców i samic szczurów odpowiednio około 30 i 40 razy więcej niż ekspozycja terapeutyczna u ludzi przy zalecanej dawce 120 mg Starlix trzy razy dziennie przed posiłki. Dwuletnie badanie rakotwórczości u myszy B6C3F1 przeprowadzono z doustnymi dawkami nateglinidu do 400 mg / kg / dobę, co spowodowało narażenie AUC u samców i samice myszy w przybliżeniu 10 i 30 razy bardziej narażone na działanie u ludzi, z zalecaną dawką Starlix 120 mg, trzy razy dziennie przed posiłkami. Nie znaleziono dowodów na odpowiedź rakotwórczą ani u szczurów, ani u myszy.
Mutageneza: Nateglinid nie wykazywał działania genotoksycznego w teście Amesa in vitro, teście chłoniaka myszy, teście aberracji chromosomowej w komórkach płuc chomika chińskiego lub w teście mikrojądrowym myszy in vivo.
Upośledzenie płodności: Podawanie nateglinidu szczurom w dawkach do 600 mg / kg nie miało wpływu na płodność (około 16-krotność ekspozycji terapeutycznej u ludzi przy zalecanej dawce Starlix 120 mg trzy razy dziennie wcześniej posiłki).
Ciąża
Kategoria ciąży C
Nateglinid nie wykazywał działania teratogennego u szczurów w dawkach do 1000 mg / kg (około 60-krotność ekspozycji terapeutycznej u ludzi przy zalecanej dawce 120 mg Starlix trzy razy dziennie przed posiłkami). U królika niekorzystnie wpłynął na rozwój zarodkowy, a częstość występowania agenezji pęcherzyka żółciowego lub małego pęcherzyka żółciowego zwiększała się dawka 500 mg / kg (około 40-krotność ekspozycji terapeutycznej u ludzi przy zalecanej dawce 120 mg Starlix trzy razy dziennie wcześniej posiłki). Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Starlix nie powinien być stosowany podczas ciąży.
Praca i dostawa
Wpływ Starlix na poród i poród u ludzi nie jest znany.
Matki karmiące
Badania na szczurach w okresie laktacji wykazały, że nateglinid przenika do mleka; stosunek AUC0-48h w mleku do osocza wynosił około 1: 4. W okresie około i poporodowym masy ciała były niższe u potomstwa szczurów, którym podano nateglinid w dawce 1000 mg / kg (około 60-krotna ekspozycja terapeutyczna u ludzi przy zalecanej dawce 120 mg Starlix trzy razy dziennie wcześniej posiłki). Nie wiadomo, czy Starlix przenika do mleka kobiecego. Ponieważ wiele leków przenika do mleka ludzkiego, Starlix nie powinien być podawany kobietom karmiącym.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność Starlix u dzieci i młodzieży nie zostały ustalone.
Zastosowanie geriatryczne
Nie zaobserwowano różnic w bezpieczeństwie ani skuteczności produktu Starlix między pacjentami w wieku 65 lat i starszymi a tymi w wieku poniżej 65 lat. Nie można jednak wykluczyć większej wrażliwości niektórych starszych osób na terapię Starlix.
Top
Działania niepożądane
W badaniach klinicznych około 2600 pacjentów z cukrzycą typu 2 było leczonych Starlix® (nateglinid). Spośród nich około 1335 pacjentów było leczonych przez 6 miesięcy lub dłużej i około 190 pacjentów przez rok lub dłużej.
Hipoglikemia występowała stosunkowo rzadko we wszystkich grupach terapeutycznych badań klinicznych. Tylko 0,3% pacjentów Starlix przerwało leczenie z powodu hipoglikemii. Objawy żołądkowo-jelitowe, szczególnie biegunka i nudności, nie występowały częściej u pacjentów stosujących kombinację Starlix i metforminy niż u pacjentów otrzymujących samą metforminę. Podobnie obrzęk obwodowy nie występował częściej u pacjentów stosujących kombinację Starlix i rozyglitazonu niż u pacjentów otrzymujących sam rozyglitazon. W poniższej tabeli wymieniono zdarzenia występujące częściej u pacjentów Starlix niż u pacjentów placebo w kontrolowanych badaniach klinicznych.
Częste zdarzenia niepożądane (â ‰ ‰ 2% u pacjentów Starlix®) w badaniach Starlix® w monoterapii (% pacjentów)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Preferowany termin | ||
| Zakażenie górnych dróg oddechowych | 8.1 | 10.5 |
| Ból pleców | 3.7 | 4.0 |
| Objawy grypy | 2.6 | 3.6 |
| Zawroty głowy | 2.2 | 3.6 |
| Artropatia | 2.2 | 3.3 |
| Biegunka | 3.1 | 3.2 |
| Przypadkowa trauma | 1.7 | 2.9 |
| Zapalenie oskrzeli | 2.6 | 2.7 |
| Kaszel | 2.2 | 2.4 |
| Hipoglikemia | 0.4 | 2.4 |
Podczas wprowadzania do obrotu zgłaszano rzadkie przypadki reakcji nadwrażliwości, takich jak wysypka, swędzenie i pokrzywka. Podobnie zgłaszano przypadki żółtaczki, cholestatycznego zapalenia wątroby i podwyższonego poziomu enzymów wątrobowych.
Nieprawidłowości laboratoryjne
Kwas moczowy: wzrosły średnie poziomy kwasu moczowego u pacjentów leczonych samym Starlix, Starlix w połączeniu z metforminą, samą metforminą i samym gliburydem. Odpowiednie różnice w porównaniu z placebo wyniosły 0,29 mg / dl, 0,45 mg / dl, 0,28 mg / dl i 0,19 mg / dl. Znaczenie kliniczne tych wyników nie jest znane.
Top
Przedawkowanie
W badaniu klinicznym z udziałem pacjentów z cukrzycą typu 2 podano Starlix® (nateglinid) zwiększanie dawek do 720 mg na dobę przez 7 dni i nie wystąpiły żadne klinicznie znaczące zdarzenia niepożądane zgłoszone. W badaniach klinicznych nie było przypadków przedawkowania Starlix. Jednak przedawkowanie może powodować nadmierne działanie obniżające stężenie glukozy wraz z rozwojem objawów hipoglikemii. Objawy hipoglikemii bez utraty przytomności lub objawów neurologicznych należy leczyć doustną glukozą i dostosowywać dawkę i / lub schematy posiłków. Ciężkie reakcje hipoglikemiczne ze śpiączką, drgawkami lub innymi objawami neurologicznymi należy leczyć dożylnie. Ponieważ nateglinid jest silnie związany z białkami, dializa nie jest skutecznym sposobem usuwania go z krwi.
Top
Dawkowanie i sposób podawania
Starlix® (nateglinid) należy przyjmować 1–30 minut przed posiłkiem.
Monoterapia i łączenie z metforminą lub tiazolidynodionem
Zalecana dawka początkowa i podtrzymująca produktu Starlix, samego lub w skojarzeniu z metforminą lub tiazolidynodionem, wynosi 120 mg trzy razy dziennie przed posiłkami.
Dawka 60 mg Starlix, sama lub w połączeniu z metforminą lub tiazolidynodionem, może być stosowana u pacjentów, którzy są bliscy docelowej wartości HbA1C po rozpoczęciu leczenia.
Dawkowanie u pacjentów geriatrycznych
Zwykle nie są wymagane specjalne dostosowania dawki. Nie można jednak wykluczyć większej wrażliwości niektórych osób na terapię Starlix.
Dawkowanie w zaburzeniach czynności nerek i wątroby
Nie ma konieczności dostosowania dawki u pacjentów z łagodną do ciężkiej niewydolnością nerek lub u pacjentów z łagodną niewydolnością wątroby. Nie badano dawkowania u pacjentów z umiarkowanymi do ciężkich zaburzeniami czynności wątroby. Dlatego Starlix należy stosować ostrożnie u pacjentów z umiarkowaną do ciężkiej chorobą wątroby (patrz ŚRODKI OSTROŻNOŚCI, Zaburzenia czynności wątroby).
Top
Jak dostarczone
Tabletki Starlix® (nateglinid)
60 mg
Różowy, okrągły tablet ze ściętymi krawędziami z wytłoczonym napisem „Starlix” na jednej stronie i „60” na drugiej.
Butelki 100... NDC 0078-0351-05
120 mg
Żółta, owalna tabletka z wytłoczonym napisem „Starlix” na jednej stronie i „120” na drugiej.
Butelki 100... NDC 0078-0352-05
Przechowywanie
Przechowywać w temperaturze 25 ° C (77 ° F); wycieczki dozwolone do 15 ° C-30 ° C (59 ° F-86 ° F).
Dozować w szczelnym pojemniku, USP.
T2008-01
REV: LIPIEC 2008
Wyprodukowano przez:
Novartis Pharma Stein AG
Stein, Szwajcaria
Dystrybuowane przez:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Ostatnia aktualizacja 07/2008
Starlix, nateglinid, pełna informacja dla pacjenta (w prostym angielskim)
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę


