Apidra do leczenia cukrzycy
Nazwa marki: Apidra
Nazwa ogólna: insulina glulizynowa
Apidra (insulina glulizynowa) to sztuczny produkt prawie identyczny z ludzką insuliną. Jest stosowany w leczeniu cukrzycy. Zastosowanie, dawkowanie, działania niepożądane.
Zawartość:
Wskazania i zastosowanie
Dawkowanie i sposób podawania
Przeciwwskazania
Ostrzeżenia i środki
Działania niepożądane
Interakcje z lekami
Użyj w określonych populacjach
Przedawkowanie
Opis
Farmakologia kliniczna
Toksykologia niekliniczna
Studia kliniczne
Jak dostarczone
Apidra, insulina glusine, informacje dla pacjenta (w prostym angielskim)
Wskazania
Apidra jest szybko działającym analogiem insuliny ludzkiej wskazanym w celu poprawy kontroli glikemii u dorosłych i dzieci z cukrzycą.
Top
Dawkowanie i sposób podawania
Uwagi dotyczące dawkowania
APIDRA jest rekombinowanym analogiem insuliny, który jest równoważny z ludzką insuliną (tj. Jedna jednostka APIDRA ma takie samo działanie obniżające stężenie glukozy jak jedna jednostka zwykłej ludzkiej insuliny), gdy jest podawana dożylnie. Po podaniu podskórnym APIDRA ma szybszy początek działania i krótszy czas działania niż zwykła ludzka insulina.
Dawkowanie APIDRA musi być zindywidualizowane. Monitorowanie poziomu glukozy we krwi jest niezbędne u wszystkich pacjentów otrzymujących leczenie insuliną.
Całkowite dzienne zapotrzebowanie na insulinę może się różnić i zwykle wynosi od 0,5 do 1 jednostki / kg / dzień. Zapotrzebowanie na insulinę może ulec zmianie podczas stresu, poważnej choroby lub zmian w ćwiczeniach, schemacie posiłków lub jednoczesnym podawaniu leków.
Podanie podskórne
APIDRA należy podać w ciągu 15 minut przed posiłkiem lub w ciągu 20 minut po rozpoczęciu posiłku.
APIDRA podawana we wstrzyknięciu podskórnym powinna zasadniczo być stosowana w schematach z insuliną o pośrednim lub długim czasie działania.
APIDRA należy podawać we wstrzyknięciu podskórnym w ścianę brzucha, uda lub ramienia. Miejsca wstrzyknięcia należy obracać w obrębie tego samego regionu (brzuch, udo lub ramię) od jednego wstrzyknięcia do drugiego, aby zmniejszyć ryzyko lipodystrofii [patrz DZIAŁANIA NIEPOŻĄDANE].
Ciągły wlew podskórny (pompa insulinowa)
APIDRA można podawać w ciągłym wlewie podskórnym do ściany brzucha. Nie należy używać rozcieńczonych lub mieszanych insulin w zewnętrznych pompach insulinowych. Miejsca infuzji należy obracać w tym samym regionie, aby zmniejszyć ryzyko lipodystrofii [patrz DZIAŁANIA NIEPOŻĄDANE]. Wstępne programowanie zewnętrznej pompy infuzyjnej z insuliną powinno opierać się na całkowitej dziennej dawce insuliny z poprzedniego schematu.
W badaniach klinicznych APIDRA przeprowadzonych przez Sanofi-Aventis, producenta APIDRA, zastosowano następujące pompy insulinowe:
- Disetronic® H-Tron® plus V100 i D-Tron® z cewnikami Disetronic (Rapid ™, Rapid C ™, Rapid D ™ i Tender ™)
- Modele MiniMed® 506, 507, 507c i 508 z cewnikami MiniMed (Sof-set Ultimate QR ™ i Quick-set ™).
Przed użyciem innej pompy insulinowej z APIDRA należy przeczytać etykietę pompy, aby upewnić się, że pompa została oceniona za pomocą APIDRA.
Lekarze i pacjenci powinni dokładnie ocenić informacje na temat użytkowania pompy w informacjach na temat przepisywania leku APIDRA, ulotce dla pacjenta i instrukcji producenta pompy. Należy przestrzegać informacji specyficznych dla APIDRA dotyczących czasu użytkowania, częstotliwości wymiany zestawów infuzyjnych lub innych szczegółowe informacje dotyczące użytkowania APIDRA, ponieważ informacje specyficzne dla APIDRA mogą różnić się od ogólnej instrukcji pompy instrukcje.
Na podstawie badań in vitro, które wykazały utratę środka konserwującego, degradację metakrezolu i insuliny, APIDRA w zbiorniku należy zmieniać co najmniej co 48 godzin. APIDRA w zastosowaniu klinicznym nie powinna być wystawiona na działanie temperatur wyższych niż 37.6 ° C (98,6 ° F). [Widzieć OSTRZEŻENIA I ŚRODKI i JAK DOSTARCZONY / Przechowywanie i postępowanie z produktem].
Podanie dożylne
APIDRA można podawać dożylnie pod nadzorem lekarza w celu kontroli glikemii z ścisłym monitorowaniem poziomu glukozy we krwi i potasu w surowicy, aby uniknąć hipoglikemii i hipokaliemii. Do podawania dożylnego APIDRA należy stosować w stężeniach od 0,05 jednostek / ml do 1 jednostki / ml insuliny glulizynowej w systemach infuzyjnych z użyciem worków z polichlorku winylu (PVC). Wykazano, że APIDRA jest stabilna tylko w normalnym roztworze soli (0,9% chlorek sodu). Produkty do podawania pozajelitowego należy sprawdzać wzrokowo pod kątem obecności cząstek stałych i przebarwień przed podaniem, ilekroć pozwala na to roztwór i pojemnik. Nie podawaj mieszanin insuliny dożylnie.
Formy dawkowania i mocne strony
Apidra 100 jednostek na ml (U-100) jest dostępna jako:
- Fiolki 10 ml
- Wkłady 3 ml do użytku w OptiClik® Urządzenie do podawania insuliny
- 3 ml wstrzykiwacz SoloStar
Top
Przeciwwskazania
Apidra jest przeciwwskazana:
- podczas epizodów hipoglikemii
- u pacjentów z nadwrażliwością na Apidra lub na którąkolwiek substancję pomocniczą
W przypadku stosowania u pacjentów ze znaną nadwrażliwością na produkt Apidra lub jego substancje pomocnicze, u pacjentów mogą wystąpić miejscowe lub uogólnione reakcje nadwrażliwości [Zobacz Działania niepożądane].
Top
Ostrzeżenia i środki
Dostosowanie i monitorowanie dawki
Monitorowanie poziomu glukozy jest niezbędne dla pacjentów leczonych insuliną. Zmiany schematu podawania insuliny należy wprowadzać ostrożnie i wyłącznie pod nadzorem lekarza. Zmiany siły insuliny, producenta, rodzaju lub sposobu podawania mogą powodować potrzebę zmiany dawki insuliny. Konieczne może być dostosowanie jednoczesnego doustnego leczenia przeciwcukrzycowego.
Podobnie jak w przypadku wszystkich preparatów insulinowych, czas działania leku Apidra może być różny u różnych osób lub w różnym czasie ta sama osoba i zależy od wielu warunków, w tym od miejsca wstrzyknięcia, miejscowego ukrwienia lub miejscowego temperatura. Pacjenci zmieniający poziom aktywności fizycznej lub plan posiłków mogą wymagać dostosowania dawek insuliny.
Hipoglikemia
Hipoglikemia jest najczęstszym działaniem niepożądanym insulinoterapii, w tym Apidra. Ryzyko hipoglikemii wzrasta wraz ze ściślejszą kontrolą glikemii. Należy przeszkolić pacjentów w rozpoznawaniu hipoglikemii i radzeniu sobie z nią. Ciężka hipoglikemia może prowadzić do utraty przytomności i / lub drgawek oraz może powodować tymczasowe lub trwałe upośledzenie funkcji mózgu lub śmierć. Ciężka hipoglikemia wymagająca pomocy innej osoby i / lub pozajelitowego wlewu glukozy lub podawanie glukagonu obserwowano w badaniach klinicznych z insuliną, w tym w badaniach z Apidra
Czas hipoglikemii zwykle odzwierciedla profil czasowy działania podanych preparatów insuliny. Inne czynniki, takie jak zmiany w przyjmowaniu pokarmu (np. Ilość posiłków lub czas posiłków), miejsce wstrzyknięcia, ćwiczenia i inne leki mogą również zmieniać ryzyko hipoglikemii [Zobacz Interakcje z lekami].
Podobnie jak w przypadku wszystkich insulin, należy zachować ostrożność u pacjentów z nieświadomością hipoglikemii iu pacjentów, którzy mogą być predysponowany do hipoglikemii (np. populacja pediatryczna i pacjenci, którzy pością lub mają nieregularny pokarm wlot). Zdolność koncentracji i reakcji pacjenta może być zaburzona w wyniku hipoglikemii. Może to stanowić ryzyko w sytuacjach, w których zdolności te są szczególnie ważne, takich jak prowadzenie pojazdów lub obsługiwanie innych maszyn.
Gwałtowne zmiany poziomu glukozy w surowicy mogą wywoływać objawy podobne do hipoglikemii u osób z cukrzycą, niezależnie od wartości glukozy. Objawy wczesnego ostrzegania o hipoglikemii mogą być różne lub mniej wyraźne w pewnych warunkach, takie jak długotrwała cukrzyca, choroba nerwów cukrzycowych, stosowanie leków takich jak beta-blokery [patrz Interakcje z lekami] lub wzmożoną kontrolę cukrzycy. Sytuacje te mogą powodować ciężką hipoglikemię (i być może utratę przytomności) przed uświadomieniem pacjentowi hipoglikemii.
Dożylnie podawana insulina ma szybszy początek działania niż insulina podawana podskórnie, co wymaga dokładniejszego monitorowania hipoglikemii.
Nadwrażliwość i reakcje alergiczne
W przypadku produktów insulinowych, w tym Apidra, może wystąpić ciężka, zagrażająca życiu, uogólniona alergia, w tym anafilaksja. Działania niepożądane].
Hipokaliemia
Wszystkie produkty insulinowe, w tym Apidra, powodują przesunięcie potasu z przestrzeni zewnątrzkomórkowej do wewnątrzkomórkowej, co może prowadzić do hipokaliemii. Nieleczona hipokaliemia może powodować paraliż oddechowy, arytmię komorową i śmierć. Należy zachować ostrożność u pacjentów, którzy mogą być narażeni na hipokaliemię (np. Pacjenci stosujący leki obniżające potas, pacjenci przyjmujący leki wrażliwe na stężenie potasu w surowicy). Często monitoruj stężenie glukozy i potasu, gdy Apidra jest podawana dożylnie.
Zaburzenia czynności nerek lub wątroby
U pacjentów z zaburzeniami czynności nerek lub wątroby może być konieczne częste monitorowanie stężenia glukozy i zmniejszanie dawki insuliny [patrz Farmakologia kliniczna].
Mieszanie insulin
Apidra do wstrzykiwań podskórnych nie należy mieszać z preparatami insuliny innymi niż insulina NPH. Jeśli Apidra zostanie zmieszany z insuliną NPH, Apidra należy najpierw pobrać do strzykawki. Wstrzyknięcie powinno nastąpić natychmiast po zmieszaniu.
Nie mieszać leku Apidra z innymi insulinami do podawania dożylnego lub do stosowania w ciągłej podskórnej pompie infuzyjnej.
Apidra do podawania dożylnego nie należy rozcieńczać roztworami innymi niż 0,9% chlorek sodu (normalna sól fizjologiczna). Skuteczność i bezpieczeństwo mieszania produktu Apidra z rozcieńczalnikami lub innymi insulinami do stosowania w zewnętrznych podskórnych pompach infuzyjnych nie zostały ustalone.
Podskórne pompy infuzyjne z insuliną
W przypadku stosowania w zewnętrznej pompie insulinowej do infuzji podskórnej produktu Apidra nie należy rozcieńczać ani mieszać z żadną inną insuliną. Apidra w zbiorniku powinna być zmieniana co najmniej co 48 godzin. Apidra nie powinna być wystawiana na działanie temperatur wyższych niż 37.6 ° C.
Wadliwe działanie pompy insulinowej lub zestawu do infuzji lub degradacja insuliny może szybko prowadzić do hiperglikemii i ketozy. Konieczna jest szybka identyfikacja i korekta przyczyny hiperglikemii lub ketozy. Konieczne mogą być tymczasowe podskórne wstrzyknięcia produktu Apidra. Pacjenci stosujący ciągłą podskórną terapię za pomocą pompy infuzyjnej muszą zostać przeszkoleni w zakresie podawania insuliny przez wstrzyknięcie oraz mieć dostęp do alternatywnej terapii insulinowej w przypadku awarii pompy. [Widzieć Dawkowanie i sposób podawania, Jak dostarczane / Przechowywanie i obsługa].
Podanie dożylne
Gdy Apidra jest podawana dożylnie, należy ściśle monitorować stężenie glukozy i potasu, aby uniknąć potencjalnie śmiertelnej hipoglikemii i hipokaliemii.
Nie mieszać leku Apidra z innymi insulinami do podawania dożylnego. Apidra można rozcieńczać tylko w normalnym roztworze soli.
Interakcje z innymi lekami
Niektóre leki mogą zmieniać zapotrzebowanie na insulinę i ryzyko hipoglikemii lub hiperglikemii [patrz Interakcje z lekami].
Top
Działania niepożądane
W innym miejscu omówiono następujące działania niepożądane:
- Hipoglikemia [patrz Ostrzeżenia i środki]
- Hipokaliemia [patrz Ostrzeżenia i środki]
Doświadczenie z badań klinicznych
Ponieważ badania kliniczne prowadzone są w ramach bardzo różnych schematów, wskaźniki działań niepożądanych zgłaszane w jednym badaniu klinicznym mogą nie być można je łatwo porównać do wskaźników zgłoszonych w innym badaniu klinicznym i może nie odzwierciedlać wskaźników rzeczywiście zaobserwowanych w badaniu klinicznym ćwiczyć.
Częstotliwość działań niepożądanych leków podczas badań klinicznych Apidra u pacjentów z cukrzycą typu 1 i cukrzycą typu 2 wymieniono w poniższych tabelach.
Tabela 1: Zdarzenia niepożądane związane z leczeniem w zbiorczych badaniach dorosłych z cukrzycą typu 1 (zdarzenia niepożądane z częstością 5%)
| APIDRA,% (n = 950) |
Wszystkie komparatoryza, % (n = 641) |
|
| Zapalenie nosogardzieli | 10.6 | 12.9 |
| Hipoglikemiab | 6.8 | 6.7 |
| Zakażenia górnych dróg oddechowych | 6.6 | 5.6 |
| Grypa | 4.0 | 5.0 |
|
za Insulina lispro, zwykła insulina ludzka, insulina aspart b Tylko ciężka objawowa hipoglikemia |
Tabela 2: Zdarzenia niepożądane związane z leczeniem w zbiorczych badaniach dorosłych z cukrzycą typu 2 (zdarzenia niepożądane z częstością 5%)
| APIDRA,% (n = 883) |
Zwykła ludzka insulina,% (n = 883) |
|
| Zakażenia górnych dróg oddechowych | 10.5 | 7.7 |
| Zapalenie nosogardzieli | 7.6 | 8.2 |
| Obrzęki obwodowe | 7.5 | 7.8 |
| Grypa | 6.2 | 4.2 |
| Ból stawów | 5.9 | 6.3 |
| Nadciśnienie | 3.9 | 5. |
- Pediatria
Tabela 3 podsumowuje działania niepożądane występujące z częstością większą niż 5% w badaniu klinicznym u dzieci i młodzieży z cukrzycą typu 1 leczonych produktem APIDRA (n = 277) lub insuliną lispro (n = 295).
Tabela 3: Zdarzenia niepożądane związane z leczeniem u dzieci i młodzieży z cukrzycą typu 1 (działania niepożądane z częstością 5%)
| APIDRA,% (n = 277) |
Lispro,% (n = 295) |
|
| Zapalenie nosogardzieli | 9.0 | 9.5 |
| Zakażenia górnych dróg oddechowych | 8.3 | 10.8 |
| Bół głowy | 6.9 | 11.2 |
| Napad hipoglikemiczny | 6.1 | 4.7 |
- Ciężka objawowa hipoglikemia
Hipoglikemia jest najczęściej obserwowanym działaniem niepożądanym u pacjentów stosujących insulinę, w tym Apidra [patrz Ostrzeżenia i środki]. Odsetki i częstość występowania ciężkiej objawowej hipoglikemii, zdefiniowanej jako hipoglikemia wymagająca interwencji od strony trzeciej, były porównywalne dla wszystkich schematów leczenia (patrz Tabela 4). W badaniu klinicznym fazy 3 częściej występowały dzieci i młodzież z cukrzycą typu 1 ciężkiej objawowej hipoglikemii w dwóch grupach leczenia w porównaniu do dorosłych z typem 1 cukrzyca. (patrz Tabela 4) [Patrz Studia kliniczne].
Tabela 4: Ciężka objawowa hipoglikemia *
| Cukrzyca typu 1 Dorośli ludzie 12 tygodni z insuliną glargine |
Dorośli z cukrzycą typu 1 26 tygodni z insuliną glargine |
Cukrzyca typu 2 Dorośli ludzie 26 tygodni z ludzką insuliną NPH |
Cukrzyca typu 1 - pediatria 26 tygodni |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Przed posiłkiem |
Apidra Po posiłku |
Zwykła ludzka insulina | Apidra | Insulina Lispro | Apidra | Zwykła ludzka insulina | Apidra | Insulina Lispr | |
| * Ciężka objawowa hipoglikemia zdefiniowana jako zdarzenie hipoglikemiczne wymagające pomocy innej osoby, która spełniła jedno z poniższych kryteriów: zdarzenie związane było z oznaczeniem stężenia glukozy we krwi <36 mg / dl we krwi pełnej lub zdarzenie związane było z szybkim powrotem do zdrowia po doustnym podaniu węglowodanów, dożylnej glukozy lub glukagonu. | |||||||||
| Zdarzenia na miesiąc na pacjenta | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Procent pacjentów (n / ogółem N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Inicjacja insuliny i intensyfikacja kontroli glukozy
Intensyfikacja lub szybka poprawa kontroli glikemii była związana z przemijającym, odwracalnym zaburzenie refrakcji okulistycznej, nasilenie retinopatii cukrzycowej i ostre bolesne objawy obwodowe neuropatia. Jednak długotrwała kontrola glikemii zmniejsza ryzyko retinopatii cukrzycowej i neuropatii.
- Lipodystrofia
Długotrwałe stosowanie insuliny, w tym Apidra, może powodować lipodystrofię w miejscu powtarzanych zastrzyków lub infuzji. Lipodystrofia obejmuje lipohipertrofię (pogrubienie tkanki tłuszczowej) i lipoatrofię (przerzedzenie tkanki tłuszczowej) i może wpływać na wchłanianie insuliny. Obróć miejsca wstrzyknięcia lub infuzji insuliny w tym samym regionie, aby zmniejszyć ryzyko lipodystrofii. [Widzieć Dawkowanie i sposób podawania].
- Przybranie na wadze
Zwiększenie masy ciała może wystąpić podczas leczenia insuliną, w tym Apidra, i przypisywane jest anabolicznemu działaniu insuliny i zmniejszeniu glukozurii.
- Obrzęk obwodowy
Insulina, w tym Apidra, może powodować zatrzymywanie sodu i obrzęki, szczególnie jeśli wcześniej słaba kontrola metaboliczna została poprawiona przez zintensyfikowaną terapię insulinową.
- Działania niepożądane związane z ciągłym podskórnym wlewem insuliny (CSII)
W 12-tygodniowym randomizowanym badaniu z udziałem pacjentów z cukrzycą typu 1 (n = 59) częstość cewników niedrożności i reakcje w miejscu infuzji były podobne u pacjentów leczonych produktem Apidra i insuliną aspart (Tabela 5).
Tabela 5: niedrożności cewnika i reakcje w miejscu infuzji.
| Apidra (n = 29) |
insulina aspart (n = 30) |
|
|---|---|---|
| Okluzowania cewnika / miesiąc | 0.08 | 0.15 |
| Reakcje w miejscu infuzji | 10.3% (3/29) | 13.3% (4/30) |
- Reakcje alergiczne
Alergia lokalna
Podobnie jak w przypadku innych insulinoterapii, u pacjentów przyjmujących lek Apidra może wystąpić zaczerwienienie, obrzęk lub swędzenie w miejscu wstrzyknięcia. Te niewielkie reakcje zwykle ustępują w ciągu kilku dni do kilku tygodni, ale w niektórych przypadkach mogą wymagać przerwania stosowania leku Apidra. W niektórych przypadkach reakcje te mogą być związane z czynnikami innymi niż insulina, takimi jak czynniki drażniące w środku do czyszczenia skóry lub zła technika iniekcji.
Alergia układowa
Ciężka, zagrażająca życiu, uogólniona alergia, w tym anafilaksja, może wystąpić przy każdej insulinie, w tym Apidra. Uogólniona alergia na insulinę może powodować wysypkę na całym ciele (w tym świąd), duszność, świszczący oddech, niedociśnienie, tachykardię lub obfite pocenie się.
W kontrolowanych badaniach klinicznych trwających do 12 miesięcy potencjalne ogólnoustrojowe reakcje alergiczne zgłoszono w 79 przypadkach 1833 pacjentów (4,3%), którzy otrzymywali Apidra i 58 z 1524 pacjentów (3,8%), którzy otrzymywali lek krótkodziałający porównawczy insuliny. Podczas tych badań leczenie produktem Apidra zostało trwale przerwane u 1 z 1833 pacjentów z powodu potencjalnej ogólnoustrojowej reakcji alergicznej.
Podczas stosowania metakrezolu, który jest substancją pomocniczą leku Apidra, zgłaszano miejscowe reakcje i uogólnione bóle mięśniowe.
Produkcja przeciwciał
W badaniu z udziałem pacjentów z cukrzycą typu 1 (n = 333) stężenia przeciwciał insulinowych reagujących zarówno z insuliną ludzką, jak i insuliną glulizyna (reagujące krzyżowo przeciwciała insuliny) pozostawała blisko wartości początkowej przez pierwsze 6 miesięcy badania u pacjentów leczonych Apidra Spadek stężenia przeciwciał obserwowano podczas kolejnych 6 miesięcy badania. W badaniu z udziałem pacjentów z cukrzycą typu 2 (n = 411) podobny wzrost stężenia reagujących krzyżowo przeciwciał insuliny był podobny obserwowane u pacjentów leczonych produktem Apidra iu pacjentów leczonych ludzką insuliną w ciągu pierwszych 9 miesięcy leczenia nauka. Następnie stężenie przeciwciał zmniejszyło się u pacjentów Apidra i pozostało stabilne u pacjentów z insuliną ludzką. Nie stwierdzono korelacji między stężeniem reaktywnych krzyżowo przeciwciał insuliny a zmianami HbA1c, dawek insuliny lub częstością hipoglikemii. Znaczenie kliniczne tych przeciwciał nie jest znane.
Apidra nie wywołała znaczącej odpowiedzi przeciwciał w badaniu dzieci i młodzieży z cukrzycą typu 1.
Doświadczenie po wprowadzeniu do obrotu
Podczas stosowania produktu Apidra po zatwierdzeniu zidentyfikowano następujące działania niepożądane.
Ponieważ reakcje te są zgłaszane dobrowolnie w populacji o niepewnej wielkości, tak nie jest zawsze możliwe jest wiarygodne oszacowanie ich częstotliwości lub ustalenie związku przyczynowego z lekiem ekspozycja.
Zgłaszano błędy w lekach, w których przypadkowo podano inne insuliny, szczególnie insuliny długo działające zamiast Apidra.
Top
Interakcje z lekami
Wiele leków wpływa na metabolizm glukozy i może wymagać dostosowania dawki insuliny oraz szczególnie ścisłego monitorowania.
Leki, które mogą nasilać działanie obniżające stężenie glukozy we krwi przez insulinę, w tym Apidra, a tym samym zwiększać ryzyko hipoglikemii, obejmują doustne produkty przeciwcukrzycowe, pramlintyd, inhibitory ACE, dizopiramid, fibraty, fluoksetyna, inhibitory monoaminooksydazy, propoksyfen, pentoksyfilina, salicylany, analogi somatostatyny i sulfonamid antybiotyki
Leki, które mogą zmniejszać działanie leku Apidra na obniżenie poziomu glukozy we krwi, obejmują kortykosteroidy, niacynę, danazol, leki moczopędne, środki sympatykomimetyczne (np. Epinefrynę, albuterol, terbutalina), glukagon, izoniazyd, pochodne fenotiazyny, somatropina, hormony tarczycy, estrogeny, progestogeny (np. w doustnych środkach antykoncepcyjnych), inhibitory proteazy i atypowe leki przeciwpsychotyczne.
Beta-adrenolityki, klonidyna, sole litu i alkohol mogą zwiększać lub zmniejszać działanie insuliny na obniżanie poziomu glukozy we krwi.
Pentamidyna może powodować hipoglikemię, po której czasami może wystąpić hiperglikemia.
Objawy hipoglikemii mogą być zmniejszone lub nieobecne u pacjentów przyjmujących leki przeciwadrenergiczne, takie jak beta-adrenolityki, klonidyna, guanetydyna i rezerpina.
Top
Użyj w określonych populacjach
Ciąża
Ciąża Kategoria C: Przeprowadzono badania reprodukcji i teratologii z użyciem insuliny glulizynowej u szczurów i królików, stosując zwykłą insulinę ludzką jako lek porównawczy. Insulinę glulizynową podawano samicom szczurów podczas ciąży w dawkach podskórnych do 10 jednostek / kg raz na dobę (dawka powodująca ekspozycja 2 razy większa od średniej dawki dla człowieka, na podstawie porównania powierzchni ciała) i nie miała znaczącego działania toksycznego na zarodek i płód rozwój.
Insulinę glulizynową podawano samicom królików podczas ciąży w dawkach podskórnych do 1,5 Jednostki / kg / dzień (dawka powodująca ekspozycję 0,5-krotną średnią dawkę dla człowieka, w oparciu o powierzchnię ciała porównanie). Niekorzystny wpływ na rozwój zarodka i płodu obserwowano jedynie przy dawkach toksycznych dla matek wywołujących hipoglikemię. Zwiększoną częstość strat po implantacji i wad szkieletu obserwowano przy poziomie dawki 1,5 jednostki / kg raz na dobę (dawka skutkujący narażeniem 0,5 razy większym niż średnia dawka dla człowieka, na podstawie porównania powierzchni ciała), co również spowodowało śmiertelność w tamy Nieznacznie wzrosła częstość strat po implantacji przy następnym niższym poziomie dawki 0,5 jednostki / kg raz na dobę (dawka powodująca narażenie 0,2 razy średnia dawka dla człowieka, na podstawie porównania powierzchni ciała), co było również związane z ciężką hipoglikemią, ale nie było w tym żadnych wad dawka. U królików nie zaobserwowano działania w dawce 0,25 jednostek / kg raz na dobę (dawka skutkująca ekspozycją 0,1 razy większą niż średnia dawka dla ludzi, na podstawie porównania powierzchni ciała). Działanie insuliny glulizynowej nie różniło się od obserwowanych w przypadku stosowania podskórnej zwykłej insuliny ludzkiej w tych samych dawkach i przypisywano ją wtórnym skutkom hipoglikemii u matek.
Nie ma dobrze kontrolowanych badań klinicznych dotyczących stosowania leku Apidra u kobiet w ciąży. Ponieważ badania nad rozmnażaniem zwierząt nie zawsze przewidują odpowiedź człowieka, lek ten należy stosować w czasie ciąży tylko wtedy, gdy potencjalna korzyść uzasadnia potencjalne ryzyko dla płodu. U pacjentów z cukrzycą lub cukrzycą ciążową w przeszłości istotne jest utrzymanie dobrej kontroli metabolicznej przed poczęciem i przez cały okres ciąży. Zapotrzebowanie na insulinę może się zmniejszyć w pierwszym trymestrze ciąży, ogólnie zwiększyć w drugim i trzecim trymestrze ciąży i gwałtownie spaść po porodzie. U tych pacjentów niezbędne jest dokładne monitorowanie kontroli stężenia glukozy.
Matki karmiące
Nie wiadomo, czy insulina glulizynowa przenika do mleka ludzkiego. Ponieważ wiele leków przenika do mleka ludzkiego, należy zachować ostrożność podczas podawania produktu Apidra kobiecie karmiącej. Stosowanie leku Apidra jest zgodne z karmieniem piersią, ale kobiety z cukrzycą karmiące piersią mogą wymagać dostosowania dawek insuliny.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność wstrzyknięć podskórnych preparatu Apidra stwierdzono u dzieci i młodzieży (w wieku od 4 do 17 lat) z cukrzycą typu 1 [Zobacz Studia kliniczne]. Apidra nie była badana u dzieci z cukrzycą typu 1 młodszych niż 4 lata oraz u dzieci z cukrzycą typu 2.
Tak jak u dorosłych, dawkę leku Apidra należy dostosować indywidualnie u dzieci w zależności od potrzeb metabolicznych i częstego monitorowania stężenia glukozy we krwi.
Zastosowanie geriatryczne
W badaniach klinicznych (n = 2408) Apidra podawano 147 pacjentom w wieku 65 lat i 27 pacjentom w wieku 75 lat. Większość tej niewielkiej grupy starszych pacjentów miała cukrzycę typu 2. Zmiana wartości HbA1c i częstości hipoglikemii nie różniła się w zależności od wieku. Niemniej jednak należy zachować ostrożność, gdy Apidra jest podawana pacjentom w podeszłym wieku.
Top
Przedawkowanie
Nadmiar insuliny może powodować hipoglikemię, a zwłaszcza podanie dożylne hipokaliemii. Łagodne epizody hipoglikemii zwykle można leczyć doustną glukozą. Konieczne może być dostosowanie dawki leku, schematów posiłków lub ćwiczeń fizycznych. Cięższe epizody hipoglikemii ze śpiączką, drgawkami lub zaburzeniami neurologicznymi można leczyć domięśniowo / podskórnie glukagonem lub stężoną glukozą dożylną. Konieczne może być ciągłe przyjmowanie węglowodanów i obserwacja, ponieważ hipoglikemia może nawrócić po pozornej poprawie klinicznej. Hipokaliemia musi zostać odpowiednio skorygowana.
Opis
Apidra® (wstrzyknięcie insuliny glulizynowej [rDNA]) jest szybko działającym analogiem ludzkiej insuliny stosowanym do obniżania poziomu glukozy we krwi. Insulina glulizynowa jest wytwarzana za pomocą technologii rekombinacji DNA z wykorzystaniem niepatogennego szczepu laboratoryjnego Escherichia coli (K12). Insulina glulizynowa różni się od ludzkiej insuliny tym, że aminokwas asparagina w pozycji B3 jest zastąpiony lizyną, a lizyna w pozycji B29 jest zastąpiona kwasem glutaminowym. Chemicznie insulina glulizynowa jest insuliną ludzką kwasu 3B-lizyno-29B-glutaminowego, ma wzór empiryczny C258H384N64O78S6 i masę cząsteczkową 5823 oraz ma następujący wzór strukturalny:
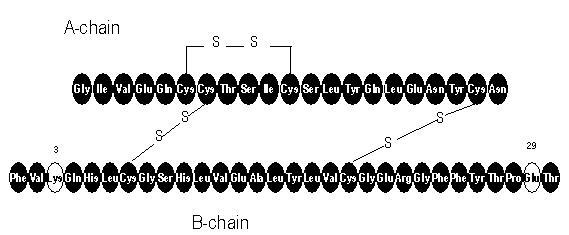
Apidra jest sterylnym, wodnym, przezroczystym i bezbarwnym roztworem. Każdy mililitr leku Apidra zawiera 100 jednostek (3,49 mg) insuliny glulizynowej, 3,15 mg metakrezolu, 6 mg trometaminy, 5 mg chlorku sodu, 0,01 mg polisorbatu 20 i wodę do wstrzykiwań. Apidra ma pH około 7,3. Wartość pH dostosowuje się przez dodanie wodnych roztworów kwasu chlorowodorowego i / lub wodorotlenku sodu.
Top
Farmakologia kliniczna
Mechanizm akcji
Regulacja metabolizmu glukozy jest podstawową aktywnością insulin i analogów insuliny, w tym insuliny glulizynowej. Insuliny obniżają poziom glukozy we krwi, stymulując obwodowe pobieranie glukozy przez mięśnie szkieletowe i tłuszcz oraz hamując wątrobowe wytwarzanie glukozy. Insuliny hamują lipolizę i proteolizę oraz zwiększają syntezę białek.
Aktywności Apidra i zwykłej ludzkiej insuliny obniżające poziom glukozy są równoważne, gdy podaje się ją dożylnie. Po podaniu podskórnym działanie leku Apidra jest szybsze i trwa krócej niż w przypadku zwykłej ludzkiej insuliny. [Patrz farmakodynamika].
Farmakodynamika
Badania na zdrowych ochotnikach i pacjentach z cukrzycą wykazały, że Apidra ma szybsze działanie początek działania i krótszy czas działania niż zwykła ludzka insulina, gdy jest podawana podskórnie.
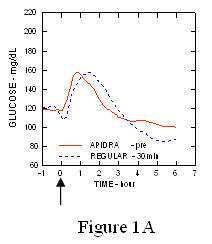
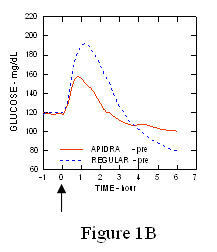
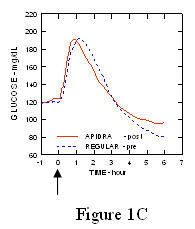
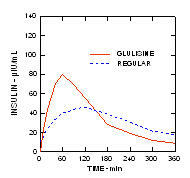
W badaniu z udziałem pacjentów z cukrzycą typu 1 (n = 20) profile obniżające stężenie glukozy w Apidra i regularna insulina ludzka była oceniana w różnym czasie w stosunku do standardowego posiłku w dawce 0,15 Jednostki / kg. (Rysunek 1.)
Maksymalne przekroczenie poziomu glukozy we krwi (Î ”GLUmax; wyjściowe odjęte stężenie glukozy) dla Apidra wstrzykniętego 2 minuty przed posiłkiem wynosiło 65 mg / dl w porównaniu do 64 mg / dl dla zwykłego człowieka insulina wstrzykiwana 30 minut przed posiłkiem (patrz ryc. 1A) i 84 mg / dl dla zwykłej ludzkiej insuliny wstrzykiwana 2 minuty przed posiłkiem (patrz ryc. 1B). Maksymalny skok stężenia glukozy we krwi dla produktu Apidra wstrzykniętego 15 minut po rozpoczęciu posiłku wynosił 85 mg / dl w porównaniu do 84 mg / dl dla zwykłej ludzkiej insuliny wstrzykiwanej 2 minuty przed posiłkiem (patrz ryc 1C).
Rycina 1. Średni seryjny poziom glukozy we krwi zebrany do 6 godzin po podaniu pojedynczej dawki leku Apidra i zwykłej ludzkiej insuliny. Apidra podawana 2 minuty (Apidra - przed) przed rozpoczęciem posiłku w porównaniu do zwykłej ludzkiej insuliny podawanej 30 minut (Regularne - 30 min) przed rozpoczęciem posiłku (ryc. 1A) i w porównaniu do zwykłej ludzkiej insuliny (zwykła - przed) podanej 2 minuty przed posiłkiem (ryc. 1B). Apidra podawana 15 minut (Apidra - po) po rozpoczęciu posiłku w porównaniu ze zwykłą ludzką insuliną (Regular - przed) podawana 2 minuty przed posiłkiem (ryc. 1C). Na osi x zero (0) oznacza początek 15-minutowego posiłku.
 |
 |
 |
 |
W randomizowanym, otwartym, dwukierunkowym badaniu krzyżowym 16 zdrowych mężczyzn otrzymało dożylnie wlew Apidry lub zwykłej ludzkiej insuliny z rozcieńczalnikiem soli fizjologicznej z prędkością 0,8 miliona jednostek / kg / min przez dwa godziny. Wlew tej samej dawki leku Apidra lub zwykłej ludzkiej insuliny zapewnił równoważne usuwanie glukozy w stanie stacjonarnym.
Farmakokinetyka
Absorpcja i biodostępność
Profile farmakokinetyczne u zdrowych ochotników i pacjentów z cukrzycą (typu 1 lub typu 2) wykazały, że wchłanianie insuliny glulizynowej było szybsze niż wchłanianie zwykłej ludzkiej insuliny.
W badaniu z udziałem pacjentów z cukrzycą typu 1 (n = 20) po podskórnym podaniu 0,15 jednostek / kg, mediana czasu do maksymalnego stężenia (Tmax) wynosił 60 minut (zakres od 40 do 120 minut), a maksymalne stężenie (Cmax) wynosiło 83 mikrojednostki / ml (zakres od 40 do 131 mikrojednostek / ml) dla insuliny glulizynowej w porównaniu do mediany Tmax wynoszącej 120 minut (zakres od 60 do 239 minut) i Cmax wynoszącej 50 mikroUnits / ml (zakres od 35 do 71 mikroUnits / ml) dla zwykłego człowieka insulina. (Rysunek 2)
Rysunek 2. Profile farmakokinetyczne insuliny glulizynowej i zwykłej insuliny ludzkiej u pacjentów z cukrzycą typu 1 po dawce 0,15 jednostek / kg.
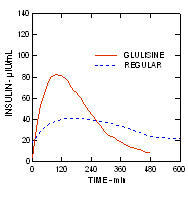
Insulinę glulizynową i zwykłą ludzką insulinę podawano podskórnie w dawce 0,2 jednostki / kg mc badanie klamry euglikemicznej u pacjentów z cukrzycą typu 2 (n = 24) i wskaźnikiem masy ciała (BMI) między 20 a 36 kg / m2. Mediana czasu do maksymalnego stężenia (Tmax) wynosiła 100 minut (zakres od 40 do 120 minut), a mediana maksymalnego stężenia (Cmax) wynosiła 84 mikro jednostek / ml (zakres od 53 do 165 mikro jednostek / ml) dla insuliny glulizynowej w porównaniu do mediany Tmax wynoszącej 240 minut (zakres od 80 do 360 minut) i mediany Cmax wynoszącej 41 mikrojednostek / ml (zakres 33 do 61 mikrojednostek / ml) dla zwykłej ludzkiej insuliny. (Rysunek 3.)
Rycina 3. Profile farmakokinetyczne insuliny glulizynowej i zwykłej insuliny ludzkiej u pacjentów z cukrzycą typu 2 po podskórnej dawce 0,2 jednostki / kg.
Kiedy Apidra wstrzykiwano podskórnie w różne obszary ciała, profile stężenia w czasie były podobne. Bezwzględna dostępność biologiczna insuliny glulizynowej po podaniu podskórnym wynosi około 70%, niezależnie od miejsca wstrzyknięcia (brzuch 73%, naramiennik 71%, udo 68%).
W badaniu klinicznym z udziałem zdrowych ochotników (n = 32) całkowita biodostępność insuliny glulizynowej była podobna po podaniu podskórnym wstrzyknięcie insuliny glulizynowej i insuliny NPH (zmieszanych ze strzykawką) i oddzielne jednoczesne podanie podskórne zastrzyki. Po zmieszaniu było 27% tłumienie maksymalnego stężenia (Cmax) Apidry; nie wpłynęło to jednak na czas do maksymalnego stężenia (Tmax). Brak danych dotyczących mieszania preparatu Apidra z preparatami insuliny innymi niż insulina NPH. [Widzieć Studia kliniczne].
Dystrybucja i eliminacja
Dystrybucja i eliminacja insuliny glulizynowej i zwykłej insuliny ludzkiej po podaniu dożylnym podawanie jest podobne z objętościami dystrybucji 13 i 21 L i okresami półtrwania 13 i 17 minut, odpowiednio. Po podaniu podskórnym insulina glulizynowa jest wydalana szybciej niż zwykła insulina ludzka z pozornym okresem półtrwania wynoszącym 42 minuty w porównaniu do 86 minut.
Farmakologia kliniczna w określonych populacjach
Pacjentów pediatrycznych
Właściwości farmakokinetyczne i farmakodynamiczne produktu Apidra i zwykłej ludzkiej insuliny oceniono w badanie przeprowadzone u dzieci w wieku od 7 do 11 lat (n = 10) i młodzieży w wieku od 12 do 16 lat (n = 10) z typem 1 cukrzyca. Względne różnice w farmakokinetyce i farmakodynamice między produktem Apidra a zwykłą insuliną ludzką w ci pacjenci z cukrzycą typu 1 byli podobni do tych u zdrowych osób dorosłych i dorosłych z typem 1 cukrzyca.
Wyścigi
W badaniu u 24 zdrowych osób rasy białej i Japończyków porównywano farmakokinetykę i farmakodynamikę po podskórnym wstrzyknięciu insuliny glulizynowej, insuliny lispro i zwykłej ludzkiej insuliny. Po podskórnym wstrzyknięciu insuliny glulizynowej Japończycy mieli większą początkową ekspozycję (33%) dla stosunku AUC (0-1h) do AUC (koniec 0-cęgowy) niż u rasy kaukaskiej (21%), chociaż całkowite narażenia wynosiły podobny. Podobne wyniki zaobserwowano w przypadku insuliny lispro i zwykłej insuliny ludzkiej.
Otyłość
Insulinę glulizynową i zwykłą ludzką insulinę podawano podskórnie w dawce 0,3 jednostki / kg mc badanie klamry euglikemicznej u osób otyłych bez cukrzycy (n = 18) o wskaźniku masy ciała (BMI) między 30 a 40 kg / m2. Mediana czasu do maksymalnego stężenia (Tmax) wyniosła 85 minut (zakres od 49 do 150 minut), a mediana maksymalnego stężenia (Cmax) wynosiła 192 mikro jednostek / ml (zakres od 98 do 380 mikro jednostek / ml) dla insuliny glulizynowej w porównaniu ze medianą Tmax wynoszącą 150 minut (zakres 90 do 240 minut) i medianą Cmax wynoszącą 86 mikro jednostek / ml (zakres 43 do 175 mikro jednostek / ml) dla zwykłego człowieka insulina.
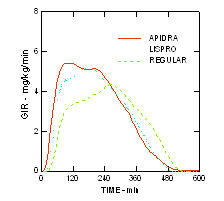
Szybszy początek działania i krótszy czas działania Apidra i insuliny lispro w porównaniu ze zwykłą insuliną ludzką utrzymywały się w populacji otyłej bez cukrzycy (n = 18). (Rysunek 4.)
Rycina 4. Szybkości infuzji glukozy (GIR) w badaniu klamry euglikemicznej po iniekcji podskórnej 0,3 jednostki / kg Apidra, insuliny lispro lub zwykłej ludzkiej insuliny w populacji otyłej.
Zaburzenia czynności nerek
Badania nad ludzką insuliną wykazały zwiększony poziom insuliny w krążeniu u pacjentów z niewydolnością nerek. W badaniu przeprowadzonym na 24 osobach bez cukrzycy z prawidłową czynnością nerek (ClCr> 80 ml / min), umiarkowanymi zaburzeniami czynności nerek (30-50 ml / min) i ciężkimi zaburzeniami czynności nerek (ostrzeżenia i środki ostrożności).
Zaburzenia czynności wątroby
Wpływ zaburzeń czynności wątroby na farmakokinetykę i farmakodynamikę produktu Apidra nie był badany. Niektóre badania z ludzką insuliną wykazały zwiększony poziom insuliny w krążeniu u pacjentów z niewydolnością wątroby. [Widzieć Ostrzeżenia i środki].
Płeć
Wpływ płci na farmakokinetykę i farmakodynamikę produktu Apidra nie był badany.
Ciąża
Wpływ ciąży na farmakokinetykę i farmakodynamikę produktu Apidra nie był badany.
Palenie
Wpływ palenia na farmakokinetykę i farmakodynamikę produktu Apidra nie był badany.
Top
Toksykologia niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
Nie przeprowadzono standardowych dwuletnich badań rakotwórczości na zwierzętach. U szczurów Sprague Dawley przeprowadzono 12-miesięczne badanie toksyczności po podaniu wielokrotnym insuliny glulizynowej w dawkach podskórnych 2,5, 5, 20 lub 50 jednostek / kg dwa razy dziennie (dawka powodująca ekspozycję 1, 2, 8 i 20-krotność średniej dawki dla człowieka, w oparciu o powierzchnię ciała porównanie).
U samic szczurów, którym podawano insulinę glulizynową, nie stwierdzono zależnej od dawki częstości występowania guzów gruczołu sutkowego w porównaniu do nieleczonych kontroli. Częstość występowania guzów sutka w przypadku insuliny glulizynowej i zwykłej insuliny ludzkiej była podobna. Znaczenie tych wyników dla ludzi nie jest znane. Insulina glulizynowa nie działała mutagennie w następujących testach: test Amesa, chromosom ssaków in vitro test aberracji w komórkach chomika chińskiego V79 oraz test mikrojądrowy erytrocytów ssaków in vivo w szczury
W badaniach płodności u samców i samic szczurów w dawkach podskórnych do 10 jednostek / kg raz na dobę (dawka powodująca narażenie 2 razy większe niż średnia wartość u ludzi dawka na podstawie porównania powierzchni ciała), brak wyraźnego negatywnego wpływu na płodność samców i samic lub ogólna wydajność reprodukcyjna zwierząt zauważony.
Top
Studia kliniczne
Bezpieczeństwo i skuteczność preparatu Apidra badano u dorosłych pacjentów z cukrzycą typu 1 i typu 2 (n = 1833) oraz u dzieci i młodzieży (od 4 do 17 lat) z cukrzycą typu 1 (n = 572). Podstawowym parametrem skuteczności w tych badaniach była kontrola glikemii, oceniana za pomocą hemoglobiny glikowanej (GHb zgłoszone jako równoważnik HbA1c).
Cukrzyca typu 1 - dorośli
Przeprowadzono 26-tygodniowe, randomizowane, otwarte, kontrolowane aktywnie badanie nie gorszej jakości u pacjentów z cukrzycą typu 1 w celu oceny bezpieczeństwo i skuteczność produktu Apidra (n = 339) w porównaniu z insuliną lispro (n = 333), gdy podano go podskórnie w ciągu 15 minut przed posiłek. Insulinę glargine podawano raz dziennie wieczorem jako insulinę podstawową. Przed randomizacją stosowano 4-tygodniowy okres docierania insuliny lispro i insuliny glargine. Większość pacjentów była rasy białej (97%). Pięćdziesiąt osiem procent pacjentów stanowili mężczyźni. Średni wiek wynosił 39 lat (zakres od 18 do 74 lat). Kontrola glikemii, liczba codziennych krótko działających zastrzyków insuliny oraz całkowita dzienna dawka Apidra i insuliny lispro były podobne w dwóch grupach leczenia (Tabela 6).
Tabela 6: Cukrzyca typu 1 - dorośli
| Czas trwania leczenia Leczenie w połączeniu z: |
26 tygodni Insulina glargine |
|
|---|---|---|
| Apidra | Insulina Lispro | |
| ||
| Hemoglobina glikowana (GHb)* (%) | ||
| Liczba pacjentów | 331 | 322 |
| Średnia wyjściowa | 7.6 | 7.6 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | -0.1 | -0.1 |
| Różnica w leczeniu: Apidra - Insulin Lispro | 0.0 | |
| 95% CI dla różnicy w leczeniu | (-0.1; 0.1) | |
| Podstawowa dawka insuliny (jednostki / dzień) | ||
| Średnia wyjściowa | 24 | 24 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | 0 | 2 |
| Krótkodziałająca dawka insuliny (jednostki / dzień) | ||
| Średnia wyjściowa | 30 | 31 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | -1 | -1 |
| Średnia liczba krótko działających zastrzyków insuliny na dzień | 3 | 3 |
| Masa ciała (kg) | ||
| Średnia wyjściowa | 73.9 | 74.1 |
| Średnia zmiana w stosunku do wartości początkowej | 0.6 | 0.3 |
Cukrzyca typu 2 - dorośli
26-tygodniowe, randomizowane, otwarte, kontrolowane aktywnie badanie nie gorszej jakości zostało przeprowadzone u pacjentów leczonych insuliną z cukrzycą typu 2 w celu oceny bezpieczeństwo i skuteczność preparatu Apidra (n = 435) podanego w ciągu 15 minut przed posiłkiem w porównaniu ze zwykłą ludzką insuliną (n = 441) podawaną 30 do 45 minut przed posiłek. Ludzka insulina NPH była podawana dwa razy dziennie jako insulina podstawowa. Wszyscy pacjenci uczestniczyli w 4-tygodniowym okresie docierania ze zwykłą insuliną ludzką i insuliną ludzką NPH. Osiemdziesiąt pięć procent pacjentów było rasy białej, a 11% było rasy czarnej. Średni wiek wynosił 58 lat (zakres od 26 do 84 lat). Średni wskaźnik masy ciała (BMI) wynosił 34,6 kg / m2. Podczas randomizacji 58% pacjentów przyjmowało doustny lek przeciwcukrzycowy. Tych pacjentów pouczono, aby kontynuowali stosowanie doustnego leku przeciwcukrzycowego w tej samej dawce przez cały okres badania. Większość pacjentów (79%) mieszała krótko działającą insulinę z ludzką insuliną NPH bezpośrednio przed wstrzyknięciem. Zmniejszenie GHb w stosunku do wartości wyjściowych było podobne między 2 grupami leczenia (patrz Tabela 7). Nie zaobserwowano różnic między grupami insuliny Apidra a zwykłą ludzką insuliną pod względem liczby codziennych krótko działających zastrzyków insuliny lub podstawowych lub krótko działających dawek insuliny. (Patrz Tabela 7.)
Tabela 7: Cukrzyca typu 2 - osoba dorosła
| Czas trwania leczenia | 26 tygodni | |
|---|---|---|
| Leczenie w połączeniu z: | Ludzka insulina NPH | |
| Apidra | Zwykła ludzka insulina | |
| ||
| Hemoglobina glikowana (GHb)* (%) | ||
| Liczba pacjentów | 404 | 403 |
| Średnia wyjściowa | 7.6 | 7.5 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | -0.5 | -0.3 |
| Różnica w leczeniu: Apidra - zwykła ludzka insulina | -0.2 | |
| 95% CI dla różnicy w leczeniu | (-0.3; -0.1) | |
| Podstawowa dawka insuliny (jednostki / dzień) | ||
| Średnia wyjściowa | 59 | 57 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | 6 | 6 |
| Krótkodziałająca dawka insuliny (jednostki / dzień) | ||
| Średnia wyjściowa | 32 | 31 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | 4 | 5 |
| Średnia liczba krótko działających zastrzyków insuliny na dzień | 2 | 2 |
| Masa ciała (kg) | ||
| Średnia wyjściowa | 100.5 | 99.2 |
| Średnia zmiana w stosunku do wartości początkowej | 1.8 | 2.0 |
Dorośli z cukrzycą typu 1: Podawanie przed posiłkiem i po posiłku
Przeprowadzono 12-tygodniowe, randomizowane, otwarte, kontrolowane aktywnie badanie nie gorszej jakości u pacjentów z cukrzyca typu 1 w celu oceny bezpieczeństwa i skuteczności Apidra podawanego w różnym czasie w odniesieniu do posiłek. Apidra podawano podskórnie w ciągu 15 minut przed posiłkiem (n = 286) lub bezpośrednio po posiłek (n = 296) i zwykłą ludzką insulinę (n = 278) podawano podskórnie 30 do 45 minut przed posiłek. Insulinę glargine podawano raz dziennie przed snem jako podstawową insulinę. Był 4-tygodniowy okres docierania ze zwykłą insuliną ludzką i insuliną glargine, a następnie randomizacją. Większość pacjentów była rasy białej (94%). Średni wiek wynosił 40 lat (zakres od 18 do 73 lat). Kontrola glikemii (patrz Tabela 8) była porównywalna dla 3 schematów leczenia. Nie zaobserwowano żadnych zmian w stosunku do wartości wyjściowej między terapiami w całkowitej dziennej liczbie krótko działających zastrzyków insuliny. (Patrz Tabela 8.)
Tabela 8: Podawanie przed posiłkiem i po posiłku u osób dorosłych z cukrzycą typu 1
| Czas trwania leczenia Leczenie w połączeniu z: |
12 tygodni insulina glargine |
12 tygodni insulina glargine |
12 tygodni insulina glargine |
|---|---|---|---|
| Apidra przed posiłkiem |
Apidra posiłek po posiłku |
Zwykła ludzka insulina | |
| |||
| Hemoglobina glikowana (GHb)* (%) | |||
| Liczba pacjentów | 268 | 276 | 257 |
| Średnia wyjściowa | 7.7 | 7.7 | 7.6 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej†| -0.3 | -0.1 | -0.1 |
| Podstawowa dawka insuliny (jednostki / dzień) | |||
| Średnia wyjściowa | 29 | 29 | 28 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | 1 | 0 | 1 |
| Krótkodziałająca dawka insuliny (jednostki / dzień) | |||
| Średnia wyjściowa | 29 | 29 | 27 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | -1 | -1 | 2 |
| Średnia liczba krótko działających zastrzyków insuliny na dzień | 3 | 3 | 3 |
| Masa ciała (kg) | |||
| Średnia wyjściowa | 79.2 | 80.3 | 78.9 |
| Średnia zmiana w stosunku do wartości początkowej | 0.3 | -0.3 | 0.3 |
Pacjenci z cukrzycą typu 1 i pediatryczni
Przeprowadzono 26-tygodniowe, randomizowane, otwarte, kontrolowane aktywnie badanie nie gorszej jakości u dzieci i młodzieży w wieku powyżej 4 lat z typem 1 cukrzyca w celu oceny bezpieczeństwa i skuteczności produktu Apidra (n = 277) w porównaniu z insuliną lispro (n = 295) po podaniu podskórnym w ciągu 15 minut przed posiłek. Pacjenci otrzymywali również insulinę glargine (podawaną raz dziennie wieczorem) lub insulinę NPH (podawaną raz rano i raz wieczorem). Przed randomizacją był 4-tygodniowy okres docierania insuliny lispro i insuliny glargine lub NPH. Większość pacjentów była rasy białej (91%). Pięćdziesiąt procent pacjentów stanowili mężczyźni. Średni wiek wynosił 12,5 roku (zakres od 4 do 17 lat). Średnie BMI wyniosło 20,6 kg / m2. Kontrola glikemii (patrz Tabela 9) była porównywalna dla dwóch schematów leczenia.
Tabela 9: Wyniki 26-tygodniowego badania z udziałem dzieci i młodzieży z cukrzycą typu 1
| Apidra | Lispro | |
|---|---|---|
| Liczba pacjentów | 271 | 291 |
| Podstawowa insulina | NPH lub insulina glargine | NPH lub insulina glargine |
| ||
| Hemoglobina glikowana (GHb)* (%) | ||
| Średnia wyjściowa | 8.2 | 8.2 |
| Skorygowana średnia zmiana w stosunku do wartości początkowej | 0.1 | 0.2 |
| Różnica w leczeniu: średnia (95% przedział ufności) | -0.1 (-0.2, 0.1) | |
| Podstawowa dawka insuliny (jednostki / kg / dzień) | ||
| Średnia wyjściowa | 0.5 | 0.5 |
| Średnia zmiana w stosunku do wartości początkowej | 0.0 | 0.0 |
| Krótkodziałająca dawka insuliny (jednostki / kg / dzień) | ||
| Średnia wyjściowa | 0.5 | 0.5 |
| Średnia zmiana w stosunku do wartości początkowej | 0.0 | 0.0 |
| Średnia liczba krótko działających zastrzyków insuliny na dzień | 3 | 3 |
| Wyjściowa średnia masa ciała (kg) | 51.5 | 50.8 |
| Średnia zmiana masy ciała w stosunku do wartości początkowej (kg) | 2.2 | 2.2 |
Cukrzyca typu 1 - dorośli: ciągły podskórny wlew insuliny
12-tygodniowe randomizowane badanie z aktywną kontrolą (Apidra vs. insulina aspart) przeprowadzone u dorosłych z cukrzycą typu 1 (Apidra n = 29, insulina aspart n = 30) ocenili zastosowanie Apidra w zewnętrznej ciągłej insulinie podskórnej pompa. Wszyscy pacjenci byli rasy białej. Średni wiek wynosił 46 lat (zakres od 21 do 73 lat). Średni poziom GHb wzrósł od wartości wyjściowej do punktu końcowego w obu grupach leczenia (z 6,8% do 7,0% dla Apidra; od 7,1% do 7,2% dla insuliny aspart).
Top
Jak dostarczane / Przechowywanie i obsługa
Jak dostarczone
| |
| Apidra 100 jednostek na ml (U-100) jest dostępna jako: | |
| Fiolki 10 ml | NDC 0088–2500–33 |
| System wkładów 3 ml*, pakiet 5 szt | NDC 0088–2500–52 |
| 3 ml wstrzykiwacz SoloStar, opakowanie 5 szt | NDC 0088-2502-05 |
Igły do penów nie są dołączone do opakowań.
Igły do pióra BD Ultra-Fine ™ 1 do stosowania w połączeniu z OptiClik są sprzedawane osobno i są produkowane przez Becton Dickinson and Company.
Solostar jest kompatybilny ze wszystkimi igłami do penów firmy Becton Dickinson and Company, Ypsomed i Owen Mumford.
Przechowywanie
Nie używać po upływie daty ważności (patrz karton i pojemnik).
Nieotwarta fiolka / system wkładów / SoloStar
Nieotwarte fiolki Apidra, systemy wkładów i wstrzykiwacz SoloStar należy przechowywać w lodówce w temperaturze 2–8 ° C (36–46 ° F). Chronić przed światłem. Apidra nie powinna być przechowywana w zamrażarce i nie powinna mieć możliwości zamarznięcia. Odrzuć, jeśli został zamrożony.
Nieotwarte fiolki / systemy wkładów / SoloStar nie przechowywane w lodówce należy zużyć w ciągu 28 dni.
Otwarta (używana) fiolka:
Otwarte fiolki, nawet schłodzone, należy zużyć w ciągu 28 dni. Jeśli chłodzenie nie jest możliwe, używaną otwartą fiolkę można przechowywać w stanie niezamrożonym do 28 dni z dala od bezpośredniego ciepła i światła, o ile temperatura nie jest wyższa niż 25 ° C (77 ° F).
System otwartych (używanych) kaset:
Otwarty (w użyciu) system wkładów włożony do OptiClik® NIE powinien być chłodzony, ale powinien być przechowywany w temperaturze poniżej 25 ° C z dala od bezpośredniego ciepła i światła. Otwarty (w użyciu) system wkładów należy wyrzucić po 28 dniach. Nigdy nie przechowuj OptiClik®, z systemem wkładów lub bez, w lodówce.
Otwarty (w użyciu) fabrycznie napełniony wstrzykiwacz SoloStar:
Otwartego (w trakcie użytkowania) SoloStar NIE należy przechowywać w lodówce, ale należy go przechowywać w temperaturze poniżej 25 ° C z dala od bezpośredniego ciepła i światła. Otwarty (używany) SoloStar przechowywany w temperaturze pokojowej należy wyrzucić po 28 dniach.
Zestawy infuzyjne:
Zestawy infuzyjne (zbiorniki, rurki i cewniki) i Apidra w zbiorniku należy wyrzucić po 48 godzinach użytkowania lub po wystawieniu na działanie temperatur przekraczających 37 ° C (98,6 ° F).
Podanie dożylne:
Worki infuzyjne przygotowane zgodnie ze wskazówkami pod DAWKOWANIE I SPOSÓB PODAWANIA są stabilne w temperaturze pokojowej przez 48 godzin.
Przygotowanie i obsługa
Po rozcieńczeniu do podania dożylnego przed podaniem roztwór należy obejrzeć pod kątem obecności cząstek stałych i przebarwień. Nie używaj roztworu, jeśli stał się mętny lub zawiera cząsteczki; używaj tylko wtedy, gdy jest przezroczysty i bezbarwny. Apidra nie jest kompatybilny z roztworem dekstrozy i roztworem Ringera, dlatego nie można go stosować z tymi płynami w roztworze. Stosowanie leku Apidra z innymi roztworami nie zostało zbadane i dlatego nie jest zalecane.
System nabojów: Jeśli OptiClik® (urządzenie do podawania insuliny dla Apidry) działa nieprawidłowo, Apidra można pobrać z systemu nabojów do strzykawki U-100 i wstrzyknąć.
Apidra, insulina glusine, informacje dla pacjenta (w prostym angielskim)
ostatnia aktualizacja: 02/2009
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę



