Onglyza do leczenia cukrzycy
Nazwa marki: Onglyza
Nazwa ogólna: sagagliptyna
Postać dawkowania: tabletka powlekana
Zawartość:
Wskazania i zastosowanie
Dawkowanie i sposób podawania
Formy dawkowania i mocne strony
Przeciwwskazania
Ostrzeżenia i środki
Działania niepożądane
Interakcje z lekami
Użyj w określonych populacjach
Przedawkowanie
Opis
Farmakologia
Toksykologia niekliniczna
Studia kliniczne
Jak dostarczone
Informacje o pacjencie Onglyza (w prostym angielskim)
Wskazania i zastosowanie
Monoterapia i terapia skojarzona
Lek Onglyza jest wskazany jako dodatek do diety i ćwiczeń fizycznych w celu poprawy kontroli glikemii u osób dorosłych z cukrzycą typu 2. [Widzieć Studia kliniczne].
Ważne ograniczenia użytkowania
Lek Onglyza nie powinien być stosowany w leczeniu cukrzycy typu 1 lub cukrzycowej kwasicy ketonowej, ponieważ nie byłby skuteczny w tych warunkach.
Lek Onglyza nie był badany w połączeniu z insuliną.
Top
Dawkowanie i sposób podawania
Zalecane dawkowanie
Zalecana dawka produktu Onglyza wynosi 2,5 mg lub 5 mg raz na dobę, niezależnie od posiłków.
Pacjenci z zaburzeniami czynności nerek
Nie zaleca się dostosowywania dawki produktu Onglyza u pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny [CrCl]> 50 ml / min).
Dawka produktu Onglyza wynosi 2,5 mg raz na dobę u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek, lub ze schyłkową niewydolnością nerek (ESRD) wymagającą hemodializy (klirens kreatyniny [CrCl] â50) ml / min). Lek Onglyza należy podawać po hemodializie. Lek Onglyza nie był badany u pacjentów poddawanych dializie otrzewnowej.
Ponieważ dawka produktu Onglyza powinna być ograniczona do 2,5 mg w zależności od czynności nerek, zaleca się ocenę czynności nerek przed rozpoczęciem stosowania produktu Onglyza, a następnie okresowo. Czynność nerek można oszacować na podstawie stężenia kreatyniny w surowicy, stosując formułę Cockcrofta-Gaulta lub modyfikację diety w chorobie nerek. [Widzieć Farmakologia kliniczna, Farmakokinetyka.]
Silne inhibitory CYP3A4 / 5
Dawka produktu Onglyza wynosi 2,5 mg raz na dobę, gdy jest podawana jednocześnie z silnymi inhibitorami cytochromu P450 3A4 / 5 (CYP3A4 / 5) (np. ketokonazol, atazanawir, klarytromycyna, indynawir, itrakonazol, nefazodon, nelfinawir, rytonawir, sakwinawir i telitromycyna). [Widzieć Interakcje z lekami, Inhibitory enzymów CYP3A4 / 5 i Farmakologia kliniczna, Farmakokinetyka.]
Top
Formy dawkowania i mocne strony
- Tabletki 5 mg Onglyza (saksagliptyna) to różowe, dwustronnie wypukłe, okrągłe tabletki powlekane z nadrukiem „5” na jednej stronie i „4215” na drugiej stronie, niebieskim tuszem.
- Tabletki 2,5 mg produktu Onglyza (saksagliptyna) są jasnożółte do jasnożółtych, dwustronnie wypukłych, okrągłych tabletek powlekanych z nadrukiem „2,5” na jednej stronie i „4214” na drugiej stronie, niebieskim tuszem.
Top
Przeciwwskazania
Żaden.
Top
Ostrzeżenia i środki
Używaj z lekami, które mogą powodować hipoglikemię
Sekretarze insuliny, tacy jak sulfonylomoczniki, powodują hipoglikemię. Dlatego może być wymagana niższa dawka sekretagoga insuliny, aby zmniejszyć ryzyko hipoglikemii, gdy jest stosowany w skojarzeniu z produktem Onglyza. [Widzieć Działania niepożądane, Doświadczenia z badań klinicznych.]
Wyniki makronaczyniowe
Nie przeprowadzono badań klinicznych, które potwierdzałyby jednoznaczne dowody zmniejszenia ryzyka makronaczyniowego za pomocą Onglyza lub jakiegokolwiek innego leku przeciwcukrzycowego.
Top
Działania niepożądane
Doświadczenia z badań klinicznych
Ponieważ badania kliniczne prowadzone są w bardzo różnych warunkach, częstość występowania działań niepożądanych obserwowana w badaniach klinicznych a leku nie można bezpośrednio porównać ze wskaźnikami w badaniach klinicznych innego leku i może nie odzwierciedlać wskaźników obserwowanych w ćwiczyć.
Monoterapia i skojarzona terapia skojarzona
W dwóch kontrolowanych placebo badaniach monoterapii trwających 24 tygodnie pacjenci byli leczeni produktem Onglyza 2,5 mg na dobę, Onglyza 5 mg na dobę i placebo. Przeprowadzono również 24-tygodniowe, kontrolowane placebo, dodatkowe badania skojarzone: jedna z metforminą, jedna z tiazolidynodionem (pioglitazon lub rozyglitazon) i jedna z gliburydem. W tych trzech badaniach pacjenci zostali losowo przydzieleni do leczenia uzupełniającego produktem Onglyza 2,5 mg na dobę, Onglyza 5 mg na dobę lub placebo. Ramię leczenia saksagliptyną w dawce 10 mg zostało włączone do jednego z badań monoterapii i do dodatkowego badania skojarzonego z metforminą.
W uprzednio określonej zbiorczej analizie 24-tygodniowych danych (niezależnie od ratowania glikemii) z dwóch prób monoterapii, dodatku do badania metforminy, dodatku do badania tiazolidynodionu (TZD), oraz w dodatku do badania gliburydu, ogólna częstość występowania zdarzeń niepożądanych u pacjentów leczonych produktem Onglyza 2,5 mg i produktem Onglyza 5 mg była podobna do placebo (72,0% i 72,2% w porównaniu do 70,6%, odpowiednio). Przerwanie leczenia z powodu zdarzeń niepożądanych wystąpiło odpowiednio u 2,2%, 3,3% i 1,8% pacjentów otrzymujących Onglyza 2,5 mg, Onglyza 5 mg i placebo. Najczęstsze zdarzenia niepożądane (zgłaszane u co najmniej 2 pacjentów leczonych produktem Onglyza 2,5 mg lub co najmniej 2 pacjentów leczonych produktem Onglyza 5 mg) związane z przedwczesnym przerwaniem leczenia obejmowały limfopenię (odpowiednio 0,1% i 0,5% w porównaniu do 0%), wysypkę (0,2% i 0,3% w porównaniu z 0,3%), zwiększenie stężenia kreatyniny we krwi (0,3% i 0% w porównaniu do 0%) i zwiększenie aktywności fosfokinazy kreatynowej we krwi (0,1% i 0,2% w porównaniu do 0%). Zgłoszone działania niepożądane w tej zbiorczej analizie (niezależnie od oceny związku przyczynowego przez badacza) w • 5% pacjentów leczonych produktem Onglyza 5 mg i częściej niż u pacjentów leczonych placebo pokazano w Tabela 1.
Tabela 1: Działania niepożądane (niezależnie od oceny przyczynowości przez badacza) w badaniach kontrolowanych placebo * Zgłoszone u%% O 5% pacjentów leczonych produktem Onglyza 5 mg i częściej niż u pacjentów leczonych produktem Onglyza Placebo
| Liczba (%) pacjentów | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * 5 badań kontrolowanych placebo obejmuje dwa badania monoterapii i jedno badanie skojarzone terapii skojarzonej z każdym z następujących: metformina, tiazolidynodion lub gliburyd. Tabela pokazuje dane z 24 tygodni bez względu na ratowanie glikemii. | ||
| Zakażenia górnych dróg oddechowych | 68 (7.7) | 61 (7.6) |
| Zakażenie dróg moczowych | 60 (6.8) | 49 (6.1) |
| Bół głowy | 57 (6.5) | 47 (5.9) |
U pacjentów leczonych produktem Onglyza 2,5 mg ból głowy (6,5%) był jedynym działaniem niepożądanym zgłaszanym z częstością 5% i częściej niż u pacjentów otrzymujących placebo.
W tej zbiorczej analizie działania niepożądane zgłaszane u 2% pacjentów leczonych produktem Onglyza 2,5 mg lub produktem Onglyza 5 mg oraz o 1% częściej niż w grupie placebo obejmowały: zapalenie zatok (odpowiednio 2,9% i 2,6% w porównaniu z 1,6%), ból brzucha (2,4% i 1,7% w porównaniu z 0,5%), zapalenie żołądka i jelit (1,9% i 2,3% w porównaniu z 0,9%) i wymioty (2,2% i 2,3% w porównaniu z 1,3% ).
W dodatku do badania TZD częstość występowania obrzęków obwodowych była większa dla produktu Onglyza 5 mg w porównaniu z placebo (odpowiednio 8,1% i 4,3%). Częstość występowania obrzęków obwodowych dla produktu Onglyza 2,5 mg wynosiła 3,1%. Żadne ze zgłoszonych działań niepożądanych obrzęku obwodowego nie spowodowało przerwania stosowania badanego leku. Wskaźniki obrzęku obwodowego dla produktu Onglyza 2,5 mg i produktu Onglyza 5 mg w porównaniu z placebo wyniosły 3,6% i 2% w porównaniu do 3% w monoterapii, 2,1% i 2,1% w porównaniu z 2,2% podawanymi jako leczenie uzupełniające do metforminy oraz 2,4% i 1,2% w porównaniu z 2,2% podawanymi jako leczenie uzupełniające gliburyd.
Częstość występowania złamań wynosiła odpowiednio 1,0 i 0,6 na 100 pacjentolat, odpowiednio dla produktu Onglyza (łączna analiza 2,5 mg, 5 mg i 10 mg) i placebo. Częstotliwość występowania złamań u pacjentów, którzy otrzymywali Onglyza, nie rosła z czasem. Przyczynowość nie została ustalona, a badania niekliniczne nie wykazały niekorzystnego wpływu saksagliptyny na kości.
W programie klinicznym obserwowano zdarzenie małopłytkowości, zgodne z rozpoznaniem idiopatycznej plamicy małopłytkowej. Związek tego wydarzenia z Onglyza nie jest znany.
Działania niepożądane związane z podawaniem produktu Onglyza jednocześnie z metforminą u nieleczonych wcześniej pacjentów z cukrzycą typu 2
Tabela 2 pokazuje zgłaszane działania niepożądane (niezależnie od oceny związku przyczynowego przez badacza) u 5% pacjentów udział w dodatkowym 24-tygodniowym, aktywnie kontrolowanym badaniu jednoczesnego podawania produktu Onglyza i metforminy w leczeniu nieleczonym pacjenci
Tabela 2: Początkowa terapia z zastosowaniem kombinacji produktu Onglyza i metforminy u pacjentów wcześniej nieleczonych: zgłaszane działania niepożądane (niezależnie od oceny badacza przyczynowości) u 5% pacjentów leczonych skojarzonym lekiem Onglyza w dawce 5 mg plus metformina (i częściej niż u pacjentów leczonych metforminą Sam)
| Liczba (%) pacjentów | ||
|---|---|---|
| Onglyza 5 mg + metformina * N = 320 |
Metformina * N = 328 |
|
| * Metforminę rozpoczynano od dawki początkowej 500 mg na dobę i stopniowo zwiększano do maksymalnie 2000 mg na dobę. | ||
| Bół głowy | 24 (7.5) | 17 (5.2) |
| Zapalenie nosogardzieli | 22 (6.9) | 13 (4.0) |
Hipoglikemia
Działania niepożądane hipoglikemii oparto na wszystkich zgłoszeniach hipoglikemii; jednoczesny pomiar glukozy nie był wymagany. W badaniu dodatkowym do badania gliburydu ogólna częstość zgłaszanej hipoglikemii była większa dla produktu Onglyza 2,5 mg i produktu Onglyza 5 mg (13,3% i 14,6%) w porównaniu do placebo (10,1%). Występowanie potwierdzonej hipoglikemii w tym badaniu, zdefiniowane jako objawy hipoglikemii, któremu towarzyszy wartość stężenia glukozy na palcu wynosząca –50 mg / dl wynosiła 2,4% i 0,8% dla produktu Onglyza 2,5 mg i produktu Onglyza 5 mg i 0,7% dla placebo. Częstość zgłaszanej hipoglikemii dla produktu Onglyza 2,5 mg i produktu Onglyza 5 mg w porównaniu z placebo podawanym w monoterapii wynosiła 4,0% i 5,6% w porównaniu Odpowiednio 4,1%, 7,8% i 5,8% w porównaniu z 5% w leczeniu uzupełniającym do metforminy oraz 4,1% i 2,7% w porównaniu z 3,8% w leczeniu uzupełniającym TZD. Częstość zgłaszanej hipoglikemii wynosiła 3,4% u wcześniej nieleczonych pacjentów otrzymujących Onglyza w dawce 5 mg plus metformina i 4,0% u pacjentów otrzymujących samą metforminę.
Reakcje nadwrażliwości
Zdarzenia związane z nadwrażliwością, takie jak pokrzywka i obrzęk twarzy w 5-analizowej zbiorczej analizie do 24 tygodnia zgłaszano u 1,5%, 1,5% i 0,4% pacjentów, którzy otrzymali Onglyza 2,5 mg, Onglyza 5 mg i placebo, odpowiednio. Żadne z tych zdarzeń u pacjentów, którzy otrzymali Onglyza, nie wymagało hospitalizacji ani nie zostało zgłoszone przez badaczy jako zagrażające życiu. Jeden pacjent leczony saksagliptyną w tej zbiorczej analizie przerwał leczenie z powodu uogólnionej pokrzywki i obrzęku twarzy.
Oznaki życia
U pacjentów leczonych produktem Onglyza nie zaobserwowano klinicznie znaczących zmian parametrów życiowych.
Testy laboratoryjne
Liczy się absolutna liczba limfocytów
W przypadku produktu Onglyza obserwowano zależne od dawki średnie zmniejszenie bezwzględnej liczby limfocytów. W stosunku do wyjściowej średniej bezwzględnej liczby limfocytów wynoszącej około 2200 komórek / mikrolitr, średnie zmniejszenie o około 100 i 120 komórek / mikrolitr z Onglyza odpowiednio 5 mg i 10 mg w stosunku do placebo obserwowano po 24 tygodniach w zbiorczej analizie pięciu klinicznie kontrolowanych placebo studia. Podobne efekty zaobserwowano, gdy Onglyza 5 mg podano w początkowej kombinacji z metforminą w porównaniu z samą metforminą. Nie zaobserwowano żadnej różnicy dla produktu Onglyza 2,5 mg w porównaniu z placebo. Odsetek pacjentów, u których stwierdzono liczbę limfocytów - 50 50750 komórek / mikroL, wynosił odpowiednio 0,5%, 1,5%, 1,4% i 0,4% w grupach saksagliptyny 2,5 mg, 5 mg, 10 mg i placebo. U większości pacjentów nie zaobserwowano nawrotu po wielokrotnym narażeniu na produkt Onglyza, chociaż u niektórych pacjentów występowały nawracające spadki po ponownym podaniu leku, które doprowadziły do przerwania leczenia produktem Onglyza. Spadek liczby limfocytów nie był związany z klinicznie istotnymi działaniami niepożądanymi.
Znaczenie kliniczne tego zmniejszenia liczby limfocytów w porównaniu z placebo nie jest znane. Gdy jest to klinicznie wskazane, na przykład w przypadku nietypowej lub długotrwałej infekcji, należy zmierzyć liczbę limfocytów. Wpływ produktu Onglyza na liczbę limfocytów u pacjentów z zaburzeniami limfocytów (np. Ludzkim wirusem niedoboru odporności) jest nieznany.
Płytki krwi
Onglyza nie wykazał klinicznie znaczącego ani spójnego wpływu na liczbę płytek krwi w sześciu badaniach z podwójnie ślepą próbą, kontrolowanych bezpieczeństwem klinicznym i skuteczności.
Top
Interakcje z lekami
Induktory enzymów CYP3A4 / 5
Ryfampina znacząco zmniejszała ekspozycję na saksagliptynę bez zmian w obszarze pod krzywą zależności czasu od stężenia (AUC) jego aktywnego metabolitu, 5-hydroksysaksagliptyny. Rifampina nie wpływała na hamowanie aktywności dipeptydylopeptydazy-4 (DPP4) w 24-godzinnym odstępie między dawkami. Dlatego nie jest zalecane dostosowanie dawki produktu Onglyza. [Widzieć Farmakologia kliniczna, Farmakokinetyka.]
Inhibitory enzymów CYP3A4 / 5
Umiarkowane inhibitory CYP3A4 / 5
Diltiazem zwiększał ekspozycję na saksagliptynę. Podobne zwiększenie stężenia saksagliptyny w osoczu jest oczekiwane w obecności innych umiarkowanych CYP3A4 / 5 inhibitory (np. amprenawir, aprepitant, erytromycyna, flukonazol, fosamprenawir, sok grejpfrutowy i werapamil); jednak nie jest zalecane dostosowanie dawki produktu Onglyza. [Widzieć Farmakologia kliniczna, Farmakokinetyka.]
Silne inhibitory CYP3A4 / 5
Ketokonazol znacznie zwiększał ekspozycję na saksagliptynę. Podobne znaczące zwiększenie stężenia saksagliptyny w osoczu jest oczekiwane w przypadku innych silnych inhibitorów CYP3A4 / 5 (np. atazanawir, klarytromycyna, indynawir, itrakonazol, nefazodon, nelfinawir, rytonawir, sakwinawir i telitromycyna). Dawka produktu Onglyza powinna być ograniczona do 2,5 mg w przypadku jednoczesnego podawania z silnym inhibitorem CYP3A4 / 5. [Widzieć Dawkowanie i sposób podawania, Silne inhibitory CYP3A4 / 5 i Farmakologia kliniczna, Farmakokinetyka.]
Top
Użyj w określonych populacjach
Ciąża
Kategoria ciąży B
Brak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania nad rozmnażaniem zwierząt nie zawsze przewidują odpowiedź człowieka, Onglyza, podobnie jak inne leki przeciwcukrzycowe, należy stosować w okresie ciąży tylko wtedy, gdy jest to bezwzględnie konieczne.
Saksagliptyna nie wykazywała działania teratogennego w żadnej badanej dawce, gdy była podawana ciężarnym szczurom i królikom w okresach organogenezy. Niekompletne kostnienie miednicy, forma opóźnienia rozwojowego, wystąpiła u szczurów w dawce 240 mg / kg lub około 1503 i 66-krotna ekspozycja człowieka odpowiednio na saksagliptynę i aktywny metabolit, przy maksymalnej zalecanej dawce dla ludzi (MRHD) wynoszącej 5 mg Toksyczność matczyną i zmniejszoną masę ciała płodu zaobserwowano przy 7986 i 328 razy większej niż ekspozycja u ludzi w MRHD odpowiednio dla saksagliptyny i aktywnego metabolitu. Niewielkie zmiany szkieletowe u królików występowały po dawce toksycznej dla matki wynoszącej 200 mg / kg lub około 1432 i 992 razy większej niż MRHD. Po podaniu szczurom w skojarzeniu z metforminą saksagliptyna nie wykazywała działania teratogennego ani zarodkowego przy ekspozycji 21 razy większej niż saksagliptyna MRHD. Podawanie skojarzone metforminy z większą dawką saksagliptyny (109 razy większej niż saksagliptyna MRHD) było związane z craniorachischisis (rzadki defekt cewy nerwowej charakteryzujący się niepełnym zamknięciem czaszki i kręgosłupa) u dwóch płodów pojedyncza tama. Ekspozycja na metforminę w każdej kombinacji była czterokrotnie większa niż ekspozycja człowieka 2000 mg na dobę.
Saksagliptyna podawana samicom szczurów od 6 dnia ciąży do 20 dnia laktacji spowodowała zmniejszenie masy ciała u samców i potomstwo samicy tylko w dawkach toksycznych dla matek (narażenie 1629 i 53 razy saksagliptyna i jej aktywny metabolit w MRHD). Nie zaobserwowano działania ani toksyczności behawioralnej u potomstwa szczurów, którym podano saksagliptynę w dowolnej dawce.
Saksagliptyna przenika przez łożysko do płodu po dawkowaniu ciężarnym szczurom.
Matki karmiące
Saksagliptyna jest wydzielana do mleka szczurów w okresie laktacji w stosunku około 1: 1 ze stężeniami leku w osoczu. Nie wiadomo, czy saksagliptyna przenika do mleka ludzkiego. Ponieważ wiele leków jest wydzielanych do mleka ludzkiego, należy zachować ostrożność podczas podawania produktu Onglyza kobiecie karmiącej.
Zastosowanie pediatryczne
Bezpieczeństwo i skuteczność produktu Onglyza u dzieci nie zostały ustalone.
Zastosowanie geriatryczne
W sześciu podwójnie zaślepionych, kontrolowanych badaniach klinicznych dotyczących bezpieczeństwa i skuteczności produktu Onglyza, 634 (15,3%) z 4148 zrandomizowanych pacjentów miało 65 lat i więcej, a 59 (1,4%) pacjentów miało 75 lat i więcej. Nie zaobserwowano ogólnych różnic w zakresie bezpieczeństwa ani skuteczności między pacjentami w wieku 65 lat a młodszymi pacjentami. Chociaż to doświadczenie kliniczne nie wykazało różnic w odpowiedziach między starszymi i młodszymi pacjentami, nie można wykluczyć większej wrażliwości niektórych starszych osób.
Saksagliptyna i jej aktywny metabolit są częściowo wydalane przez nerki. Ponieważ u pacjentów w podeszłym wieku istnieje większe prawdopodobieństwo pogorszenia czynności nerek, należy zachować ostrożność przy doborze dawki u osób starszych w zależności od czynności nerek. [Widzieć Dawkowanie i sposób podawania, Pacjenci z zaburzeniami czynności nerek i Farmakologia kliniczna, Farmakokinetyka.]
Top
Przedawkowanie
W kontrolowanym badaniu klinicznym, raz na dobę, doustnie podawany lek Onglyza zdrowym ochotnikom w dawkach do 400 mg na dobę przez 2 tygodnie (80-krotność MRHD) nie wykazywało klinicznych działań niepożądanych zależnych od dawki i nie miało znaczącego klinicznie wpływu na odstęp QTc lub serce oceniać.
W przypadku przedawkowania należy rozpocząć odpowiednie leczenie podtrzymujące, zależnie od stanu klinicznego pacjenta. Saksagliptyna i jej aktywny metabolit są usuwane przez hemodializę (23% dawki w ciągu 4 godzin).
Top
Opis
Saksagliptyna jest doustnie aktywnym inhibitorem enzymu DPP4.
Monohydrat saksagliptyny jest chemicznie opisany jako (1S, 3S, 5S) -2 - [(2S) -2-amino-2- (3-hydroksytricyklo [3.3.1.13,7] dec-1-ylo) acetylo] -2-azabicyklo [3.1.0] heksano-3-karbonitryl, monohydrat lub (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2 - (3 - hydroksyadamantan - 1 - ylo) acetylo] - 2 - azabicyklo [3.1.0] heksan - 3 - karbonitryl hydrat. Wzór empiryczny to C.18H.25N.3O2-H2O, a masa cząsteczkowa wynosi 333,43. Wzór strukturalny jest następujący:
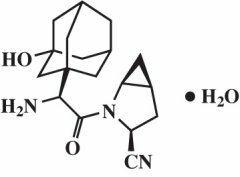
Monohydrat saksagliptyny jest białym, jasnożółtym lub jasnobrązowym, niehigroskopijnym, krystalicznym proszkiem. Jest trudno rozpuszczalny w wodzie o temperaturze 24 ° C ± 3 ° C, słabo rozpuszczalny w octanie etylu i rozpuszczalny w metanolu, etanolu, alkoholu izopropylowym, acetonitrylu, acetonie i glikolu polietylenowym 400 (PEG 400).
Każda tabletka powlekana leku Onglyza do podawania doustnego zawiera 2,79 mg saksagliptyny chlorowodorku (bezwodnego), co odpowiada 2,5 mg saksagliptyny lub 5,58 mg saksagliptyny chlorowodorek (bezwodny) odpowiadający 5 mg saksagliptyny i następujące nieaktywne składniki: laktoza jednowodna, celuloza mikrokrystaliczna, kroskarmeloza sodowa i stearynian magnezu. Ponadto powłoczka zawiera następujące nieaktywne składniki: alkohol poliwinylowy, glikol polietylenowy, dwutlenek tytanu, talk i tlenki żelaza.
Top
Farmakologia kliniczna
Mechanizm akcji
Zwiększone stężenie hormonów inkretynowych, takich jak peptyd glukagonopodobny-1 (GLP-1) i zależne od glukozy polipeptyd insulinotropowy (GIP) jest uwalniany do krwioobiegu z jelita cienkiego w odpowiedzi na posiłki. Hormony te powodują uwalnianie insuliny z trzustkowych komórek beta w sposób zależny od glukozy, ale są inaktywowane przez enzym dipeptydylopeptydazę-4 (DPP4) w ciągu kilku minut. GLP-1 obniża również wydzielanie glukagonu z komórek alfa trzustki, zmniejszając wytwarzanie glukozy w wątrobie. U pacjentów z cukrzycą typu 2 stężenie GLP-1 jest zmniejszone, ale odpowiedź insuliny na GLP-1 zostaje zachowana. Saksagliptyna jest konkurencyjnym inhibitorem DPP4, który spowalnia inaktywację hormonów inkretyny, tym samym zwiększając ich ukrwienie stężenia i zmniejszanie stężenia glukozy na czczo i po posiłku w sposób zależny od glukozy u pacjentów z cukrzycą typu 2 melitus.
Farmakodynamika
U pacjentów z cukrzycą typu 2 podawanie produktu Onglyza hamuje aktywność enzymu DPP4 przez 24 godziny. Po doustnym obciążeniu glukozą lub posiłku, to hamowanie DPP4 spowodowało 2- do 3-krotny wzrost poziomu aktywnych składników w krążeniu GLP-1 i GIP, zmniejszały stężenie glukagonu i zwiększały zależne od glukozy wydzielanie insuliny z komórek beta trzustki. Wzrost insuliny i spadek glukagonu były związane z niższymi stężeniami glukozy na czczo i zmniejszonym skokiem glukozy po doustnym obciążeniu glukozą lub posiłku.
Elektrofizjologia serca
W randomizowanym, podwójnie zaślepionym, kontrolowanym placebo, czterokierunkowym crossover, aktywnym badaniu porównawczym z użyciem moksyfloksacyny u 40 zdrowych osób, Onglyza nie była związana z klinicznie znaczącym wydłużeniem odstępu QTc lub częstości akcji serca w dawkach dziennych do 40 mg (8-krotność MRHD).
Farmakokinetyka
Farmakokinetyka saksagliptyny i jej aktywnego metabolitu 5-hydroksysaksagliptyny była podobna u zdrowych osób i pacjentów z cukrzycą typu 2. C.max a wartości AUC saksagliptyny i jej aktywnego metabolitu wzrosły proporcjonalnie w zakresie dawek od 2,5 do 400 mg. Po doustnym podaniu pojedynczej dawki 5 mg saksagliptyny zdrowym osobom, średnie wartości AUC w osoczu dla saksagliptyny i jej aktywnego metabolitu wyniosły odpowiednio 78 ng-h / ml i 214 ng-h / ml. Odpowiednie osocze Cmax wartości wynosiły odpowiednio 24 ng / ml i 47 ng / ml. Średnia zmienność (% CV) dla AUC i Cmax zarówno dla saksagliptyny, jak i jej aktywnego metabolitu, było mniejsze niż 25%.
Nie obserwowano znacznego kumulacji ani saksagliptyny, ani jej aktywnego metabolitu po wielokrotnym dawkowaniu raz na dobę przy dowolnym poziomie dawki. Nie obserwowano zależności dawki i czasu w klirensie saksagliptyny i jej aktywnego metabolitu przez 14 dni dawkowania raz dziennie saksagliptyny w dawkach od 2,5 do 400 mg.
Wchłanianie
Mediana czasu do maksymalnego stężenia (Tmax) po podaniu dawki 5 mg raz na dobę wynosiło 2 godziny dla saksagliptyny i 4 godziny dla jej aktywnego metabolitu. Podawanie z posiłkiem wysokotłuszczowym spowodowało wzrost Tmax saksagliptyny o około 20 minut w porównaniu do warunków na czczo. Stwierdzono 27% wzrost wartości AUC saksagliptyny podawanej z posiłkiem w porównaniu do warunków na czczo. Lek Onglyza można podawać niezależnie od posiłków.
Dystrybucja
Wiązanie saksagliptyny i jej aktywnego metabolitu w surowicy ludzkiej in vitro jest nieznaczne. Dlatego nie oczekuje się, aby zmiany poziomów białka we krwi w różnych stanach chorobowych (np. Zaburzenia czynności nerek lub wątroby) wpływały na zmianę saksagliptyny.
Metabolizm
W metabolizmie saksagliptyny pośredniczy przede wszystkim cytochrom P450 3A4 / 5 (CYP3A4 / 5). Głównym metabolitem saksagliptyny jest także inhibitor DPP4, który jest o połowę silniejszy niż saksagliptyna. Dlatego silne inhibitory CYP3A4 / 5 i induktory zmienią farmakokinetykę saksagliptyny i jej aktywnego metabolitu. [Widzieć Interakcje z lekami.]
Wydalanie
Saksagliptyna jest wydalana zarówno przez nerki, jak i wątrobę. Po pojedynczej dawce 50 mg 14C-saksagliptyna, 24%, 36% i 75% dawki była wydalana z moczem w postaci odpowiednio saksagliptyny, jej aktywnego metabolitu i całkowitej radioaktywności. Średni klirens nerkowy saksagliptyny (~ 230 ml / min) był większy niż średni szacowany współczynnik filtracji kłębuszkowej (~ 120 ml / min), co sugeruje pewne aktywne wydalanie przez nerki. W sumie 22% podanej radioaktywności zostało wydalone z kałem reprezentującym część dawki saksagliptyny wydalanej z żółcią i (lub) niewchłoniętym lekiem z przewodu pokarmowego. Po podaniu pojedynczej dawki doustnej produktu Onglyza 5 mg zdrowym osobom średni końcowy okres półtrwania w osoczu (t1/2) dla saksagliptyny i jej aktywnego metabolitu wynosiło odpowiednio 2,5 i 3,1 godziny.
Określone populacje
Zaburzenia czynności nerek
Przeprowadzono otwarte badanie z pojedynczą dawką w celu oceny farmakokinetyki saksagliptyny (dawka 10 mg) w osoby z różnym stopniem przewlekłej niewydolności nerek (N = 8 na grupę) w porównaniu z osobami z prawidłową nerką funkcjonować. Badaniem objęto pacjentów z zaburzeniami czynności nerek sklasyfikowanych na podstawie klirensu kreatyniny jako łagodny (> 50–80 ¤80). ml / min), umiarkowane (od 30 do ¤ mL50 ml / min) i ciężkie (<30 ml / min), a także pacjenci ze schyłkową niewydolnością nerek na hemodializa. Klirens kreatyniny oszacowano na podstawie stężenia kreatyniny w surowicy na podstawie wzoru Cockcroft-Gault:
CrCl = [140 â ˆ ‚wiek (lata)] × waga (kg) {à 0,85 dla pacjentek}
[72 Ã- kreatynina w surowicy (mg / dL)]
Stopień niewydolności nerek nie wpływał na Cmax saksagliptyny lub jej aktywnego metabolitu. U pacjentów z łagodnymi zaburzeniami czynności nerek wartości AUC saksagliptyny i jej aktywnego metabolitu były odpowiednio o 20% i 70% wyższe niż wartości AUC u osób z prawidłową czynnością nerek. Ponieważ zwiększenie tej wielkości nie jest uważane za klinicznie istotne, nie zaleca się dostosowywania dawki u pacjentów z łagodnymi zaburzeniami czynności nerek. U pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek wartości AUC saksagliptyny i jej substancji czynnej metabolity były odpowiednio do 2,1- i 4,5-krotnie wyższe niż wartości AUC u osób z prawidłową czynnością nerek funkcjonować. Aby uzyskać ekspozycję na saksagliptynę i jej aktywny metabolit w osoczu podobną do ekspozycji u pacjentów z prawidłową czynnością nerek, zalecana dawka wynosi 2,5 mg raz na dobę u pacjentów z umiarkowanymi i ciężkimi zaburzeniami czynności nerek, a także u pacjentów ze schyłkową niewydolnością nerek wymagającą hemodializa. Saksagliptyna jest usuwana przez hemodializę.
Zaburzenia czynności wątroby
U osób z zaburzeniami czynności wątroby (klasy A, B i C w skali Childa-Pugha) średnia Cmax i AUC saksagliptyny były odpowiednio do 8% i 77% wyższe w porównaniu ze zdrowymi dobranymi kontrolami po podaniu pojedynczej dawki 10 mg saksagliptyny. Odpowiedni Cmax i AUC aktywnego metabolitu były odpowiednio do 59% i 33% niższe w porównaniu ze zdrowymi dobranymi kontrolami. Różnice te nie są uważane za istotne klinicznie. Nie zaleca się dostosowywania dawki u pacjentów z zaburzeniami czynności wątroby.
Wskaźnik masy ciała
Nie zaleca się dostosowywania dawki w oparciu o wskaźnik masy ciała (BMI), który nie został określony jako istotny zmienne dotyczące pozornego klirensu saksagliptyny lub jej aktywnego metabolitu w farmakokinetyce populacyjnej analiza.
Płeć
Nie zaleca się dostosowywania dawki w zależności od płci. Nie zaobserwowano różnic w farmakokinetyce saksagliptyny między mężczyznami i kobietami. W porównaniu z mężczyznami kobiety miały o około 25% wyższe wartości ekspozycji na aktywny metabolit niż mężczyźni, ale jest mało prawdopodobne, aby ta różnica miała znaczenie kliniczne. Płeć nie została zidentyfikowana jako znacząca zmienna pozorna klirensu saksagliptyny i jej aktywnego metabolitu w populacyjnej analizie farmakokinetycznej.
Geriatryczny
Nie zaleca się dostosowywania dawki na podstawie samego wieku. Osoby w podeszłym wieku (65-80 lat) miały średnią geometryczną C o 23% i 59%max i średnie geometryczne wartości AUC odpowiednio dla saksagliptyny niż u młodych osób (18-40 lat). Różnice w farmakokinetyce aktywnego metabolitu między osobami w podeszłym wieku i młodymi ogólnie odzwierciedlały różnice obserwowane w farmakokinetyce saksagliptyny. Różnica między farmakokinetyką saksagliptyny i aktywnego metabolitu u młodych i starszych osób u pacjentów prawdopodobnie występuje wiele czynników, w tym pogorszenie czynności nerek i zdolność metaboliczna rosnący wiek. Wiek nie został zidentyfikowany jako znacząca zmienna pozornego klirensu saksagliptyny i jej aktywnego metabolitu w populacyjnej analizie farmakokinetycznej
Pediatryczny
Nie przeprowadzono badań charakteryzujących farmakokinetykę saksagliptyny u dzieci.
Rasa i pochodzenie etniczne
Nie zaleca się dostosowywania dawki w zależności od rasy. W analizie farmakokinetyki populacyjnej porównano farmakokinetykę saksagliptyny i jej substancji czynnej metabolit u 309 osób rasy białej, 105 osób rasy innej niż rasy białej (składających się z sześciu ras grupy). Nie stwierdzono istotnych różnic w farmakokinetyce saksagliptyny i jej aktywnego metabolitu między tymi dwiema populacjami.
Interakcje między lekami
Ocena interakcji leków w warunkach in vitro
W metabolizmie saksagliptyny pośredniczy przede wszystkim CYP3A4 / 5.
W badaniach in vitro saksagliptyna i jej aktywny metabolit nie hamowały CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 lub 3A4 ani nie indukowały CYP1A2, 2B6, 2C9 ani 3A4. Dlatego saksagliptyna nie powinna zmieniać klirensu metabolicznego jednocześnie podawanych leków metabolizowanych przez te enzymy. Saksagliptyna jest substratem glikoproteiny P (P-gp), ale nie jest znaczącym inhibitorem ani induktorem P-gp.
Wiązanie saksagliptyny i jej aktywnego metabolitu w surowicy ludzkiej in vitro jest nieznaczne. Zatem wiązanie z białkami nie miałoby znaczącego wpływu na farmakokinetykę saksagliptyny lub innych leków.
Ocena interakcji leków in vivo
Wpływ Saksagliptyny na inne leki
W badaniach przeprowadzonych na zdrowych ochotnikach, jak opisano poniżej, saksagliptyna nie zmieniała znacząco farmakokinetyka metforminy, gliburydu, pioglitazonu, digoksyny, symwastatyny, diltiazemu lub ketokonazolu.
Metformina: Podanie pojedynczej dawki saksagliptyny (100 mg) i metforminy (1000 mg), substratu hOCT-2, nie wpłynęło na farmakokinetykę metforminy u zdrowych osób. Dlatego Onglyza nie jest inhibitorem transportu za pośrednictwem hOCT-2.
Gliburyd: Podanie pojedynczej dawki saksagliptyny (10 mg) i gliburydu (5 mg), substratu CYP2C9, spowodowało zwiększenie C w osoczumax gliburydu o 16%; jednak AUC gliburydu pozostało niezmienione. Dlatego Onglyza nie hamuje w sposób znaczący metabolizmu pośredniczonego przez CYP2C9.
Pioglitazon: Podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i pioglitazonu (45 mg), substratu CYP2C8, zwiększało stężenie C w osoczumax pioglitazonu o 14%; jednak wartość AUC pioglitazonu nie uległa zmianie.
Digoksyna: Jednoczesne podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i digoksyny (0,25 mg), substratu P-gp, nie zmieniało farmakokinetyki digoksyny. Dlatego Onglyza nie jest inhibitorem ani induktorem transportu za pośrednictwem P-gp.
Symwastatyna: Jednoczesne podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i symwastatyny (40 mg), substratu CYP3A4 / 5, nie zmieniało farmakokinetyki symwastatyny. Dlatego Onglyza nie jest inhibitorem ani induktorem metabolizmu pośredniczonego przez CYP3A4 / 5.
Diltiazem: jednoczesne podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i diltiazemu (preparat długo działający 360 mg w stanie stacjonarnym), umiarkowany inhibitor CYP3A4 / 5, zwiększał stężenie C w osoczumax diltiazemu o 16%; jednak AUC diltiazemu pozostało niezmienione.
Ketokonazol: Jednoczesne podawanie pojedynczej dawki saksagliptyny (100 mg) i wielu dawek ketokonazolu (200 mg co 12 godzin w stan stacjonarny), silny inhibitor CYP3A4 / 5 i P-gp, zmniejszał Cmax i AUC w osoczu ketokonazolu o 16% i 13%, odpowiednio.
Wpływ innych leków na sagagliptynę
Metformina: Podanie pojedynczej dawki saksagliptyny (100 mg) i metforminy (1000 mg), substratu hOCT-2, obniżyło Cmax saksagliptyny o 21%; jednak AUC pozostało niezmienione.
Gliburyd: Podanie pojedynczej dawki saksagliptyny (10 mg) i gliburydu (5 mg), substratu CYP2C9, zwiększyło Cmax saksagliptyny o 8%; jednak wartość AUC saksagliptyny nie uległa zmianie.
Pioglitazon: Podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i pioglitazonu (45 mg), substrat CYP2C8 (główny) i CYP3A4 (mniejszy), nie zmieniał farmakokinetyki saksagliptyna.
Digoksyna: Jednoczesne podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i digoksyny (0,25 mg), substratu P-gp, nie zmieniało farmakokinetyki saksagliptyny.
Symwastatyna: Jednoczesne podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i symwastatyny (40 mg), substratu CYP3A4 / 5, zwiększało Cmax saksagliptyny o 21%; jednak wartość AUC saksagliptyny nie uległa zmianie.
Diltiazem: Podanie pojedynczej dawki saksagliptyny (10 mg) i diltiazemu (preparat długo działający 360 mg w stanie stacjonarnym), umiarkowany inhibitor CYP3A4 / 5, zwiększał Cmax saksagliptyny o 63%, a AUC 2,1-krotnie. Było to związane z odpowiednim spadkiem Cmax i AUC aktywnego metabolitu odpowiednio o 44% i 36%.
Ketokonazol: Jednoczesne podanie pojedynczej dawki saksagliptyny (100 mg) i ketokonazolu (200 mg co 12 godzin w stanie stacjonarnym), silnego inhibitora CYP3A4 / 5 i P-gp, zwiększało Cmax dla saksagliptyny o 62% i AUC 2,5-krotnie. Było to związane z odpowiednim spadkiem Cmax i AUC aktywnego metabolitu odpowiednio o 95% i 91%.
W innym badaniu jednoczesne podanie pojedynczej dawki saksagliptyny (20 mg) i ketokonazolu (200 mg co 12 godzin w stanie stacjonarnym) spowodowało zwiększenie Cmax i AUC saksagliptyny odpowiednio 2,4-krotnie i 3,7-krotnie. Było to związane z odpowiednim spadkiem Cmax i AUC aktywnego metabolitu odpowiednio o 96% i 90%.
Ryfampina: Jednoczesne podanie pojedynczej dawki saksagliptyny (5 mg) i rifampiny (600 mg QD w stanie stacjonarnym) obniżyło Cmax i AUC saksagliptyny odpowiednio o 53% i 76%, z odpowiednim wzrostem Cmaxmax (39%), ale nie ma znaczącej zmiany w AUC aktywnego metabolitu w osoczu.
Omeprazol: Jednoczesne podawanie wielokrotnych dawek saksagliptyny raz na dobę (10 mg) i omeprazolu (40 mg), CYP2C19 (główny) i substrat CYP3A4, inhibitor CYP2C19 i induktor MRP-3, nie zmieniają farmakokinetyki saksagliptyna.
Wodorotlenek glinu + wodorotlenek magnezu + symetikon: Podanie pojedynczej dawki saksagliptyny (10 mg) i ciecz zawierająca wodorotlenek glinu (2400 mg), wodorotlenek magnezu (2400 mg) i symetikon (240 mg) obniżały Cmax saksagliptyny o 26%; jednak wartość AUC saksagliptyny nie uległa zmianie.
Famotydyna: Podanie pojedynczej dawki saksagliptyny (10 mg) 3 godziny po pojedynczej dawce famotydyny (40 mg), inhibitora hOCT-1, hOCT-2 i hOCT-3, zwiększyło Cmax saksagliptyny o 14%; jednak wartość AUC saksagliptyny nie uległa zmianie.
Top
Toksykologia niekliniczna
Rakotwórczość, mutageneza, upośledzenie płodności
Saksagliptyna nie indukowała nowotworów u myszy (50, 250 i 600 mg / kg) ani u szczurów (25, 75, 150 i 300 mg / kg) przy najwyższych ocenianych dawkach. Najwyższe dawki ocenione u myszy były równoważne około 870 (samcom) i 1165 (samicom) razy ekspozycji ludzkiej przy MRHD wynoszącej 5 mg / dzień. U szczurów ekspozycja wynosiła około 355 (samce) i 2217 (samice) razy więcej niż MRHD.
Saksagliptyna nie była mutagenna ani klastogenna z aktywacją metaboliczną lub bez aktywacji w teście bakteryjnym Ames in vitro, teście cytogenetycznym in vitro u pierwotnego człowieka limfocyty, doustny test mikrojądrowy in vivo u szczurów, doustne badanie naprawy DNA in vivo u szczurów oraz doustne badanie cytogenetyczne in vivo / in vitro we krwi obwodowej szczura limfocyty Aktywny metabolit nie wykazywał działania mutagennego w teście bakteryjnym Amesa in vitro.
W badaniu płodności szczurów samce leczono doustnymi dawkami zgłębnikowymi przez 2 tygodnie przed kryciem, podczas krycia i do zaplanowanego zakończenie (łącznie około 4 tygodni) i samice leczono doustnymi dawkami zgłębnikowymi przez 2 tygodnie przed kryciem przez ciążę dzień 7. Nie zaobserwowano niekorzystnego wpływu na płodność przy ekspozycji wynoszącej około 603 (mężczyźni) i 776 (kobiety) razy więcej niż MRHD. Wyższe dawki, które wywoływały toksyczność u matek, również zwiększały resorpcje płodu (około 2069 i 6138 razy więcej niż MRHD). Dodatkowy wpływ na cyklinę rujową, płodność, owulację i implantację zaobserwowano przy około 6138-krotności MRHD.
Toksykologia Zwierząt
Saksagliptyna powodowała niepożądane zmiany skórne w kończynach małp cynomolgus (strup i / lub owrzodzenie ogona, palców, moszny i / lub nosa). Zmiany skórne były odwracalne przy 20-krotnej wartości MRHD, ale w niektórych przypadkach były nieodwracalne i nekrotyzowały przy wyższych ekspozycjach. Nie zaobserwowano niekorzystnych zmian skórnych przy ekspozycji podobnej do (1 do 3 razy) MRHD wynoszącej 5 mg. W badaniach klinicznych saksagliptyny na ludziach nie obserwowano korelacji klinicznych ze zmianami skórnymi u małp.
Top
Studia kliniczne
Lek Onglyza badano w monoterapii oraz w skojarzeniu z terapią metforminą, gliburydem i tiazolidynodionem (pioglitazon i rozyglitazon). Lek Onglyza nie był badany w połączeniu z insuliną.
Ogółem 4148 pacjentów z cukrzycą typu 2 zostało zrandomizowanych w sześciu podwójnie zaślepionych, kontrolowanych badaniach klinicznych przeprowadzonych w celu oceny bezpieczeństwa i skuteczności glikemicznej produktu Onglyza. W tych badaniach łącznie 3021 pacjentów było leczonych produktem Onglyza. W tych badaniach średni wiek wynosił 54 lata, a 71% pacjentów było rasy białej, 16% było pochodzenia azjatyckiego, 4% było rasy czarnej, a 9% należało do innych grup rasowych. Dodatkowych 423 pacjentów, w tym 315, którzy otrzymywali lek Onglyza, uczestniczyło w kontrolowanym placebo badaniu obejmującym podawanie dawek trwającym od 6 do 12 tygodni.
W tych sześciu badaniach z podwójnie ślepą próbą Onglyza oceniano przy dawkach 2,5 mg i 5 mg raz na dobę. W trzech z tych badań oceniano także dawkę saksagliptyny 10 mg na dobę. Dzienna dawka saksagliptyny wynosząca 10 mg nie zapewniała większej skuteczności niż dawka dobowa 5 mg. Leczenie produktem Onglyza we wszystkich dawkach powodowało klinicznie istotną i statystycznie istotną poprawę hemoglobiny A1c (A1C), glukoza w osoczu na czczo (FPG) i 2-godzinna glikemia poposiłkowa (PPG) po standardowym doustnym teście tolerancji glukozy (OGTT), w porównaniu do kontrola. Zmniejszenie poziomu HbA1c obserwowano we wszystkich podgrupach, w tym płci, wieku, rasy i wyjściowego BMI.
Lek Onglyza nie był związany ze znaczącymi zmianami w stosunku do wartości początkowej masy ciała ani lipidów w surowicy na czczo w porównaniu z placebo.
Monoterapia
Łącznie 766 pacjentów z cukrzycą typu 2 niedostatecznie kontrolowanych pod względem diety i wysiłku fizycznego (HbA 1–7% do 10%) uczestniczył w dwóch 24-tygodniowych, podwójnie zaślepionych, kontrolowanych placebo badaniach oceniających skuteczność i bezpieczeństwo produktu Onglyza monoterapia.
W pierwszym badaniu, po dwutygodniowej diecie, ćwiczeniach i wprowadzeniu placebo, 401 pacjentów zostało losowo przydzielonych do grupy otrzymującej 2,5 mg, 5 mg lub 10 mg produktu Onglyza lub placebo. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badania, zostali poddani terapii ratunkowej metforminą, dodanej do placebo lub Onglyza. Skuteczność oceniano na ostatnim pomiarze przed terapią ratunkową u pacjentów wymagających ratowania. Dostosowywanie dawki produktu Onglyza nie było dozwolone.
Leczenie produktem Onglyza w dawce 2,5 mg i 5 mg na dobę zapewniło znaczną poprawę w zakresie A1C, FPG i PPG w porównaniu z placebo (Tabela 3). Odsetek pacjentów, którzy przerwali leczenie z powodu braku kontroli glikemii lub którzy zostali uratowani na spotkanie, został wcześniej określony kryteria glikemiczne wynosiły 16% w grupie leczonej produktem Onglyza 2,5 mg, 20% w grupie leczonej produktem Onglyza 5 mg i 26% w grupie otrzymującej grupa placebo.
Tabela 3: Parametry glikemiczne w 24. tygodniu w kontrolowanym placebo badaniu Onglyza Monoterapia u pacjentów z cukrzycą typu 2 *
| Parametr skuteczności | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Populacja zgodna z leczeniem, wykorzystująca ostatnią obserwację podczas badania lub ostatnią obserwację przed terapią ratunkową metforminą dla pacjentów wymagających ratowania. | |||
| †Średnia najmniejszych kwadratów skorygowana o wartość początkową. | |||
| do Wartość p <0,0001 w porównaniu z placebo | |||
| § Wartość p <0,05 w porównaniu z placebo | |||
| ¶ Istotności nie zbadano dla 2-godzinnego PPG dla dawki 2,5 mg produktu Onglyza. | |||
| Hemoglobina a1c (%) | N = 100 | N = 103 | N = 92 |
| Wartość początkowa (średnia) | 7.9 | 8.0 | 7.9 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −0.4 | −0.5 | +0.2 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −0.6do | −0.6do | |
| 95% przedział ufności | (−0.9, −0.3) | (−0.9, −0.4) | |
| Odsetek pacjentów osiągających HbA1c <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Glukoza w osoczu na czczo (mg / dL) | N = 101 | N = 105 | N = 92 |
| Wartość początkowa (średnia) | 178 | 171 | 172 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −15 | −9 | +6 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −21 § | −15 § | |
| 95% przedział ufności | (−31, −10) | (−25, −4) | |
| 2-godzinna glukoza poposiłkowa (mg / dl) | N = 78 | N = 84 | N = 71 |
| Wartość początkowa (średnia) | 279 | 278 | 283 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −45 | −43 | −6 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −39 ¶ | −37 § | |
| 95% przedział ufności | (−61, −16) | (−59, −15) |
Drugie 24-tygodniowe badanie monoterapii przeprowadzono w celu oceny zakresu schematów dawkowania produktu Onglyza. Nieleczeni wcześniej pacjenci z niedostatecznie kontrolowaną cukrzycą (HbA 1–7% do 10%) przeszli dwutygodniową, pojedynczo ślepą dietę, ćwiczenia i okres wstępny placebo. W sumie 365 pacjentów przydzielono losowo do 2,5 mg każdego ranka, 5 mg każdego ranka, 2,5 mg z możliwym dostosowaniem do 5 mg każdego ranka lub 5 mg każdego wieczoru produktu Onglyza lub placebo. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badania, byli leczeni terapią ratunkową metforminą dodaną do placebo lub Onglyza; liczba pacjentów zrandomizowanych do grupy leczenia wahała się od 71 do 74.
Leczenie albo Onglyza 5 mg każdego ranka, albo 5 mg każdego wieczoru zapewniło znaczną poprawę w zakresie HbA1c w porównaniu z placebo (średnie skorygowane placebo odpowiednio o 0,4% i 0,3%). Leczenie produktem Onglyza w dawce 2,5 mg każdego ranka również zapewniało znaczną poprawę wartości HbA1c w porównaniu z placebo (średnie skorygowane o placebo zmniejszenie o 0,4%).
Terapia skojarzona
Terapia skojarzona z metforminą
W tym 24-tygodniowym, randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu wzięło udział łącznie 743 pacjentów z cukrzycą typu 2 w celu oceny skuteczność i bezpieczeństwo produktu Onglyza w skojarzeniu z metforminą u pacjentów z niewystarczającą kontrolą glikemii (A1C - 7% i - 10%) na metforminie sam. Aby zakwalifikować się do włączenia, pacjenci musieli przyjmować stałą dawkę metforminy (1500-2550 mg na dobę) przez co najmniej 8 tygodni.
Pacjenci, którzy spełnili kryteria kwalifikacyjne, zostali włączeni do grupy prowadzącej dla pojedynczej ślepej, 2-tygodniowej diety i ćwiczeń wprowadzających placebo okres, podczas którego pacjenci otrzymywali metforminę w dawce przed badaniem, do 2500 mg na dobę, przez czas trwania nauka. Po okresie wstępnym kwalifikujący się pacjenci zostali losowo przydzieleni do 2,5 mg, 5 mg lub 10 mg produktu Onglyza lub placebo oprócz obecnej dawki otwartej metforminy. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badania, byli leczeni terapią ratunkową pioglitazonem, uzupełnioną o istniejące leki badane. Dostosowywanie dawki produktu Onglyza i metforminy nie było dozwolone.
Dodatek Onglyza w dawce 2,5 mg i 5 mg do meforminy zapewnił znaczącą poprawę w zakresie A1C, FPG i PPG w porównaniu z dodatkiem placebo do metforminy (Tabela 4). Średnie zmiany w stosunku do wartości wyjściowej dla A1C w czasie i w punkcie końcowym pokazano na rycinie 1. Odsetek pacjentów, którzy przerwali leczenie z powodu braku kontroli glikemii lub którzy zostali uratowani za spełnienie określonych wcześniej kryteriów glikemii wynosi 15% w dodatku Onglyza 2,5 mg w grupie metforminy, 13% w dodatku Onglyza 5 mg w grupie metforminy i 27% w grupie placebo w stosunku do metforminy Grupa.
Tabela 4: Parametry glikemiczne w 24. tygodniu w kontrolowanym placebo badaniu produktu Onglyza jako terapii skojarzonej z metforminą *
| Parametr skuteczności | Onglyza 2,5 mg + Metformina N = 192 |
Onglyza 5 mg + Metformina N = 191 |
Placebo + Metformina N = 179 |
|---|---|---|---|
| * Populacja zgodna z leczeniem, wykorzystująca ostatnią obserwację podczas badania lub ostatnią obserwację przed terapią ratunkową pioglitazonem u pacjentów wymagających ratowania. | |||
| †Średnia najmniejszych kwadratów skorygowana o wartość początkową. | |||
| do Wartość p <0,0001 w porównaniu z placebo + metforminą | |||
| § Wartość p <0,05 w porównaniu z placebo + metforminą | |||
| Hemoglobina a1c (%) | N = 186 | N = 186 | N = 175 |
| Wartość początkowa (średnia) | 8.1 | 8.1 | 8.1 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −0.6 | −0.7 | +0.1 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −0.7do | −0.8do | |
| 95% przedział ufności | (−0.9, −0.5) | (−1.0, −0.6) | |
| Odsetek pacjentów osiągających HbA1c <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Glukoza w osoczu na czczo (mg / dL) | N = 188 | N = 187 | N = 176 |
| Wartość początkowa (średnia) | 174 | 179 | 175 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −14 | −22 | +1 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −16 § | −23 § | |
| 95% przedział ufności | (−23, −9) | (−30, −16) | |
| 2-godzinna glukoza poposiłkowa (mg / dl) | N = 155 | N = 155 | N = 135 |
| Wartość początkowa (średnia) | 294 | 296 | 295 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −62 | −58 | −18 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −44 § | −40 § | |
| 95% przedział ufności | (−60, −27) | (−56, −24) |
Rycina 1: Średnia zmiana w stosunku do wartości początkowej w HbA1c w kontrolowanym placebo badaniu Onglyza jako terapii skojarzonej z metforminą *
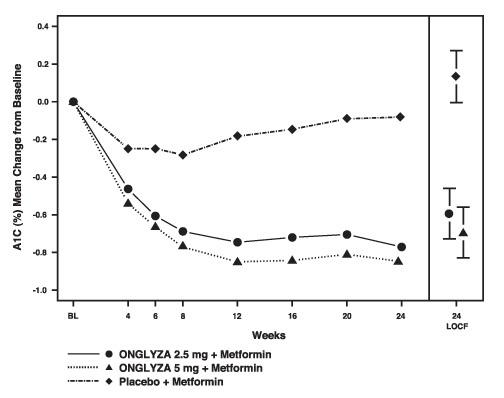
* Obejmuje pacjentów z wartością wyjściową i wartością w 24. tygodniu.
Tydzień 24 (LOCF) obejmuje populację zgodną z leczeniem, z wykorzystaniem ostatniej obserwacji w badaniu przed terapią ratunkową pioglitazonem u pacjentów wymagających ratowania. Średnia zmiana w stosunku do wartości wyjściowej jest dostosowywana do wartości wyjściowej.
Terapia skojarzona z tiazolidynodionem
W tym 24-tygodniowym, randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu wzięło udział ogółem 565 pacjentów z cukrzycą typu 2 w celu oceny skuteczność i bezpieczeństwo produktu Onglyza w skojarzeniu z tiazolidynodionem (TZD) u pacjentów z niedostateczną kontrolą glikemii (A1C - 7% do - 10,5%) Sam TZD. Aby zakwalifikować się do włączenia, pacjenci musieli przyjmować stałą dawkę pioglitazonu (30-45 mg raz na dobę) lub rozyglitazon (4 mg raz na dobę lub 8 mg raz na dobę lub w dwóch dawkach podzielonych 4 mg) przez co najmniej 12 tygodnie
Pacjenci, którzy spełnili kryteria kwalifikacyjne, zostali zakwalifikowani do diety jednoetapowej, dwutygodniowej, diety i ćwiczeń fizycznych okres wprowadzający placebo, podczas którego pacjenci otrzymywali TZD w dawce przed badaniem przez czas trwania nauka. Po okresie wstępnym kwalifikujący się pacjenci zostali losowo przydzieleni do 2,5 mg lub 5 mg produktu Onglyza lub placebo oprócz obecnej dawki TZD. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badania, byli leczeni metforminą ratującą, dodaną do istniejących badanych leków. Podczas badania nie było dozwolone dostosowywanie dawki produktu Onglyza lub TZD. Zmiana schematu TZD z rozyglitazonu na pioglitazon w określonych, równoważnych dawkach terapeutycznych była dozwolona według uznania badacza, jeśli zostanie to uznane za medycznie właściwe.
Dodatek Onglyza w dawce 2,5 mg i 5 mg do TZD zapewnił znaczącą poprawę w zakresie A1C, FPG i PPG w porównaniu z dodatkiem placebo do TZD (Tabela 5). Odsetek pacjentów, którzy przerwali leczenie z powodu braku kontroli glikemii lub którzy zostali uratowani za spełnienie określonych wcześniej kryteriów glikemii wynosił 10% w przypadku dodatku Onglyza 2,5 mg w grupie TZD, 6% w przypadku dodatku Onglyza 5 mg w grupie TZD i 10% w przypadku dodatku placebo do TZD Grupa.
Tabela 5: Parametry glikemiczne w 24. tygodniu w kontrolowanym placebo badaniu produktu Onglyza jako terapii skojarzonej z tiazolidynodionem *
| Parametr skuteczności | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Populacja zgodna z leczeniem, wykorzystująca ostatnią obserwację podczas badania lub ostatnią obserwację przed terapią ratunkową metforminą dla pacjentów wymagających ratowania. | |||
| †Średnia najmniejszych kwadratów skorygowana o wartość początkową. | |||
| do Wartość p <0,0001 w porównaniu z placebo + TZD | |||
| § Wartość p <0,05 w porównaniu z placebo + TZD | |||
| Hemoglobina a1c (%) | N = 192 | N = 183 | N = 180 |
| Wartość początkowa (średnia) | 8.3 | 8.4 | 8.2 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −0.7 | −0.9 | −0.3 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −0.4 § | −0.6do | |
| 95% przedział ufności | (−0.6, −0.2) | (−0.8, −0.4) | |
| Odsetek pacjentów osiągających HbA1c <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Glukoza w osoczu na czczo (mg / dL) | N = 193 | N = 185 | N = 181 |
| Wartość początkowa (średnia) | 163 | 160 | 162 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −14 | −17 | −3 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −12 § | −15 § | |
| 95% przedział ufności | (−20, −3) | (−23, −6) | |
| 2-godzinna glukoza poposiłkowa (mg / dl) | N = 156 | N = 134 | N = 127 |
| Wartość początkowa (średnia) | 296 | 303 | 291 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −55 | −65 | −15 |
| Różnica w stosunku do placebo (skorygowana średnia†) | −40 § | −50 § | |
| 95% przedział ufności | (−56, −24) | (−66, −34) |
Terapia skojarzona z użyciem gliburydu
W tym 24-tygodniowym, randomizowanym, podwójnie zaślepionym, kontrolowanym placebo badaniu wzięło udział łącznie 768 pacjentów z cukrzycą typu 2 w celu oceny skuteczności i bezpieczeństwa preparatu Onglyza w skojarzeniu z pochodną sulfonylomocznika (SU) u pacjentów z niewystarczającą kontrolą glikemii podczas rekrutacji (A1C - 7,5% do - 10%) przy submaksymalnej dawce SU sam. Aby zakwalifikować się do włączenia, pacjenci musieli przyjmować submaksymalną dawkę SU przez 2 miesiące lub dłużej. W tym badaniu lek Onglyza w połączeniu ze stałą, pośrednią dawką SU porównano z dostosowaniem dawki do wyższej dawki SU.
Pacjenci, którzy spełnili kryteria kwalifikacyjne, zostali włączeni do 4-tygodniowego okresu jednokrotnej ślepej próby i po wprowadzeniu do ćwiczeń oraz otrzymywali gliburyd 7,5 mg raz na dobę. Po okresie wstępnym kwalifikujący się pacjenci z HbA 1–7% do 10% zostali zrandomizowani do 2,5 mg lub 5 mg dodatku Onglyza do 7,5 mg gliburydu lub do placebo plus całkowita dawka dobowa 10 mg gliburyd. Pacjenci, którzy otrzymali placebo, mogli zwiększać dawkę gliburydu do całkowitej dawki dobowej 15 mg. Zwiększanie dawki gliburydu nie było dozwolone u pacjentów, którzy otrzymywali Onglyza w dawce 2,5 mg lub 5 mg. Gliburyd może być stopniowo zmniejszany w dowolnej grupie terapeutycznej raz w ciągu 24-tygodniowego okresu badania z powodu hipoglikemii, jeśli badacz uzna to za konieczne. Około 92% pacjentów w grupie placebo plus gliburyd zostało zwiększonych do końcowej całkowitej dawki dobowej 15 mg podczas pierwszych 4 tygodni okresu badania. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badania, byli leczeni metforminą ratującą, dodaną do istniejącego badanego leku. Podczas badania nie było dozwolone dostosowywanie dawki produktu Onglyza.
W połączeniu z gliburydem lek Onglyza w dawce 2,5 mg i 5 mg zapewniał znaczącą poprawę w zakresie A1C, FPG i PPG w porównaniu z grupą placebo i grupą zwiększającą dawkę gliburydu (Tabela 6). Odsetek pacjentów, którzy przerwali leczenie z powodu braku kontroli glikemii lub którzy zostali uratowani za spełnienie określonych wcześniej kryteriów glikemii, wynosił 18% dodatek Onglyza 2,5 mg do grupy gliburydowej, 17% w grupie dodatkowej Onglyza 5 mg do grupy gliburydowej i 30% w grupie placebo plus gliburyd podwyższany Grupa.
Tabela 6: Parametry glikemiczne w 24. tygodniu w kontrolowanym placebo badaniu produktu Onglyza jako terapii skojarzonej z użyciem gliburydu *
| Parametr skuteczności | Onglyza 2,5 mg + Gliburyd 7,5 mg N = 248 |
Onglyza 5 mg + Gliburyd 7,5 mg N = 253 |
Placebo + Zwiększony poziom gliburydu N = 267 |
|---|---|---|---|
| * Populacja zgodna z leczeniem, wykorzystująca ostatnią obserwację podczas badania lub ostatnią obserwację przed terapią ratunkową metforminą dla pacjentów wymagających ratowania. | |||
| †Średnia najmniejszych kwadratów skorygowana o wartość początkową. | |||
| do Wartość p <0,0001 w porównaniu do placebo + zwiększonego miana gliburydu | |||
| § Wartość p <0,05 w porównaniu do placebo + zwiększonego dawkowania gliburydu | |||
| Hemoglobina a1c (%) | N = 246 | N = 250 | N = 264 |
| Wartość początkowa (średnia) | 8.4 | 8.5 | 8.4 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −0.5 | −0.6 | +0.1 |
| Różnica w stosunku do zwiększonego miareczkowania gliburydu (skorygowana średnia†) | −0.6do | −0.7do | |
| 95% przedział ufności | (−0.8, −0.5) | (−0.9, −0.6) | |
| Odsetek pacjentów osiągających HbA1c <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Glukoza w osoczu na czczo (mg / dL) | N = 247 | N = 252 | N = 265 |
| Wartość początkowa (średnia) | 170 | 175 | 174 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −7 | −10 | +1 |
| Różnica w stosunku do zwiększonego miareczkowania gliburydu (skorygowana średnia†) | −8 § | −10 § | |
| 95% przedział ufności | (−14, −1) | (−17, −4) | |
| 2-godzinna glukoza poposiłkowa (mg / dl) | N = 195 | N = 202 | N = 206 |
| Wartość początkowa (średnia) | 309 | 315 | 323 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −31 | −34 | +8 |
| Różnica w stosunku do zwiększonego miareczkowania gliburydu (skorygowana średnia†) | −38 § | −42 § | |
| 95% przedział ufności | (−50, −27) | (−53, −31) |
Jednoczesne stosowanie z metforminą u pacjentów wcześniej nieleczonych
W tym 24-tygodniowym, randomizowanym badaniu z podwójnie ślepą próbą, kontrolowanym placebo, wzięło udział 1306 nieleczonych wcześniej pacjentów z cukrzycą typu 2 oceniać skuteczność i bezpieczeństwo produktu Onglyza podawanego jednocześnie z metforminą u pacjentów z nieodpowiednią kontrolą glikemii (A1C - 8% do - 12%) w diecie i ćwiczeniach sam. Aby wziąć udział w tym badaniu, pacjenci musieli być wcześniej nieleczeni.
Pacjenci, którzy spełnili kryteria kwalifikacyjne, zostali włączeni do fazy wstępnej dla pojedynczej ślepej, 1-tygodniowej diety i ćwiczeń. Pacjenci zostali losowo przydzieleni do jednego z czterech ramion leczenia: Onglyza 5 mg + metformina 500 mg, saksagliptyna 10 mg + metformina 500 mg, saksagliptyna 10 mg + placebo lub metformina 500 mg + placebo. Lek Onglyza podawano raz dziennie. W 3 grupach leczenia stosujących metforminę dawkę metforminy zwiększano co tydzień co 500 mg na dobę, zgodnie z tolerancją, do maksymalnie 2000 mg na dzień w oparciu o FPG. Pacjenci, którzy nie osiągnęli określonych celów glikemicznych podczas badań, byli leczeni pioglitazonem w ramach terapii uzupełniającej.
Jednoczesne podawanie produktu Onglyza w dawce 5 mg i metforminy zapewniło znaczną poprawę w zakresie A1C, FPG i PPG w porównaniu z placebo i metforminą (Tabela 7).
Tabela 7: Parametry glikemiczne w 24. tygodniu w kontrolowanym placebo badaniu jednoczesnego podawania produktu Onglyza z metforminą u pacjentów wcześniej nieleczonych
| Parametr skuteczności | Onglyza 5 mg + Metformina N = 320 |
Placebo + Metformina N = 328 |
|---|---|---|
| * Populacja zgodna z leczeniem, wykorzystująca ostatnią obserwację podczas badania lub ostatnią obserwację przed terapią ratunkową pioglitazonem u pacjentów wymagających ratowania. | ||
| †Średnia najmniejszych kwadratów skorygowana o wartość początkową. | ||
| do Wartość p <0,0001 w porównaniu z placebo + metforminą | ||
| § Wartość p <0,05 w porównaniu z placebo + metforminą | ||
| Hemoglobina a1c (%) | N = 306 | N = 313 |
| Wartość początkowa (średnia) | 9.4 | 9.4 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −2.5 | −2.0 |
| Różnica w stosunku do placebo + metforminy (skorygowana średnia†) | −0.5do | |
| 95% przedział ufności | (−0.7, −0.4) | |
| Odsetek pacjentów osiągających HbA1c <7% | 60% §(185/307) | 41% (129/314) |
| Glukoza w osoczu na czczo (mg / dL) | N = 315 | N = 320 |
| Wartość początkowa (średnia) | 199 | 199 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −60 | −47 |
| Różnica w stosunku do placebo + metforminy (skorygowana średnia†) | −13 § | |
| 95% przedział ufności | (−19, −6) | |
| 2-godzinna glukoza poposiłkowa (mg / dl) | N = 146 | N = 141 |
| Wartość początkowa (średnia) | 340 | 355 |
| Zmiana od wartości początkowej (skorygowana średnia†) | −138 | −97 |
| Różnica w stosunku do placebo + metforminy (skorygowana średnia†) | −41 § | |
| 95% przedział ufności | (−57, −25) |
Top
Jak dostarczone
Tabletki Onglyza ™ (saksagliptyna) mają oznaczenia po obu stronach i są dostępne w mocach i opakowaniach wymienionych w tabeli 8.
| Tablet siła |
Tabletka powlekana Kolor / kształt |
Tablet Znakowania |
wielkość paczki | Kod NDC |
|---|---|---|---|---|
| 5 mg | różowy dwuwypukłe, okrągłe |
„5” z jednej strony i „4215” z drugiej strony, niebieskim tuszem | Butelki po 30 Butelki 90 Butelki 500 Blister 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | jasnożółty do jasnożółtego dwuwypukłe, okrągłe |
„2,5” na jednej stronie i „4214” na drugiej stronie, niebieskim tuszem | Butelki po 30 Butelki 90 |
0003-4214-11 0003-4214-21 |
Składowania i stosowania
Przechowywać w temperaturze 20–25 ° C (68–77 ° F); wycieczki dozwolone do 15–30 ° C (59–86 ° F) [patrz temperatura pokojowa kontrolowana przez USP].
Top
Ostatnia aktualizacja: 07/09
E.R. Squibb & Sons, L.L.C.
Informacje o pacjencie Onglyza
Szczegółowe informacje na temat objawów, objawów, przyczyn, leczenia cukrzycy
Informacje w tej monografii nie mają na celu objąć wszystkich możliwych zastosowań, wskazówek, środków ostrożności, interakcji między lekami ani działań niepożądanych. Informacje te są uogólnione i nie są przeznaczone jako konkretne porady medyczne. Jeśli masz pytania dotyczące przyjmowanych leków lub chcesz uzyskać więcej informacji, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
wrócić do: Przeglądaj wszystkie leki na cukrzycę



